6.20: Tamaños Iónicos
- Page ID
- 75764
El tamaño de un ion se rige no sólo por su estructura electrónica sino también por su carga. Esta relación es evidente en la siguiente figura comparando los radios iónicos. Los iones en la primera fila de esta figura, H —, Li +, y Be 2 +, todos tienen la misma estructura electrónica de 1 s 2 que el átomo de helio (He), pero difieren en tamaño debido al diferente número de protones que cada uno tiene en su núcleo.
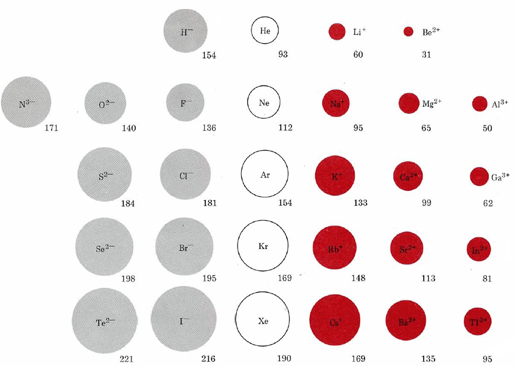
Se dice que las especies que tienen la misma estructura electrónica pero diferentes cargas son isoelectrónicas. Para cualquier serie electrónica, como H —, He, Li +, Be 2 +, en la que la carga nuclear aumenta en 1 cada vez, encontramos una disminución progresiva de tamaño debido a la atracción cada vez más fuerte del núcleo por la nube de electrones. Cada fila de la figura corresponde a una serie isoelectrónica que involucra una configuración diferente de electrones de gas noble-gas.
A medida que pasamos de los iones más negativos a los más positivos en cada fila, hay una disminución constante en el tamaño. Si bajamos alguna de las columnas, los tamaños iónicos aumentan debido al creciente número cuántico principal de los electrones más externos. Los tamaños de los cationes con carga individual, por ejemplo, aumentan en el siguiente orden: Li + < Na + < K + < Rb + < Cs +.
Otro punto de interés es el tamaño de un ion relativo al átomo a partir del cual se formó. Recordemos el diagrama de densidad de puntos electrónicos que muestra la formación de LiH. cuando el átomo de Li perdió su electrón y se convirtió en un ion Li +, su tamaño disminuyó drásticamente. La comparación de los radios atómicos con los radios iónicos anteriores revela que esto también es cierto para los otros metales alcalinos. Por ejemplo, echa un vistazo a la imagen de abajo, que compara los radios atómicos del elemento sin carga con su ion. A la izquierda se encuentran los cationes, que han perdido un electrón para convertirse en un ion y muestran disminuciones de tamaño.
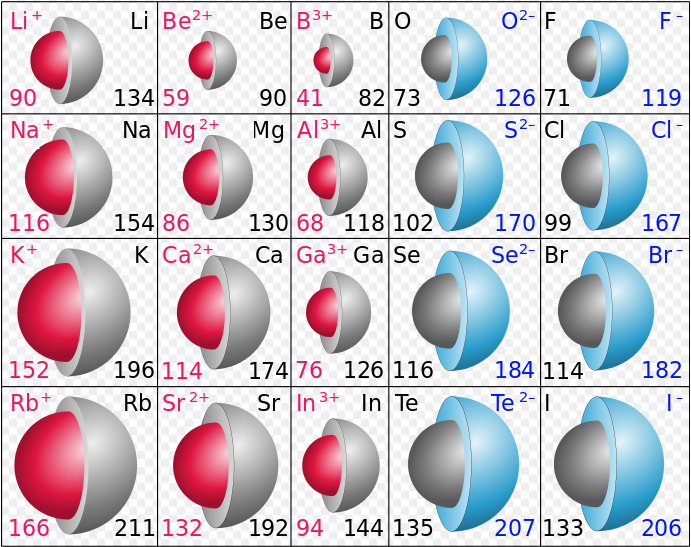
Crédito de la imagen: Por Popnose [CC BY-SA 3.0 (Creative Commons [creativecommons.org]) o GFDL (GNU [www.gnu.org])], vía Wikimedia Commons
En el lado derecho de la figura están los aniones, que se forman cuando un elemento gana un electrón. El electrón agregado, como se puede observar a partir del patrón anterior, aumenta los radios atómicos. Dado que el electrón agregado entra en una subcapa que ya tiene ocupantes, en lugar de comenzar en una nueva subcapa, a menudo hay muy pocos cambios de tamaño. Esto se ve claramente en el diagrama de densidad de puntos electrónicos mencionado anteriormente, donde la formación de un ion H — a partir de un átomo de H no produce un aumento perceptible de tamaño. Al comparar la figura de radios atómicos con los radios iónicos anteriores, también encontramos que los radios de van der Waals de los no metales son solo ligeramente más pequeños que los radios de sus aniones. Sin embargo, algunos iones aún experimentan cambios de tamaño bastante significativos, como se puede ver en la figura anterior (los aniones están en el lado derecho).
Los tamaños de los iones involucrados tienen una influencia considerable tanto en las propiedades químicas como físicas de los compuestos iónicos. Existe una fuerte correlación, por ejemplo, entre el tamaño iónico y el punto de fusión de un compuesto iónico. Entre los haluros de sodio el punto de fusión disminuye en el orden de NaF (995°C) > NaCl (808°C) > NaBr (750°C) > NaI (662°C). Cuanto mayor es el anión, más lejos está del ion sodio, y más débil es la fuerza culómbica de atracción entre ellos. De ahí que menor sea el punto de fusión. Cuando un catión muy pequeño se combina con un anión muy grande, es menos probable que el compuesto resultante exhiba las propiedades macroscópicas características de una sustancia iónica.


