7.2.1: Biología- Excepciones Biológicamente Activas a la Regla del Octeto
- Page ID
- 75010
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La teoría del octeto de Lewis predice correctamente las fórmulas para casi todos los compuestos iónicos y da cuenta de la mayoría de los esquemas de enlace covalente para moléculas biológicamente importantes. Pero los que son excepciones se encuentran entre los compuestos biológicamente más interesantes.
La teoría de Lewis se concentra en las semejanzas a los octetos de valencia de gas noble-gas ns 2 np 6. Por lo tanto, es más exitoso en contabilizar fórmulas de compuestos de los elementos representativos (especialmente en los periodos 1 y 2), cuyos electrones distintivos son también electrones s y p. La regla del octeto es mucho menos útil para tratar compuestos de los elementos de transición o elementos de transición internos, la mayoría de los cuales implican alguna participación de los orbitales d o f en la vinculación.
Incluso entre los elementos representativos hay algunas excepciones interesantes a la teoría de Lewis. Estos se agrupan principalmente en tres categorías:
- “Expanded Valence Shell” compuestos formados por elementos en el tercer periodo y por debajo de los cuales pueden acomodar más de un octeto de electrones. Si bien elementos como Si, P, S, Cl, Br y yo obedecemos la regla del octeto en muchos casos, bajo otras circunstancias forman más vínculos de los que permite la regla porque el tercer caparazón tiene orbitales s, pm y d.
- “Radicales Libres” que tienen electrones desapareados, como el mensajero biológico de vertebrados clave óxido nítrico, NO, que juega un papel en una variedad de procesos biológicos. El Premio Nobel de Medicina de 1998 fue otorgado por los descubrimientos relativos al óxido nítrico como molécula de señalización en el sistema cardiovascular.
- Los compuestos “deficientes en electrones” no tienen suficientes electrones para lograr octetos alrededor de todos los átomos, pero aún tienen moléculas estables. A menudo contienen Be, B o Al.
Expansión de Valence Shell
La fórmula estructural típica para ATP (trifosfato de adenosina) muestra tres enlaces simples y un doble enlace en el átomo de fósforo, para un total de 5 pares de electrones. Esto es posible porque P tiene orbitales 3d así como orbitales 3s y 3p para acomodar los electrones. La unión se muestra en el ion fosfato simple [PO 4] 3-:

Otros ejemplos de moléculas con más de un octeto de electrones son el pentafluoruro de fósforo (PF 5) y el hexafluoruro de azufre (SF 6). El pentafluoruro de fósforo es un gas a temperatura ambiente. Consiste en moléculas PF 5 en las que cada átomo de flúor está unido al átomo de fósforo. Dado que cada enlace corresponde a un par compartido de electrones, la estructura de Lewis esLa expansión de la capa de valencia es imposible para un átomo en el segundo periodo porque no existe tal cosa como un orbital de 2 d. La capa de valencia (n = 2) de nitrógeno, por ejemplo, consiste únicamente en las subcáscaras de 2 s y 2 d. Así, el nitrógeno puede formar NF 3 (en el que el nitrógeno tiene un octeto) pero no NF 5. El fósforo, por otro lado, forma tanto PF 3 como PF 5, este último implica la expansión de la concha de valencia para incluir parte de la subcubierta de 3 d.
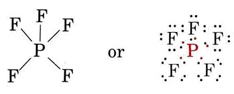
En lugar de un octeto el átomo de fósforo tiene 10 electrones en su caparazón de valencia. El hexafluoruro de azufre (también un gas) consiste en moléculas SF 6. Su estructura es
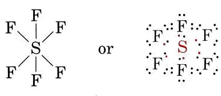
Aquí el átomo de azufre tiene seis pares de electrones en su caparazón de valencia.
Radicales Libres
Otra excepción a la regla del octeto ocurre en moléculas llamadas radicales libres. Estas moléculas contienen al menos un electrón desapareado, una clara violación de la regla del octeto. Los radicales libres juegan muchos papeles importantes en una amplia gama de campos de la química aplicada, incluyendo la biología y la medicina.
Óxido nítrico
El óxido nítrico, conocido como el 'factor relajante derivado del endotelio', o 'EDRF', es sintetizado en el cuerpo a partir de arginina y oxígeno por diversas enzimas y por reducción de nitrato inorgánico. Se libera por el revestimiento de los vasos sanguíneos, y hace que el músculo circundante se relaje, aumentando el flujo sanguíneo.
Durante la Primera Guerra Mundial, se encontró que los soldados que manejaban explosivos de nitroglicerina tenían presión arterial baja. Esto llevó al descubrimiento de que la nitroglicerina sirve como vasodilatador porque se convierte en óxido nítrico en el cuerpo. El sildenafilo, conocido popularmente por el nombre comercial Viagra, estimula las erecciones principalmente al mejorar la señalización a través de la vía del óxido nítrico en el pene. La terapia con óxido nítrico puede, en algunos casos, salvar la vida de los bebés con riesgo de enfermedad vascular pulmonar. Como se esperaba para un compuesto no octeto, el óxido nítrico es altamente reactivo (con una vida útil de unos pocos segundos), pero se difunde libremente a través de las membranas. Los niveles apropiados de producción de NO son importantes para proteger un órgano como el hígado del daño isquémico (constricción de los vasos sanguíneos).
Dióxido de nitrógeno
| Dióxido de nitrógeno, NO 2 es otro radical libre que es el componente marrón tóxico del smog. Se dimeriza parcialmente para alcanzar un octeto de Lewis:
-
- 2 NO 2 ↔ N 2 O 4
Vitamina E
Los eliminadores de radicales libres pueden ser biomoléculas antienvejecimiento importantes. Los radicales libres son generados por varios procesos naturales en el cuerpo, y si no se destruyen de inmediato, pueden atacar el ADN y otras moléculas críticas. Se ha afirmado que el α-tocoferol (Vitamina E) acepta rápidamente electrones de radicales libres producidos por la reacción en cadena de peroxidación lipídica, convirtiéndose en el | Radical Libre de Vitamina E.

y protegiendo el ADN.
Observe la similitud con el radical libre de hidróxido de 7 electrones, uno de los radicales libres dañinos (pero de corta duración) del cuerpo:
-
- •O-H
Oxígeno
La estructura de Lewis para Oxígeno suele ocultar el hecho de que es un “dirradical”, que contiene dos electrones desapareados. Esto a veces se cita como una falla grave en la teoría de los enlaces de Lewis, y fue un impulso importante para el desarrollo de la teoría orbital molecular.
El carácter paramagnético del oxígeno se mencionó anteriormente, y se demuestra fácilmente por la atracción del oxígeno a un imán externo.
Compuestos deficientes en electrones
Los elementos berilio, boro y aluminio son conocidos por formar compuestos “deficientes en electrones” (con menos de los típicos 8 electrones de valencia). Esto les da propiedades especiales en química bioquímica sintética y orgánica, pero casi siempre reaccionan para formar especies que obedecen a la regla del octeto de Lewis en los sistemas bioquímicos.
Berilio
Un buen ejemplo es el dicloruro de berilio, BeCl 2, que se funde a 405°C y hierve a 520°C, lo que se compara con 714°C y 1412°C para el cloruro de magnesio. Las moléculas individuales de BeCl 2 solo existen en la fase gaseosa por encima de 750°C:
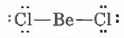
En lugar de un octeto, el caparazón de valencia de Be contiene sólo dos pares de electrones. Es reactivo porque no tiene el octeto, y al enfriarse, forma moléculas que sí, donde los átomos de Cl donan un par de sus electrones no enlazantes a un átomo Be vecino para que puenteen dos átomos Be, satisfaciendo la valencia de ambos:

Pero la toxicidad extremadamente alta del berilio probablemente se deba a especies iónicas, y el [pillsm.com/? a=7539 | Prueba de Proliferación de Linfocitos de Berilio en Sangre] utiliza sulfato de berilio, un compuesto iónico típico de Be 2+ (aq), o Be (H 2) 4 2—:, para imitar lo biológico forma de berilio.
El berilio también puede adquirir y octeto por formación de “enlaces covalentes coordinados”, aceptando ambos electrones en el enlace de otra especie. Así, BeCl 2 reacciona con Cl — iones u OH — iones en condiciones normales para formar BeCl 4 2 — o Be (OH) 4 2—:

Boro
Se pueden aplicar argumentos similares al tricloruro de boro, BCl3, que es un gas estable a temperatura ambiente. Nos vemos obligados a escribir su estructura como

en el que la capa de valencia del boro tiene sólo tres pares de electrones. Las moléculas como BeCl 2 y Bcl3 se denominan deficientes en electrones porque algunos átomos no tienen octetos completos. BCl 3 reacciona con NH 3 de la siguiente manera:
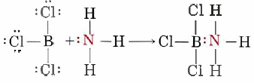
Nuevamente, los compuestos de boro más estables en condiciones normales siguen la regla de Lewis: El ácido bórico, H 3 BO 3 se usa tradicionalmente como insecticida, notablemente contra hormigas, pulgas y cucarachas, pero es tan inocuo como la sal para los humanos, como lo son los boratos, que contienen el BO 4 2 — ion.
Aluminio
El Cloruro de Aluminio es un compuesto covalente de bajo punto de fusión que existe como AlCl 3 solo en fase gaseosa. Debido a que solo tiene 6 electrones en su estructura de Lewis, reacciona con donantes de pares de electrones como el agua:
- AlCl 3 + H 2 O → [Al (H 2 O) 6] 3+ + 3 Cl 1 -


