7.2: Excepciones a la Regla del Octeto
- Page ID
- 74998
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Considerando la tremenda variedad de propiedades de elementos y compuestos en el sistema periódico, se está pidiendo mucho esperar una regla tan simple como la teoría del octeto de Lewis para poder predecir todas las fórmulas o dar cuenta de todas las estructuras moleculares que involucran enlaces covalentes. La teoría de Lewis se concentra en las semejanzas a los octetos de valencia de gas noble-gas ns 2 np 6. Por lo tanto, es más exitoso en contabilizar fórmulas de compuestos de los elementos representativos, cuyos electrones distintivos son también electrones s y p. La regla del octeto es mucho menos útil para tratar compuestos de los elementos de transición o elementos de transición internos, la mayoría de los cuales implican alguna participación de los orbitales d o f en la vinculación.
Incluso entre los elementos representativos hay algunas excepciones a la teoría de Lewis. Estos se clasifican principalmente en tres categorías:
- Algunas moléculas estables simplemente no tienen suficientes electrones para lograr octetos alrededor de todos los átomos. Esto suele ocurrir en compuestos que contienen Be o B.
- Los elementos en el tercer periodo y por debajo pueden acomodar más de un octeto de electrones. Si bien elementos como Si, P, S, Cl, Br y yo obedecemos la regla del octeto en muchos casos, bajo otras circunstancias forman más vínculos de los que la regla permite.
- Radicales Libres
Especies deficientes en electrones
Buenos ejemplos del primer tipo de excepción son proporcionados por BeCl 2 y BcL 3. El dicloruro de berilio, BeCl 2, es una sustancia covalente más que iónica. El BeCl 2 sólido tiene una estructura relativamente compleja a temperatura ambiente, pero cuando se calienta a 750°C, se obtiene un vapor que consiste en moléculas separadas de BeCl 2. Dado que los átomos de Cl no forman fácilmente múltiples enlaces, esperamos que el átomo Be esté unido a cada átomo de Cl por un enlace sencillo. La estructura es

En lugar de un octeto la concha de valencia de Be contiene sólo dos pares de electrones. Se pueden aplicar argumentos similares al tricloruro de boro, BCl3, que es un gas estable a temperatura ambiente. Nos vemos obligados a escribir su estructura como

en el que la capa de valencia del boro tiene sólo tres pares de electrones. Las moléculas como BeCl 2 y Bcl3 se denominan deficientes en electrones porque algunos átomos no tienen octetos completos. Las moléculas deficientes en electrones suelen reaccionar con especies que contienen pares solitarios, adquiriendo octetos mediante la formación de enlaces covalentes coordinados. Así, BeCl 2 reacciona con iones Cl — para formar BeCl 4 —;

BCl 3 reacciona con NH 3 de la siguiente manera:

Especies con Octetos Ampliados
Ejemplos de moléculas con más de un octeto de electrones son el pentafluoruro de fósforo (PF 5) y el hexafluoruro de azufre (SF 6). El pentafluoruro de fósforo es un gas a temperatura ambiente. Consiste en moléculas PF 5 en las que cada átomo de flúor está unido al átomo de fósforo. Dado que cada enlace corresponde a un par compartido de electrones, la estructura de Lewis es
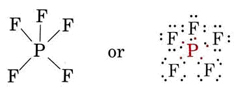
En lugar de un octeto el átomo de fósforo tiene 10 electrones en su caparazón de valencia. El hexafluoruro de azufre (también un gas) consiste en moléculas SF 6. Su estructura es

Aquí el átomo de azufre tiene seis pares de electrones en su caparazón de valencia.
Se dice que un átomo como el fósforo o azufre que tiene más de un octeto ha expandido su caparazón de valencia. Esto sólo puede ocurrir cuando el caparazón de valencia tiene suficientes orbitales para acomodar los electrones adicionales. Por ejemplo, en el caso del fósforo, la concha de valencia tiene un número cuántico principal n = 3. Un octeto sería 3 s 2 3 p 6. Sin embargo, la subcapa de 3 d también está disponible, y algunos de los orbitales de 3 d también pueden estar involucrados en la unión. Esto permite que el par extra de electrones ocupe la capa de valencia (n = 3) del fósforo en PF 5.
La expansión del caparazón de valencia es imposible para un átomo en el segundo periodo porque no existe tal cosa como un orbital de 2 d. La capa de valencia (n = 2) de nitrógeno, por ejemplo, consiste únicamente en las subcáscaras de 2 s y 2 p. Así, el nitrógeno puede formar NF 3 (en el que el nitrógeno tiene un octeto) pero no NF 5. El fósforo, por otro lado, forma tanto PF 3 como PF 5, este último implica la expansión de la concha de valencia para incluir parte de la subcapa de 3 d.
Radicales Libres
Se demuestra que la mayoría de las moléculas o iones complejos discutidos en los cursos de química general tienen pares de electrones. Sin embargo, hay algunas moléculas estables que contienen un número impar de electrones. Estas moléculas, llamadas “radicales libres”, contienen al menos un electrón desapareado, una clara violación de la regla del octeto. Los radicales libres juegan muchos papeles importantes en una amplia gama de campos de la química aplicada, incluida la biología, la medicina y la astroquímica.
Tres ejemplos bien conocidos de tales moléculas son el óxido de nitrógeno (II), el óxido de nitrógeno (IV) y el dióxido de cloro. Las estructuras de Lewis más plausibles para estas moléculas son

Los radicales libres suelen ser más reactivos que la molécula promedio en la que se emparejan todos los electrones. En particular tienden a combinarse con otras moléculas para que su electrón desapareado encuentre un compañero de espín opuesto. Dado que la mayoría de las moléculas tienen todos los electrones emparejados, tales reacciones suelen producir un nuevo radical libre. Esta es una de las razones por las que las emisiones de automóviles que provocan que incluso pequeñas concentraciones de NO y NO 2 estén presentes en el aire pueden ser un grave problema de contaminación. Cuando uno de estos radicales libres reacciona con otras emisiones de automóviles, el problema no desaparece. En cambio, se produce un radical libre diferente que es tan reactivo como el que se consumió. Para empeorar las cosas, cuando la luz solar interactúa con NO 2, produce dos radicales libres por cada uno destruido:

De esta manera se empeora mucho un problema malo.
Un cuarto ejemplo muy interesante de un radical libre es el gas oxígeno. La estructura de Lewis para Oxígeno suele ocultar el hecho de que es un “dirradical”, que contiene dos electrones desapareados. Esto a menudo se cita como una falla grave en la teoría de los enlaces de Lewis, y fue un impulso importante para el desarrollo de la teoría orbital molecular. Sabemos que el oxígeno es un dirradical por su carácter paramagnético, que se demuestra fácilmente por la atracción del oxígeno a un imán externo.


