8.5: Compuestos Orgánicos- Hidrocarburos
- Page ID
- 75699
El carbono es único entre los elementos de la tabla periódica debido a la capacidad de sus átomos para formar fuertes enlaces entre sí sin dejar de tener una o más valencias sobrantes para vincularse a otros átomos. La fuerza del enlace carbono-carbono permite que las cadenas largas formen:
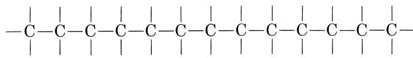
Este comportamiento se conoce como catenación. Dicha cadena contiene numerosos sitios a los que pueden unirse otros átomos (o más átomos de carbono), lo que lleva a una gran variedad de compuestos de carbono, o compuestos orgánicos. Los hidrocarburos contienen solo hidrógeno y carbono. Proporcionan los ejemplos más simples de cómo la catenación, combinada con la valencia de carbono de 4, da lugar a una tremenda variedad de estructuras moleculares, incluso con solo dos elementos involucrados. Los hidrocarburos de enlace simple se llaman alcanos. Un ejemplo de alcano es butano:
Butano
Estos hidrocarburos pueden estar en cadenas rectas de longitud variable, o pueden ramificarse, con un carbono unido a otros tres o cuatro carbonos. Esto permite que los isómeros, como el isobutano, un hidrocarburo ramificado:
Isobutano
Los hidrocarburos también pueden formar estructuras de anillo, que se conocen como cicloalcanos. Un ejemplo es el ciclohexano:
Ciclohexano
Los carbonos son capaces de formar enlaces dobles y triples con otros carbonos. Esto lleva a moléculas llamadas alquenos, que contienen un doble enlace, y alquinos, que contienen un triple enlace. Un ejemplo de un alqueno es eteno (etileno), y un ejemplo de un alquino es etino (acetileno):
Eteno
Ethyne
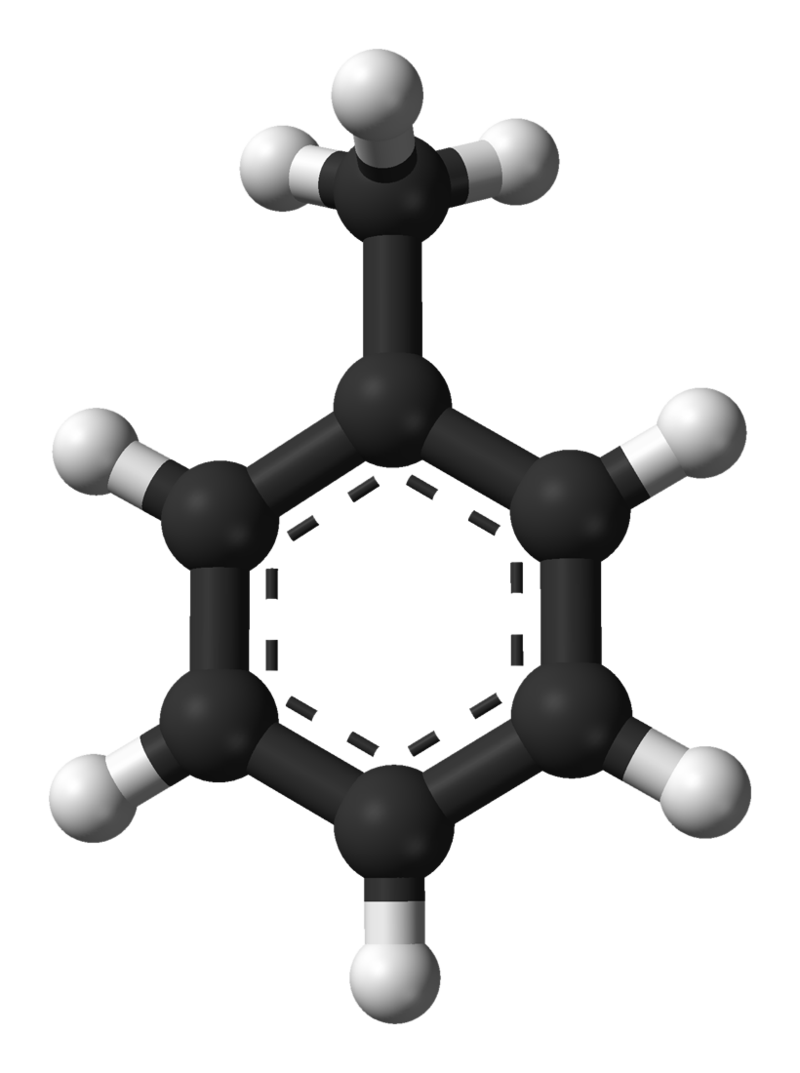
En conjunto, se les conoce como hidrocarburos insaturados, ya que hay menos átomos de hidrógeno en la molécula debido a múltiples enlaces en comparación con los alcanos. Una clase especial de hidrocarburos de enlace múltiple son los hidrocarburos aromáticos, todos los cuales toman la forma de estructuras de anillos hidrocarbonados con dobles enlaces entre los carbonos. El benceno es un ejemplo:
Benceno
Los hidrocarburos también son sumamente importantes desde el punto de vista económico y geopolítico. Los combustibles fósiles, el carbón, el petróleo (o petróleo crudo) y el gas natural consisten principalmente en hidrocarburos y son extremadamente importantes en la vida cotidiana. El petróleo resulta ser una mezcla de muchos hidrocarburos diferentes. Moléculas de diferentes tamaños son útiles para diferentes tareas. El siguiente esquema de destilación fraccionada de petróleo muestra los diferentes tipos de fracciones de hidrocarburos tomadas del petróleo.
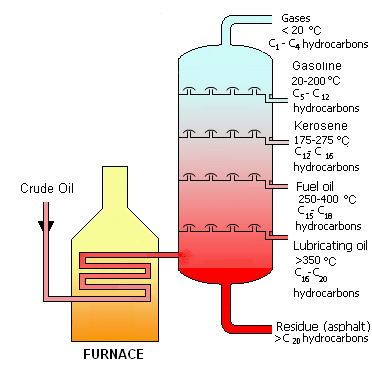
A continuación se presenta una breve descripción de las diferentes fracciones del petróleo [1].
Gases (Naturales)
La fracción gaseosa contiene hidrocarburos que contienen de 1 a 4 átomos de carbono en cada molécula. Estos pueden ser utilizados para combustibles. Otro uso es derivar materiales tales como plásticos y fibras sintéticas a partir de dichos hidrocarburos, realizados por técnicas de polimerización. A continuación se da un ejemplo, propano:
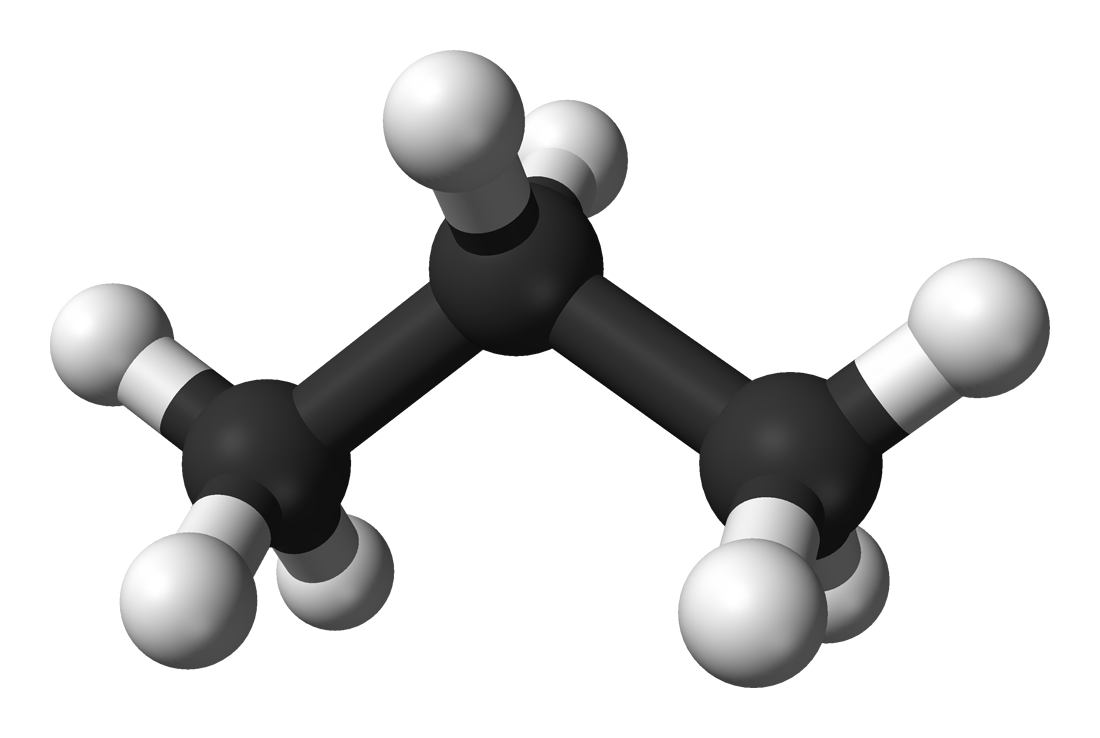
Modelo de bola y varilla de propano
Gasolina
Probablemente el más familiar de los destilados de hidrocarburos es la gasolina. La gasolina consiste en hidrocarburos con 5 a 12 átomos de carbono en cada molécula. Es difícil exagerar la importancia de la gasolina para la sociedad moderna, dado el papel central de los viajes en automóvil en nuestra sociedad. La gasolina también sirve como solvente industrial. Un ejemplo de un hidrocarburo que se encuentra en la gasolina es el tolueno:
Modelo de bola y barra de la molécula de tolueno, C7H8, tal como se encuentra en la estructura cristalina. Datos cristalográficos de rayos X de J. Chim. Phys. Phys. -Chim. Biol. (1977) 74, 68-73.
Queroseno
El queroseno consiste en hidrocarburos que contienen entre 12 y 16 átomos de carbono por molécula. Los principales usos del queroseno son como aceite de lámpara, combustible diesel, y para craqueo catalítico, un proceso discutido en la sección sobre hidrocarburos insaturados. Esto permite que estos hidrocarburos más grandes se descompongan a un tamaño que pueda usarse para gasolina. Un ejemplo de un hidrocarburo que estaría en la fracción de queroseno es el tetradecano:
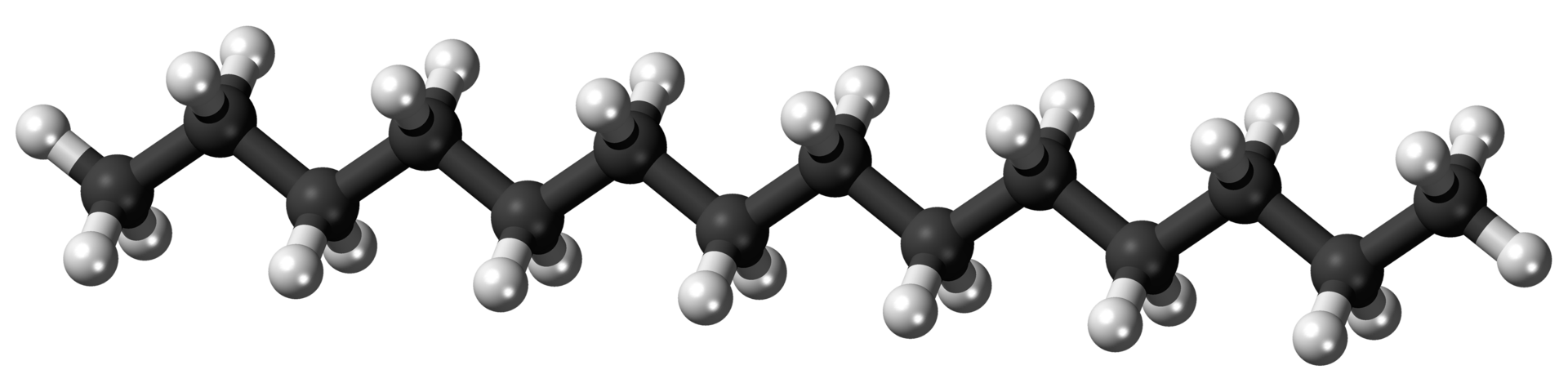
Modelo de bola y varilla de la molécula de tetradecano
Fuel Oil
Los Fuel Oil consisten en hidrocarburos que oscilan entre 15 y 18 átomos de carbono por molécula. Al igual que el queroseno, este destilado se utiliza para calentar aceite, para combustible diesel y para craqueo catalítico. Un ejemplo es el hexadecano:
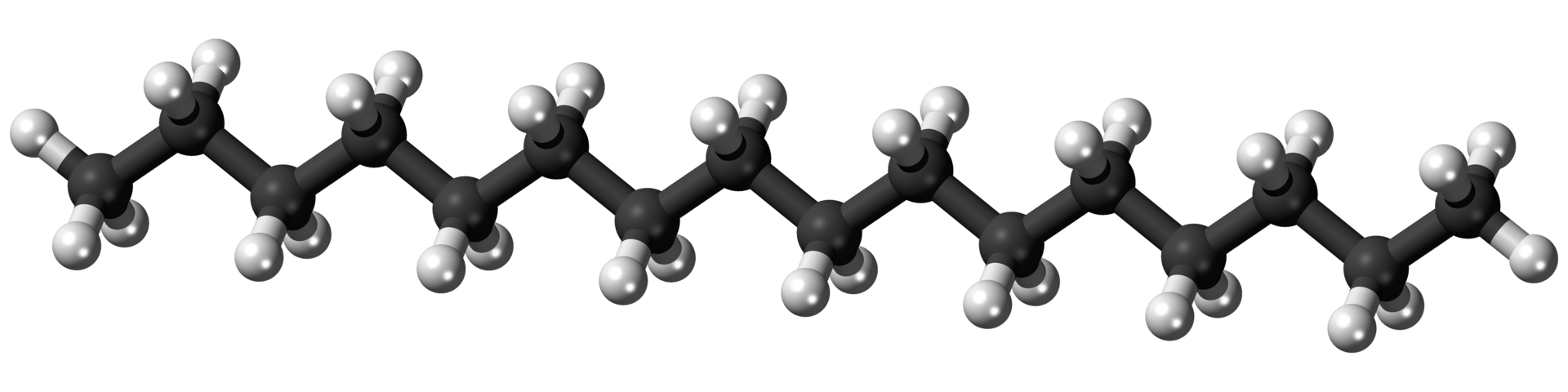
Modelo de bola y varilla de la molécula de hexadecano
Aceite Lubricante
Los aceites lubricantes constan de 16 a 20 átomos de carbono por molécula de hidrocarburo. Denominados a veces como aceite mineral, los aceites lubricantes se utilizan para disminuir la fricción entre las partes móviles. Quizás la aplicación más familiar es el aceite de motor. Un ejemplo de un hidrocarburo en el rango de tamaño para el aceite lubricante es el eicosano:
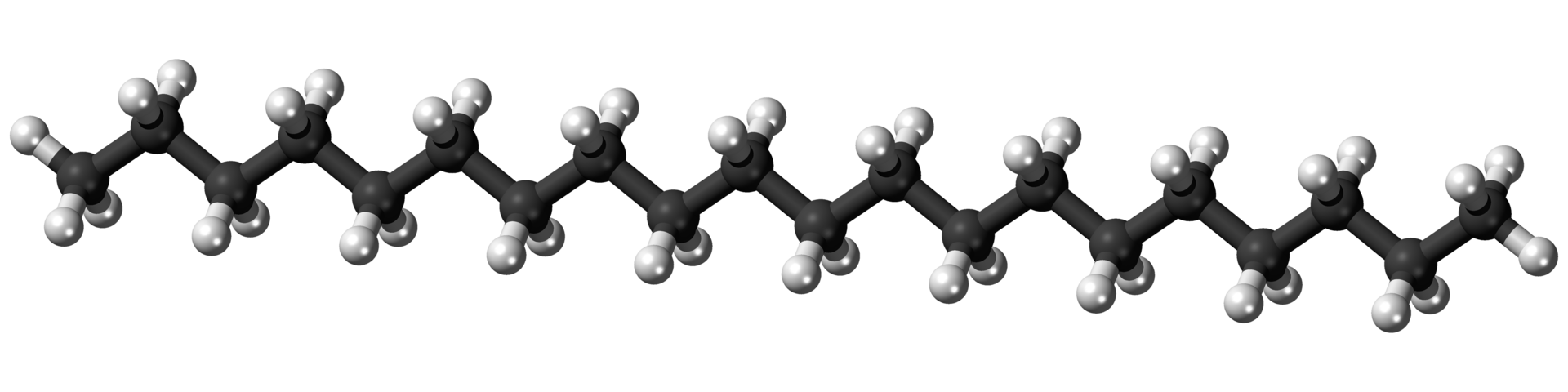
Modelo de bola y palo de la molécula icosane
Residuos (asfalto)
Los hidrocarburos que no se hierven permanecen después de la destilación como hidrocarburos con más de 20 átomos de carbono por molécula. Estos hidrocarburos pueden ser utilizados como asfalto. Un ejemplo es tetracosano:
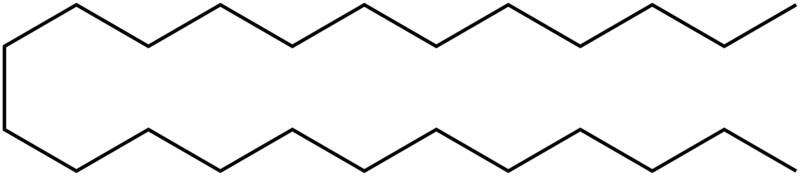
estructura química del tetracosano
- Moore, J.W.; Stanitski, C.L.; Jurs, P.C. Chemisty:The Molecular Science. 3a edición. Thompson Brooks/Cole. 2008. 546-547.


