8.11: Enlace de Hidrógeno- Agua
- Page ID
- 75773
Parecería que las fuerzas londinenses y las fuerzas dipolares discutidas en las secciones anteriores de este capítulo deberían ser adecuadas para dar cuenta de las propiedades macroscópicas de las sustancias unidas covalentemente. Ciertamente se pueden aplicar con éxito a los hidrocarburos y a muchas sustancias polares. Hay algunos datos experimentales, sin embargo, que no pueden ser explicados por las fuerzas londinenses y dipolares por sí solas. A continuación aparece un ejemplo, donde se trazan los puntos de ebullición para los compuestos de hidrógeno (hidruros) de la mayoría de los no metales.
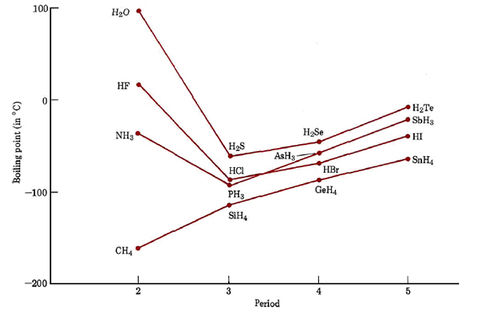
Los hidruros de los elementos en el quinto periodo se comportan como podríamos predecir. SnH 4, que consiste en moléculas no polares, hierve a la temperatura más baja. SbH 3, H 2 Te e HI, todos los cuales son polares, tienen puntos de ebullición algo más altos, pero todos se encuentran dentro de un rango de 50°C; un comportamiento similar ocurre entre los hidruros de los elementos en el cuarto y tercer período. En el segundo periodo, sin embargo, los hidruros polares NH 3, H 2 O y HF tienen puntos de ebullición superiores a 100°C por encima del compuesto no polar CH 4. Claramente, estos hidruros de la segunda fila deben tener fuerzas intermoleculares particularmente fuertes.
Para ver por qué sucede esto, consideremos el hidrido de segunda fila más simple: HF. Supongamos que dos moléculas de HF se acercan entre sí, como se muestra en la siguiente figura. En cada molécula de HF, el núcleo de hidrógeno está bastante mal protegido por una delgada nube de electrones (solo dos electrones), y gran parte de esa nube de electrones se ha distorsionado hacia el átomo de flúor altamente electronegativo.
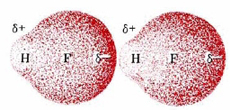
En consecuencia, el núcleo de hidrógeno en el HF de la derecha puede acercarse mucho más al lado flúor de la molécula izquierda que cualquier otro tipo de núcleo. Además, debido a que el flúor es tal átomo electronegativo, su carga negativa parcial es particularmente grande. La fuerza de atracción entre los electrones del flúor de la izquierda y el núcleo de hidrógeno de la derecha será inusualmente fuerte, y habrá una distorsión considerable de las nubes de electrones. Se desarrolla algún carácter de enlace covalente entre el flúor en una molécula y el hidrógeno en la otra.
El acercamiento cercano de los extremos con carga opuesta de los dipolos moleculares se combina con este pequeño grado de carácter de enlace covalente para producir una fuerza intermolecular anormalmente fuerte llamada enlace de hidrógeno. Para que se produzcan enlaces de hidrógeno, debe haber un átomo de hidrógeno conectado a un átomo pequeño y altamente electronegativo (generalmente flúor, oxígeno o nitrógeno) en una molécula. La otra molécula debe tener un átomo muy electronegativo (nuevamente generalmente flúor, oxígeno o nitrógeno) que tenga uno o más pares solitarios de electrones. La separación de dos moléculas unidas por un enlace de hidrógeno requiere de 10 a 30 kJ mol —1, aproximadamente 10 veces la energía necesaria para superar las fuerzas dipolares. Por lo tanto, los enlaces de hidrógeno pueden explicar los puntos de ebullición inusualmente altos de NH 3, H 2 O y HF.
Los enlaces de hidrógeno entre las moléculas de HF son particularmente evidentes en HF sólido, donde los átomos están dispuestos en un patrón en zigzag:
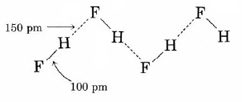
Aquí la distancia entre los núcleos de hidrógeno y flúor en diferentes moléculas es de sólo 150pm. Si agregamos los radios de van der Waals para hidrógeno y flúor, obtenemos una distancia esperada de hidrógeno a flúor de (120 + 135) pm = 255pm, más de 100pm mayor a la observada. Obviamente los átomos de hidrógeno y flúor en las moléculas adyacentes no son solo “conmovedores”, sino que deben asociarse de una manera mucho más íntima.
Redefinición provisional del enlace de hidrógeno
Un grupo de trabajo de la Unión Internacional de Química Pura y Aplicada (IUPAC) propone una redefinición del enlace de hidrógeno:
“El enlace de hidrógeno es una interacción atractiva entre un átomo de hidrógeno de una molécula o un fragmento molecular X-H en el que X es más electronegativo que H, y un átomo o un grupo de átomos en la misma o en una molécula diferente, en la que hay evidencia de formación de enlaces”. [1]
Esta redefinición propuesta incluiría muchas más situaciones en las que los enlaces de hidrógeno parecen ser importantes, incluyendo los casos en los que el átomo de hidrógeno es atraído por átomos distintos de F, O y N. Por ejemplo, parece haber una atracción entre los electrones de la subcapa d en el átomo central de platino en el que se muestra en la Figura siguiente, y los átomos de hidrógeno de un grupo H 2 O o NH 3 adyacente en un complejo de platino adyacente [2].
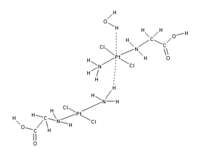
La nueva formulación reconoce que el enlace de hidrógeno puede tener algún carácter covalente [3] [4]. Reconoce que los enlaces de hidrógeno pueden ser significativos en H 2 S a presiones más altas y bajas temperaturas, o que se puede formar un “enlace dihidrógeno” (donde hidruros metálicos como LiH son los aceptores de enlaces H).
Referencias
- media.iupac.org/reports/provisional/abstracto11/arunan_310311.html
- Kozelka, J. et al, Angew. Chem. Int. Ed., DOI:10.1002/anie.201001892
- Enlace de hidrógeno [es.wikipedia.org]
- Kemsley, Jyllian, “Formación de enlaces de hidrógeno”, Chemical & Engineering News, 22 de noviembre de 2010, p. 32


