21.1: Preludio a la Espectroscopia
- Page ID
- 75221
En los siguientes apartados vamos a estudiar la manera en que la materia puede absorber energía y emitirla en forma de radiación electromagnética como la luz. El patrón en el que la materia absorbe o emite radiación se llama su espectro. En el pasado, y aún hasta el día de hoy, los estudios del espectro de una sustancia han proporcionado pistas importantes sobre la estructura de la materia. Al mismo tiempo, el espectro de una sustancia suele ser una forma muy útil de caracterizar y de ahí identificar y analizar esa sustancia.
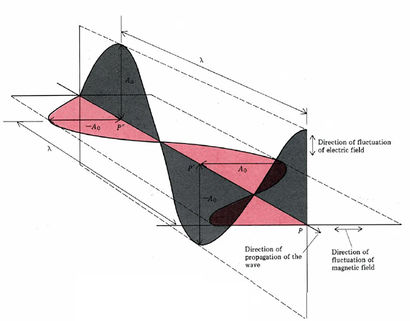
Muchas de las propiedades de la radiación electromagnética pueden explicarse si la luz es pensada como campos eléctricos y magnéticos que varían periódicamente (ondas electromagnéticas). Dichas ondas pueden caracterizarse por su frecuencia v o su longitud de onda λ, y su velocidad de propagación es siempre λ v = c = 2.998 × 10 8 m s —1. Algunas propiedades de la luz se explican más fácilmente en términos de partículas llamadas fotones. La energía de un fotón viene dada por E = hv, donde h = 6.626 × 10 —34 J s y se llama constante de Planck.
Cuando cualquier elemento se calienta a una temperatura alta o se excita en un tubo de descarga, da un espectro de línea. Niels Bohr fue capaz de predecir las longitudes de onda de las líneas en el espectro del hidrógeno mediante una teoría que asignó el electrón único a niveles de energía específicos y, por lo tanto, a órbitas de radio específico. La absorción de una cantidad apropiada de energía puede elevar el átomo de hidrógeno de un nivel de energía menor a uno superior, mientras que la emisión de radiación electromagnética corresponde a un cambio de un nivel de energía superior a uno más bajo. Aunque la teoría de Bohr es cuantitativamente precisa solo para el hidrógeno, su idea de los niveles de energía es útil para todos los demás átomos e incluso para las moléculas.
En el caso de las moléculas, los niveles de energía surgen debido a diferentes velocidades y tipos de vibraciones moleculares y rotaciones, así como porque los electrones se mueven más lejos o más cerca de núcleos cargados positivamente. En los compuestos orgánicos algunos grupos de átomos vibran a casi la misma frecuencia sin importar en qué molécula se encuentren. Los niveles de energía de tales vibraciones generalmente difieren aproximadamente por las energías de los fotones infrarrojos, y muchos grupos funcionales orgánicos pueden identificarse por las frecuencias características a las que absorben la radiación infrarroja. Cuando las moléculas absorben luz visible o ultravioleta, se producen espectros de banda. Parte de la energía de cada fotón absorbido va a excitar un electrón, pero cantidades variables también aumentan las energías vibracionales y rotacionales. Así, los fotones son absorbidos en un amplio rango de frecuencias y longitudes de onda.
La teoría más conveniente mediante la cual se pueden predecir las energías electrónicas de las moléculas es la teoría molecular-orbital. Se supone que los electrones en una molécula ocupan orbitales que no están confinados a un solo átomo sino que se extienden por toda la molécula. Los orbitales moleculares de unión implican interferencia constructiva entre dos ondas de electrones, mientras que los orbitales moleculares antiadherentes implican interferencia destructiva. Un electrón que ocupa un MO antienlace es mayor en energía de lo que sería si los átomos no estuvieran unidos entre sí, por lo que los electrones antiadherentes cancelan el efecto de unir electrones. Esto explica por qué no se forman moléculas como He 2 o Ne 2.
La teoría molecular-orbital es especialmente útil en el tratamiento de moléculas para las que se deben dibujar estructuras de resonancia. Debido a que los orbitales moleculares pueden deslocalizarse sobre varios átomos, no hay necesidad de varias estructuras de resonancia en el caso de moléculas como O 3 y C 6 H 6. Cuanto mayor sea el grado de deslocalización de electrones, menor será la separación entre los niveles de energía molecular y mayor será la longitud de onda a la que puede ocurrir la absorción de luz ultravioleta o visible. Así, los compuestos que contienen cadenas largas de enlaces simples y dobles alternos o que tienen varios anillos de benceno conectados entre sí a menudo absorben la luz visible y son coloreados.


