21.9: Sistemas Conjugados
- Page ID
- 75220
En algunas moléculas la deslocalización de los pares de electrones puede ser mucho más extensa que en el ozono y el benceno. Esto es particularmente cierto para los compuestos de carbono que contienen cadenas conjugadas, es decir, cadenas largas de enlaces simples y dobles alternantes. Un ejemplo es proporcionado por la vitamina A 2 que tiene la estructura
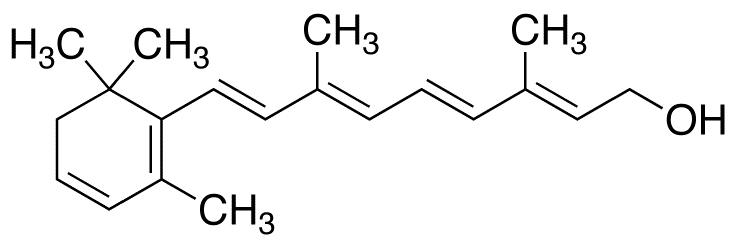
Tanto las propiedades físicas como químicas de esta molécula indican que todos los enlaces en la cadena conjugada (mostrados en color) son de carácter intermedio entre enlaces simples y dobles y que los electrones pi son libres de moverse sobre toda la longitud de la cadena conjugada.
Un método muy simple, aunque aproximado, de manejar matemáticamente electrones deslocalizados es tratarlos como si fueran partículas en una caja unidimensional de la misma longitud que la cadena. En el caso de la vitamina A2 la distancia desde el átomo de carbono en un extremo de la cadena conjugada hasta el del otro es de aproximadamente 1210pm. Si alimentamos este valor y la masa del electrón (9.110 × 10-31 kg) en la fórmula de partícula en caja (Ecuación\(\ref{1}\)), podemos obtener valores aproximados de los niveles de energía ocupados por los electrones deslocalizados:
\[E_{k}=\dfrac{1}{2m}\left(\dfrac{nh}{2d}\right)^{2}=\dfrac{1}{2\times9.110\times10^{-31} \text{ kg}}\left(\dfrac{n\times6.626\times10^{-34} \text{J s }}{2\times 1210\times 10^{-12} \text{ m}}\right) ^{2} \label{1} \]
\[E_{k}=n^{2}(4.11\times10^{-20} \text{ J}) \label{2} \]
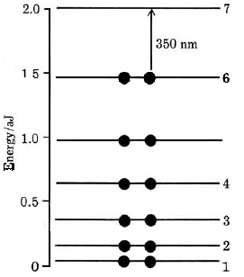
Los primeros siete niveles de energía derivados de esta fórmula se muestran en la Figura\(\PageIndex{2}\). Tenga en cuenta que dado que hay 12 electrones pi (uno por cada átomo de carbono en la cadena conjugada), estos ocuparán los seis niveles más bajos de acuerdo con el principio Pauli.
Este modelo nos permite calcular la longitud de onda de la banda de absorción principal en el espectro de la vitamina A 2. Si un electrón del nivel ocupado más alto (n = 6) se excita al nivel desocupado más bajo (n = 7), la energía requerida se puede calcular a partir de la Ecuación\(\ref{2}\):
\[\Delta E = E_{7}-E_{6}=(7^{2}-6^{2})\times4.11\times10^{-20} \text{ J}=5.34\times10^{-19} \text{ J} \nonumber \]
Así
\[ λ = \dfrac{hc}{\Delta E} = \dfrac{6.626\times10^{-34} \text{ Js}\times2.998\times0^{8} \text{ ms}^{-1}}{5.34\times10^{-19} \text{ J}} = 327 \text{ nm} \nonumber \]
Esto está en concordancia razonable con el valor observado de 350 nm, considerando la naturaleza aproximada del modelo.
Como regla general, cuanto más larga sea una cadena conjugada, mayor será la longitud de onda a la que absorbe. El eteno (C 2 H 4), por ejemplo, tiene solo un doble enlace y absorbe a 170 nm. El hexatrieno (C 6 H 8) tiene tres dobles enlaces alternos y absorbe a 265 nm, mientras que la vitamina A 2, con seis dobles enlaces, absorbe a 350 nm. No es difícil explicar este efecto en términos del modelo particle-in-a-box. Según\(\ref{1}\) la Ecuación la energía de un nivel varía inversamente con el cuadrado de la longitud de la caja. Así, cuanto más larga sea la cadena conjugada, más cerca estarán los niveles de energía entre sí, y menos energía necesitará un fotón para excitar un electrón. Naturalmente, cuanto menor sea la energía de un fotón, más larga será su longitud de onda.
Un efecto similar se encuentra para las moléculas que contienen varios anillos de benceno. Dado que estos corresponden a fórmulas de Lewis de enlaces dobles y simples alternantes, también pueden considerarse como sistemas conjugados que contienen electrones deslocalizados. Experimentalmente encontramos que cuantos más anillos de benceno contenga una molécula, más largas serán las longitudes de onda a las que absorbe:
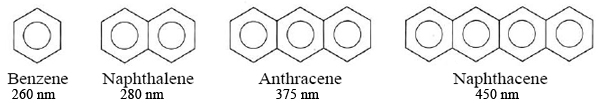
Así, aumentando la extensión de la deslocalización de electrones aumenta la longitud de onda a la que una molécula absorberá la luz, ya sea que el electrón esté deslocalizado sobre anillos o cadenas.
Este comportamiento de los electrones deslocalizados es importante en la preparación de compuestos que absorben fuertemente la luz visible, es decir, en la preparación de colorantes. Muy pocos compuestos que se mantienen unidos solo por enlaces sigma están coloreados. Los electrones están tan apretados que se necesita un fotón muy energético para excitarlos. Para que una molécula orgánica se absorba en la región visible del espectro, generalmente debe contener electrones pi muy deslocalizados. Así, la mayoría de los colorantes y compuestos de color que ocurren en los organismos vivos resultan ser moléculas grandes con extensos sistemas de dobles enlaces conjugados.


