21.8: Electrones deslocalizados
- Page ID
- 75228
Uno de los aspectos más útiles de la teoría molecular-orbital solo se hace evidente cuando consideramos moléculas que contienen tres o más átomos. Según la teoría molecular-orbital, los electrones ocupan orbitales deslocalizados. Es decir, los orbitales se extendieron por toda la molécula. Un electrón no se limita solo a la proximidad de uno o dos núcleos atómicos como en los pares solitarios y pares de enlaces de la teoría de valencia-enlace. Como se ve en la sección de Resonancia, existen algunas moléculas, como O 3 y C 6 H 6, las cuales no pueden ser descritas adecuadamente por un solo diagrama de Lewis. En tales casos, la teoría de valencia-enlace recurre a híbridos de resonancia, como
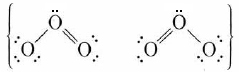
para ozono. Las mismas moléculas pueden ser manejadas por la teoría MO sin la necesidad de varias estructuras contribuyentes, ya que los electrones pueden ocupar orbitales pertenecientes a la molécula en su conjunto.
Como ejemplo de esto aplicaremos la teoría MO a los orbitales pi en ozono. Los enlaces sigma en esta molécula pueden atribuirse a la superposición de orbitales híbridos sp 2 en cada uno de los tres átomos de oxígeno. Recordará que los híbridos sp 2 se dirigen hacia las esquinas de un triángulo equilátero, en razonable acuerdo con el ángulo de 117° en el ozono. Para los enlaces sigma y los pares solitarios, entonces, tenemos el diagrama de Lewis
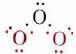
Esto involucra solo a 14 de los 18 electrones de valencia de los tres oxígenos, y así quedan 4 electrones para la unión pi. Además, cada oxígeno tiene una órbita p perpendicular al plano de sus híbridos sp 2 (es decir, perpendicular al plano de los tres átomos de oxígeno), que aún no se ha utilizado para la unión.
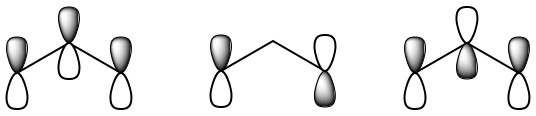
Estos tres orbitales p restantes pueden superponerse lateralmente para formar orbitales moleculares, los cuales se incluyen en el jmol que se muestra aquí. Usando la barra de desplazamiento, puede seleccionar qué orbital molecular mostrar para la molécula de ozono. Para demostrar electrones deslocalizados, nos centraremos en tres de los orbitales moleculares mostrados. El primero de estos orbitales en resaltar se ve seleccionando el orbital etiquetado “N7" en el menú de desplazamiento. Este orbital muestra una densidad de electrones concentrada entre el oxígeno central y cada uno de los otros dos, y por lo tanto es un MO de unión. El segundo en el que enfocarse es orbital “N10", que se ve muy similar a los orbitales p atómicos originales en los átomos de oxígeno finales. Un electrón en este orbital no fortalece ni debilita las atracciones entre los átomos, por lo que se dice que el MO no se une. Finalmente, existe un MO antienlace que tiene nodos entre cada par de átomos de oxígeno y se puede ver seleccionando “N13" orbital. Dado que solo hay cuatro electrones, solo se ocuparán los dos MO de menor energía (el enlace y el no enlace). Los dos electrones en el MO de unión proporcionan un orden de enlace de 1, pero esto se extiende sobre ambos enlaces O-O, por lo que contribuye con un orden de enlace de la mitad entre cada par de oxígenos. De manera similar los dos electrones en el MO no enlazante corresponden a un par solitario, la mitad en el oxígeno izquierdo y la mitad a la derecha. Incluyendo el marco de unión sigma, esto da 1½ enlaces entre cada par de oxígenos y 2½ pares solitarios en cada extremo de oxígeno. Este es exactamente el promedio de las dos estructuras de resonancia ya dadas.
El tratamiento MO también se puede utilizar para interpretar el espectro de ozono. El ozono en la estratosfera terrestre absorbe mucha radiación ultravioleta solar que de otro modo causaría daños a la biosfera. Esta absorción se debe a una banda centrada alrededor de 255 nm que corresponde a la excitación de un electrón al orbital pi antienlace sin relleno mostrado en la Figura\(\PageIndex{1}\) c.
Otra molécula importante a la que se puede aplicar útilmente la teoría MO es el benceno. Como se describe en “Resonancia”, el benceno puede ser representado por el híbrido de resonancia
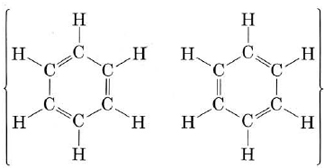
Esto indica que todos los enlaces C-C son equivalentes e intermedios entre un enlace sencillo y uno doble. Como en el caso del ozono, podemos tratar los enlaces sigma del benceno en términos de valencia-enlace, tratando únicamente con la unión pi por el método molecular-orbital. El marco de unión sigma es
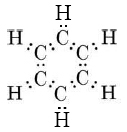
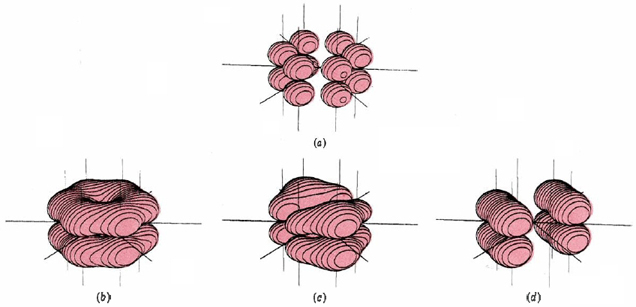
Esto involucra 24 electrones en enlaces formados por superposición de orbitales híbridos sp 2 en los átomos de carbono con orbitales 1s en cada hidrógeno o con otros híbridos sp 2 en otros carbonos. Esto da un marco plano y deja seis orbitales p (uno en cada carbono) que son perpendiculares al plano molecular y pueden superponerse lateralmente para formar seis orbitales moleculares pi. Solo los tres MO de menor energía están ocupados, y sus nubes de electrones se muestran en la Figura\(\PageIndex{2}\). Todos estos MO son adhesivos, mientras que los tres que no se muestran son antiadhesivos. Cuando los seis electrones de valencia no utilizados para la unión sigma ocupan los MO de unión pi, se distribuyen uniformemente alrededor del anillo de átomos de carbono. Esto aporta un orden de enlace de la mitad entre cada par de carbonos, o un orden de enlace total de 1½ cuando se incluye el enlace sigma. Así, el enlace C-C es intermedio entre un enlace sencillo y doble, de acuerdo con el híbrido de resonancia.