22.7: Corrosión
- Page ID
- 76153
Un aspecto importante del uso de algunos metales, particularmente del hierro, es la posibilidad de corrosión. Se estima que alrededor de una séptima parte de toda la producción de hierro va a sustituir el metal perdido por la corrosión. La roya es aparentemente una forma hidratada de óxido de hierro (III). La fórmula es aproximadamente Fe 2 O 3 •\(\tfrac{\text{3}}{\text{2}}\) H 2 O, aunque la cantidad exacta de agua es variable. (Tenga en cuenta que esto es aproximadamente a medio camino entre el hidróxido de hierro (III), Fe (OH) 3 o ½ {Fe 2 O 3 •3H 2 O], y Fe anhidro 2 O 3).
La oxidación requiere tanto oxígeno como agua, y suele ser acelerada por ácidos, cepas en el hierro, contacto con metales menos activos y la presencia de óxido en sí. Además, la observación de un objeto oxidado, como un clavo de hierro de un antiguo edificio de madera, muestra que el óxido se depositará en una ubicación (cerca de la cabeza del clavo) mientras que la mayor pérdida de hierro metálico ocurrirá en otra parte (cerca del punto). Estos hechos sugieren que el mecanismo de oxidación involucra una celda galvánica. Las medias ecuaciones involucradas son
\[\text{2Fe}(S) \rightarrow \text{2Fe}^{2+}(aq) + \text{4}e^-\label{1} \]
\[\text{4}e^- + \text{4H}^+(aq) + \text{O}_2(g) \rightarrow \text{2H}_2\text{O}\label{2} \]
produciendo la reacción completa:
\[\text{2Fe}(s) + \text{4H}^+(aq) + \text{O}_2(g) \rightarrow \text{2Fe}^{2+}(aq) + \text{2H}_2\text{O}\label{3} \]
Una vez que se forma Fe 2+ (ac), puede migrar libremente a través de la solución acuosa a otra ubicación en la superficie metálica. En ese punto el hierro puede precipitar:
\[\text{4Fe}(s) + \text{O}_2(g) + \text{7 H}_2\text{O}(l) \rightarrow \text{2Fe}_2\text{O}_3 \cdot \frac{3}{2} \text{H}_2\text{O}(s) + \text{8H}^+(aq) \nonumber \]
Los iones de hidrógeno liberados por esta reacción son luego parcialmente consumidos por la Ecuación\(\ref{2}\). Los electrones requeridos para la media ecuación\(\ref{2}\) se suministran a partir de la Ecuación\(\ref{1}\) a través de la conducción metálica a través del hierro o por conducción iónica si la solución acuosa contiene una concentración significativa de iones. Así, el hierro se oxida más rápido en contacto con agua salada que en fresco.
El mecanismo propuesto en el párrafo anterior implica que algunas regiones de la superficie de hierro se vuelven catódicas, es decir, que ahí se produce la reducción de oxígeno a agua. Otras localizaciones son anódicas; se produce la oxidación de Fe a Fe 2+. La forma principal en que se pueden establecer tales regiones depende de la restricción del suministro de oxígeno, ya que se requiere oxígeno para la reacción catódica mostrada en la Ecuación\(\ref{2}\). En el caso del clavo de hierro, por ejemplo, se forma óxido cerca de la cabeza porque hay más oxígeno disponible. La mayor parte de la pérdida de metal se produce en lo profundo de la madera, sin embargo, cerca de la punta del clavo. En esta ubicación Ecuación\(\ref{1}\) pero no\(\ref{2}\) puede ocurrir.
Una situación similar ocurre cuando una gota de humedad se adhiere a una superficie de hierro (Figura\(\PageIndex{1}\)). La picadura ocurre cerca del centro de la gota, mientras que el óxido de hierro hidratado (III) se deposita cerca del borde.
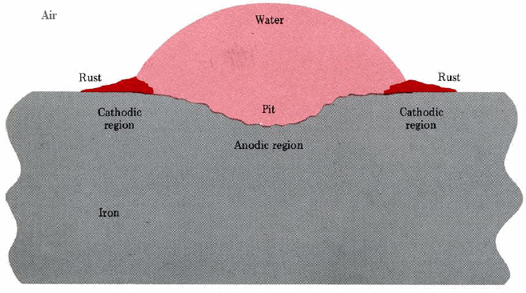
Una segunda forma en la que se pueden configurar las regiones anódica y catódica implica la presencia de un segundo metal que tiene una mayor atracción por los electrones (se oxida menos fácilmente) que el hierro. Tal metal puede drenar los electrones que quedan en el hierro cuando el Fe 2+ se disuelve. Este exceso de electrones hace que el metal menos activo sea un sitio ideal para la Ecuación\(\ref{2}\), por lo que se establece una celda en la intersección de los metales. El óxido en realidad puede cubrir la superficie del metal menos activo mientras que se forman hoyos en el hierro.
La técnica más importante para la prevención de la oxidación es simplemente excluir el agua y el oxígeno por medio de una capa protectora. Este es el principio detrás de engrasar, engrasar, pintar o enchapado metálico de hierro. El recubrimiento debe estar completo, sin embargo, o la oxidación puede acelerarse mediante la exclusión de oxígeno de parte de la superficie. Esto es especialmente cierto cuando el hierro está recubierto con un metal menos activo como el estaño. Incluso un orificio en el recubrimiento de una lata se oxidará muy rápidamente, ya que el estaño se vuelve catódico debido a su mayor potencial de electrodo y a la exclusión de oxígeno del hierro debajo.
Una segunda técnica consiste en poner el objeto de hierro en contacto con un metal más activo. A esto se le llama protección catódica porque el metal más activo dona electrones al hierro, inhibiendo fuertemente la Ecuación\(\ref{1}\). Tanto la protección catódica como un recubrimiento superficial se proporcionan por galvanización, un proceso en el que el zinc se platea sobre acero electrolíticamente o por inmersión en el metal fundido. Al igual que muchos otros metales, el zinc es autoprotector: reacciona con el oxígeno y el dióxido de carbono del aire para formar un recubrimiento adherente impermeable de hidroxicarbonato de zinc, Zn 2 (OH) 2 CO 3. Si hubiera un rasguño en la placa de zinc, el hierro aún no puede oxidarse porque el zinc se oxidará preferencialmente. El hidroxicarbonato formado cubrirá entonces la abertura, evitando un mayor contacto de oxígeno con el hierro o zinc.
Una tercera técnica se aplica a situaciones (como un radiador de automóvil) donde las soluciones acuosas están en contacto con el hierro. Los inhibidores de corrosión incluyen sales de cromato y compuestos orgánicos como la tribtilamina, (C 4 H 9) 3 N. Los cromatos aparentemente forman un recubrimiento impermeable de FeCrO 4 (s) tan pronto como cualquier hierro se oxida a hierro (II). La tributilamina, un derivado del amoníaco, reacciona con los ácidos orgánicos formados por la descomposición del anticongelante a las altas temperaturas de un motor de automóvil. Las sales de tributilammonio producidas son insolubles y recubren el interior del sistema de enfriamiento. Por lo tanto, la tributilamina neutraliza el ácido que aceleraría la corrosión y también proporciona un recubrimiento superficial.


