22.9: Geometría de Complejos
- Page ID
- 76120
La geometría de un complejo se rige casi en su totalidad por el número de coordinación. Consideraremos únicamente los números de coordinación más comunes, es decir, 2, 4 y 6.
Número de coordinación = 2
Los complejos con dos ligandos son invariablemente lineales. Los ejemplos más conocidos de tales compuestos son complejos de Ag (I) y Au (I) tales como
2%25E2%2580%2593.jpg)
2%252B.jpg)
Ambos complejos son importantes. El complejo Au (CN) 2 — se utiliza para extraer partículas diminutas de oro de la roca en la que se encuentran. El mineral triturado se trata con solución de KCN y se sopla aire a través de ella:
\[ 4 \text{Au} (s) + 8 \text{CN}^{-} (aq) + \text{O}_{2} (g) + 2 \text{H}_{2} \text{O} (l) \rightarrow 4 \text{[Au(CN)}_{2} \text{]}^{-} (aq) + 4 \text{OH}^{-} (aq) \label{1} \]
El complejo resultante es soluble en agua. El complejo de plata también es soluble en agua y proporciona un método para disolver AgCl, que por lo demás es muy insoluble.
\[ \text{AgCl} (s) + 2 \text{NH}_{3} (aq) \rightarrow \text{[Ag(NH}_{3} \text{)}_{2} \text{]}^{+} (aq) + \text{Cl}^{-} (aq) \nonumber \]
Esta reacción se usa a menudo en el laboratorio para asegurarse de que un precipitado es AgCl (s).
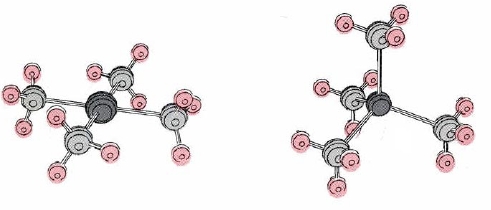42%252B_(square_planar)_and_Zn(NH3)42%252B_(tetrahedral)_.jpg)
Número de coordinación = 4
Dos geometrías son posibles para este número de coordinación. Algunos complejos, como el ion [Pt (NH 3) 4] 2+ que se muestra en la Figura\(\PageIndex{1}\), son planos cuadrados, mientras que otros, como Cd (NH 3) 4 2—, son tetraédricos. La mayoría de los complejos de cuatro coordinados de Zn (II), Cd (II) y Hg (II) son tetraédricos, mientras que la disposición plana cuadrada es preferida por los complejos Pd (II), Pt (II) y Cu (II).
Debido a que la geometría plana cuadrada es menos simétrica que la geometría tetraédrica, ofrece más posibilidades de isomería. Un ejemplo bien conocido de tal isomería lo dan los dos complejos planos cuadrados
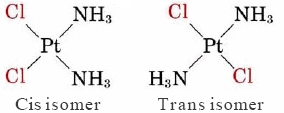2.jpg)
Estos dos isómeros se denominan isómeros geométricos. Ese isómero en el que dos ligandos idénticos están uno al lado del otro se llama isómero cis, mientras que aquel en el que están en lados opuestos se denomina isómero trans. Aunque estos dos isómeros tienen algunas propiedades que son similares, ninguna propiedad es idéntica y algunos son muy diferentes. Por ejemplo, el isómero cis del complejo anterior se usa como fármaco antitumoral para tratar células cancerosas. La forma trans, por el contrario, no muestra actividad biológica similar.
Cabe señalar que el isomerismo cis-trans no es posible en el caso de los complejos tetraédricos. Como se puede verificar rápidamente examinando cualquier forma tetraédrica tridimensional, cualquier esquina dada de un tetraedro es adyacente a las otras tres. Ya que todas las esquinas son cis entre sí, ninguna es trans.
Número de coordinación = 6
Cuando hay seis ligandos, la geometría del complejo es casi siempre octaédrica, como la geometría de SF 6, o de [Cr (H 2 O) 6] 3+. Todos los ligandos son equidistantes del átomo central, y todos los ángulos ligando-metal-ligando son de 90°. También se puede pensar que un complejo octaédrico deriva de una estructura plana cuadrada al agregar un quinto ligando por encima y un sexto por debajo en una línea a través del ion metálico central y perpendicular al plano.
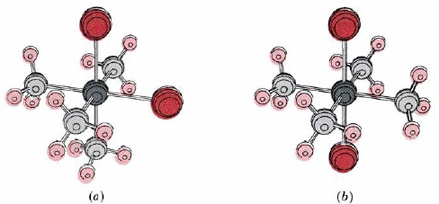4Cl2_.jpg)
La estructura octaédrica también da lugar a isomería geométrica. Por ejemplo, dos compuestos diferentes, uno violeta y otro verde, tienen la fórmula [Co (NH 3) 4 Cl 2] Cl. El complejo violeta resulta tener la estructura cis y la trans verde, como se muestra en la Figura\(\PageIndex{2}\).


