1.5: Moléculas y Moles
- Page ID
- 77430
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Hasta el momento hemos hablado sólo de átomos o moléculas individuales, y de masas medidas en unidades de masa atómica. Pero las moléculas individuales son difíciles de manipular en el laboratorio, y los químicos pesan sus materiales en gramos, no en unidades de masa atómica. Para escalar desde el nivel molecular hasta el nivel de laboratorio, utilizamos una unidad llamada mole. Un mol de una sustancia es igual a tantas moléculas de esa sustancia como átomos de carbono-12 en exactamente 12 g de carbono-12. Esto significa que 1 mol de cualquier sustancia es un peso, en gramos, igual al peso molecular de esa sustancia expresado en unidades de masa atómica. Lo más importante de todo, por esta definición, 1 mol de cualquier sustancia contiene el mismo número de moléculas. El químico puede contar átomos y moléculas en el laboratorio simplemente pesándolos. La palabra topo se aplica no sólo a las moléculas sino también a los átomos; en la práctica, hablamos de un mol de átomos de helio así como de un mol de moléculas de agua. El término gram-átomo aplicado a un mol de átomos ya no es ampliamente utilizado.
Ejemplo 1.5.1
¿Cuántos gramos de cada una de las siguientes sustancias hay en 1 mol de esa sustancia: H 2, H 2 0, CH 3 OH, octano (C 8 H 18) y gas neón (Ne)?
Solución
Los pesos moleculares (en unidades de masa atómica) de la mayoría de estas sustancias se han dado en ejemplos anteriores, y el peso atómico del neón se enumera en la contraportada interior. Por lo tanto, un mol de cada sustancia es:
-
-
H 2 2.0160 g romper C 8 H 18 114.23 g H 2 O 18.0154 g romper Ne 20.179 g CH 3 OH 32.04 g romper
-
Debido a que los pesos enumerados en el Ejemplo 9 dan los pesos relativos correctos de las moléculas que se están pesando, cada una de las cantidades de material contendrá el mismo número de moléculas. Esto es lo que hace útil el concepto de lunares. Ni siquiera es necesario saber cuál es ese número, aunque sabemos que es 6.022 X 10 23; se llama número de Avogadro y se le da el símbolo N Pasar de moléculas a moles significa una escala de 6.022 X 10 23 veces. El número de Avogadro es también el factor de conversión entre unidades de masa atómica y gramos como unidades de masa: 1 g = 6.022 X 10 23 amu. Si pensamos en el peso molecular como la masa de un mol de sustancia, las unidades para el peso molecular son gramos por mol; si pensamos en ello como el peso real de una molécula, el valor numérico no cambia pero las unidades se convierten en unidades de masa atómica por molécula. Ambos son correctos.
Ejemplo 1.5.2
Una molécula de H 2 reacciona con una molécula de Cl 2 para formar dos moléculas de gas de cloruro de hidrógeno, HCl. ¿Qué peso de gas cloro se debe utilizar para reaccionar completamente con 1 kilogramo (kg) de gas hidrógeno?
Solución
Los pesos moleculares de H 2 y Cl 2 son 2.0160 g mol -1 y 70.906 g mol -1, respectivamente. * De ahí que 1000 g de H 2 contiene:
-
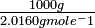 = 496.0 moles de moléculas H 2
= 496.0 moles de moléculas H 2
-
- 496.0 moles X 70.906 g mol -1 = 35,170 g de Cl 2
* La expresión “g mol -1" debe leerse como “gramos por mol”. En esta notación, se escribe una velocidad en millas por hora con unidades de “millas HR-i”.
Ejemplo 1.5.3
¿Cuántas moléculas de\(H_2\) y\(Cl_2\) estarían presentes en el experimento del Ejemplo 1.5.2?
Solución
En 496.0 moles de cualquier sustancia, habrá
\[(496.0\; \cancel{mol}) \left(6.022 \times 10^{23}\; \dfrac{molecules}{\cancel{mole}}\right) = 2.99 \times 10^{26}\; molecules\]
Como ejemplo aleccionador de cuán grande es el número de Avogadro, 1 mol de cocos, cada uno de 14 centímetros (cm) de diámetro, llenaría un volumen tan grande como todo el planeta tierra. El uso de moles en los cálculos químicos es el tema del siguiente capítulo, pero la idea se ha introducido aquí porque necesitamos saber cómo escalar desde el nivel molecular hasta el de laboratorio.
Colaboradores y Atribuciones
R. E. Dickerson, H. B. Gray, and G. P. Haight, Jr. Content was used from "Chemical Principles", an introductory college-level text for General Chemistry with permission of the Caltech library and Harry B. Gray, on behalf of the authors.

