1.6: Iones
- Page ID
- 77399
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
La idea de un enlace covalente sugiere compartir equitativamente el par de electrones por los átomos unidos, pero la breve discusión de la polaridad en la Sección 1-4 indicó que el intercambio no siempre es igual. La electronegatividad relativa o poder de atracción de electrones de los átomos es de gran importancia para explicar el comportamiento químico, y se trata en detalle en los Capítulos 9 y 10. Los átomos de sodio (y todos los metales en general) tienen una retención débil sobre los electrones, mientras que los átomos de cloro son muy electronegativos. De ahí que en la sal de mesa común (cloruro de sodio, NaCl), cada átomo de sodio, Na, pierde un electrón (e -) para formar un ion sodio, Na +. Cada átomo de cloro recoge un electrón para convertirse en un ion cloruro, Cl -:
-
- Na → Na + + e - palabra y palabra
 Cl 2 + e - → Cl -
Cl 2 + e - → Cl -
- Na → Na + + e - palabra y palabra
Escribimos Cl 2 porque el gas cloro libre existe como moléculas diatómicas (de dos átomos), no como átomos de cloro libres. El cloruro de sodio sólido (Figura 1-5) tiene iones de sodio y cloruro empaquetados en una red tridimensional de tal manera que cada ion Na + positivo está rodeado en cuatro lados y la parte superior e inferior por iones Cl negativos, y cada Cl - está rodeado de manera similar por seis más cercanos vecino Na + iones. Se trata de un arreglo particularmente estable de cargas positivas y negativas.
Cl 2 porque el gas cloro libre existe como moléculas diatómicas (de dos átomos), no como átomos de cloro libres. El cloruro de sodio sólido (Figura 1-5) tiene iones de sodio y cloruro empaquetados en una red tridimensional de tal manera que cada ion Na + positivo está rodeado en cuatro lados y la parte superior e inferior por iones Cl negativos, y cada Cl - está rodeado de manera similar por seis más cercanos vecino Na + iones. Se trata de un arreglo particularmente estable de cargas positivas y negativas.
Los metales en general pierden de uno a tres electrones fácilmente para convertirse en iones cargados positivamente, o cationes:
-
-
Li → Li + + e - ttt iones de litio Na → Na + + e - ttt ión de sodio K → K + + e - ttt ión potasio Mg → Mg 2+ + 2 e - ttt ion magnesio Ca → Ca 2+ + 2 e - ttt ion calcio Al → Al 3+ + 3 e - ttt iones de aluminio
-
Algunos no metales, por el contrario, captan electrones para convertirse en iones cargados negativamente, o aniones:
-
-
 F 2
F 2+ e - → F - ttt ion fluoruro  Cl 2
Cl 2+ e - → Cl - ttt ión cloruro  O 2
O 2+ 2 e - → O 2- ttt ión óxido  S 2
S 2+ 2 e - → S 2- ttt ion sulfuro
-
-
-
-
-
-
-
- Tabla 1-4 Algunos iones simples de elementos
-
-
-
-
-

Otros iones simples hechos de átomos individuales se muestran en la Tabla 1-4. La carga en un ion simple de un solo átomo como AP + o S2- es su estado de oxidación o número de oxidación. Es el número de electrones que se deben agregar para reducir (o eliminar para oxidar) el ion a las especies neutras:
-
- Reducción: AI 3+ + 3 e - → Al
- Oxidación: S 2- → S + 2 e -
Alejar electrones de un átomo o eliminarlos por completo es oxidación. Agregar electrones a un átomo o simplemente desplazarlos hacia él es reducción.
| ¿Se oxida o reduce el cloro en la formación del ion cloruro? ¿Cuál es el estado de oxidación del ion? |
|
Solución Se reduce el cloro, ya que se agrega un electrón por átomo de cloro para formar el ion. El ion cloruro, Cl -, se encuentra en el estado de oxidación - 1. |
| Cuando los metales se convierten en sus iones, ¿se oxidan o reducen? ¿Cuál es el estado de oxidación del ion aluminio? |
|
Solución Los metales se oxidan a sus iones, ya que se eliminan los electrones. El ion aluminio, AP +, se encuentra en el estado de oxidación +3. |
Si son posibles dos o más estados de oxidación para un ion metálico, se diferencian escribiendo el estado de oxidación en números romanos después del nombre del átomo. Una nomenclatura más antigua, aún en uso, identifica el estado de oxidación superior por el final - ic y el más bajo por - ous. Por lo tanto,
-
-
Fe 2+ tt hierro (II) o ferroso romper Fe 3+ tt hierro (III) o férrico Cu + tt cobre (I) o cuproso romper Cu 2+ tt cobre (II) o cúprico Sn 2+ tt estaño (II) o estannoso romper Sn 4+ tt estaño (IV) o estánnico
-
| Cuando el ion férrico se convierte en el ion ferroso, ¿es esto una oxidación o reducción? Escribe la ecuación para el proceso. |
|
Solución La ecuación es Fe 3+ + e - → Fe 2+. El proceso es una reducción ya que se agrega un electrón. |
Una sal es un compuesto compuesto por iones positivos y negativos. Debido a que una sal debe ser eléctricamente neutra, la carga total sobre sus iones positivos y negativos debe ser cero. Dado que cada ion de Sn 2+ tiene una carga de +2, se requiere el doble de iones cloruro con -1 carga cada uno para producir una carga neta cero. De ahí que la sal de los iones Sn 2+ y Cl - tenga la composición general SnCl 2, en lugar de SnCl o SnCl 3. Se llama cloruro estañoso o cloruro de estaño (II). La fórmula para cloruro estánnico o cloruro de estaño (IV) es SnCl 4.
Además de estos iones simples, se pueden formar iones compuestos o complejos entre un metal o no metal y oxígeno, cloro, amoníaco (NH 3), el ion hidróxido (OH -), u otros grupos químicos. El ion sulfato, SO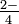 , tiene cuatro oxígenos en las esquinas de un tetraedro alrededor del átomo central de azufre, y una carga global de -2. El ion nitrato, NO
, tiene cuatro oxígenos en las esquinas de un tetraedro alrededor del átomo central de azufre, y una carga global de -2. El ion nitrato, NO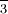 , tiene tres átomos de oxígeno en un triángulo equilátero alrededor del nitrógeno, y una carga -1. El ion amonio, NH
, tiene tres átomos de oxígeno en un triángulo equilátero alrededor del nitrógeno, y una carga -1. El ion amonio, NH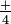 , tiene cuatro hidrógenos en las esquinas de un tetraedro, y una carga +1. Estos iones son pensados como unidades porque forman sales como lo hacen los iones de un solo átomo, y pasan por muchas reacciones químicas sin cambios. El nitrato de plata, AgN0 3, es una sal que contiene números iguales de
, tiene cuatro hidrógenos en las esquinas de un tetraedro, y una carga +1. Estos iones son pensados como unidades porque forman sales como lo hacen los iones de un solo átomo, y pasan por muchas reacciones químicas sin cambios. El nitrato de plata, AgN0 3, es una sal que contiene números iguales de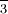 iones Ag + y NO. El sulfato de amonio es una sal con el doble de iones amonio
iones Ag + y NO. El sulfato de amonio es una sal con el doble de iones amonio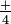 , NH, que iones sulfato, SO
, NH, que iones sulfato, SO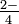 , y la fórmula química (NH 4) 2 S0 4. Otros iones complejos típicos se muestran en la Tabla 1-5.
, y la fórmula química (NH 4) 2 S0 4. Otros iones complejos típicos se muestran en la Tabla 1-5.
-
-
-
-
-
-
- Tabla 1-5 Algunos iones complejos comunes
-
-
-
-
-

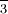 , tiene espacio para tres átomos de oxígeno a su alrededor, y de ahí un número de coordinación de 3 para el oxígeno. El átomo de azufre es mayor que un átomo de nitrógeno, y puede acomodar un átomo de oxígeno más en el ion sulfato, SO
, tiene espacio para tres átomos de oxígeno a su alrededor, y de ahí un número de coordinación de 3 para el oxígeno. El átomo de azufre es mayor que un átomo de nitrógeno, y puede acomodar un átomo de oxígeno más en el ion sulfato, SO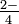 . De ahí que el número de coordinación de azufre para oxígeno sea 4.
. De ahí que el número de coordinación de azufre para oxígeno sea 4.
Los números de coordinación más comunes son 2, 3, 4 y 6, (Ver Cuadro 1-6.) Un ion o molécula con un átomo central que tenga un número de coordinación de 2 puede ser lineal, como dióxido de carbono con O-C-O en línea recta, o doblado, como en agua, H 2 0. Las estructuras posibles para iones o moléculas con números de coordinación de 3, 4 y 6 se muestran en la Tabla 1-6.
-
-
-
-
- Tabla 1-6 Números comunes de coordinación
-
-
-


-
-
1 sodio: tt 22.990 amu 1 cloro: tt 35.453 amu Total: tt 58.443 amu
-
| ¿Cuál es el peso molecular del sulfato de amonio? | |||||||||||||||||||||||||
|
Solución La fórmula química del sulfato de amonio es (NH 4) 2 SO 4, por lo que el peso molecular (en realidad el peso de la fórmula) es
|
-
-
Ion sulfato: tt SO 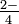
palabra Ion sulfito: tt SO 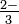
Ión nitrato: tt NO 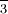
palabra Ión nitrito: tt NO 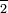
Ión arseniato: tt ASo 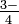
palabra Ion arsenito: tt ASo 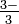
-
Si existen más de dos de esos aniones, entonces se utilizan los prefijos hypo- (“under”) y per- (“beyond”):
-
-
Ion perclorato: tt ClO 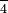
Ión clorato: tt ClO 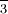
Ion clorito: tt ClO 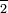
Ion hipoclorito: tt ClO 
-
Puntos de fusión y puntos de ebullición de sales
Un cristal de sal representa un balance particularmente estable de cargas positivas y negativas, manteniéndose cada tipo de ion fuera del camino de otros de carga similar. Derretir un cristal de sal significa perturbar este delicado equilibrio de cargas y permitir que los iones que se repelen mutuamente se acerquen de vez en cuando a medida que los iones fluyen entre sí. Esta alteración de la estructura requiere grandes cantidades de energía para lograr, por lo que los puntos de fusión de las sales son más altos que los de los sólidos moleculares. Los puntos de fusión de dos sales, cloruro de sodio (NaCl) y sulfato de potasio (K 2 SO 4), se comparan en el Cuadro 1-7 con los de los elementos a partir de los cuales se elaboran las sales.
| Sustancia |
Químico Fórmula |
T m (°C) | T b (°C) |
|---|---|---|---|
| Sodio metálico | Na | 97.8 | 882.9 |
| Gas Cloro | Cl 2 | -101.0 | -34.6 |
| Cloruro de Sodio (sal) | NaCl | 801 | 1413 |
| Potasio metálico | K | 64 | 774 |
| Azufre | S | 119 | 445 |
| Oxígeno gaseoso | O 2 | -218 | -183 |
| Sulfato de potasio (sal) | K 2 SO 4 | 1069 | 1689 |
Colaboradores y Atribuciones
R. E. Dickerson, H. B. Gray, and G. P. Haight, Jr. Content was used from "Chemical Principles", an introductory college-level text for General Chemistry with permission of the Caltech library and Harry B. Gray, on behalf of the authors.

