1.7: Iones en Solución
- Page ID
- 77387
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Aunque las sales son difíciles de fundir y aún más difíciles de vaporizar, muchas pueden disolverse fácilmente en un líquido polar como el agua. El motivo de esto es simple. Las moléculas de agua ayudan a desmantelar el cristal de sal, ya que las cargas parciales positivas y negativas en las moléculas polares de agua (Figura 1-4) proporcionan un sustituto de las cargas positivas y negativas que estaban presentes en la red cristalina. La Figura 1-7 ilustra lo que sucede cuando un cristal como el cloruro de sodio se disuelve en agua. Cada Na + cargado positivamente está rodeado por moléculas de agua con sus oxígenos cargados negativamente girados hacia él, y cada ion Cl - cargado negativamente está rodeado por moléculas de agua con sus hidrógenos cargados positivamente más cercanos. Se dice que los iones del cristal de sal están hidratados. Si la estabilidad que da la hidratación a los iones en solución es mayor que la estabilidad de la red cristalina, entonces la sal se disolverá. El cloruro de sodio es un ejemplo familiar de una sal soluble. En contraste, si la energía de hidratación es demasiado pequeña, entonces el cristal será la forma más estable, y no se disolverá en agua. El cloruro de plata (AgCl) y el sulfato de bario (BaS0 4) son ejemplos de sales insolubles. Cuando un cristal de sal se disuelve, no simplemente se desmonta en iones; se desmonta por las moléculas del líquido en el que se disuelve (el disolvente). Es por ello que las sales no se disolverán en líquidos no polares como la gasolina (octano, C 8 H 18); no hay cargas en las moléculas de disolvente para compensar la pérdida de atracciones de carga dentro de la sal cristalina.

Las soluciones salinas conducen la electricidad, y esta propiedad fue extremadamente importante al principio del desarrollo de teorías de unión química. La conducción eléctrica en los metales se realiza por medio de electrones en movimiento; los iones metálicos permanecen en su lugar. Las sales cristalinas no conducen electricidad en absoluto, pero si la sal se funde, entonces los iones positivos pueden migrar de una manera a través del líquido y los iones negativos pueden moverse por el otro lado en presencia de un campo eléctrico. Esta movilidad de los iones es aún mayor si la sal se disuelve en agua y los iones en consecuencia se hidratan.
Algunas de las primeras ideas concretas sobre la naturaleza de la unión química provinieron de los experimentos de electrólisis del científico inglés Michael Faraday (1791-1867). (La electrólisis significa “romper con la electricidad”.) Si se funde cloruro de sodio (por encima de 801°C) y si se insertan dos electrodos (el cátodo y el ánodo) en la masa fundida como se muestra en la Figura 1-8 y se pasa una corriente eléctrica a través de la sal fundida, entonces se producen reacciones químicas en los electrodos: migran al cátodo, donde los electrones entran en la masa fundida, y se reducen a sodio metálico:


\[Na^+ + e^-(from\; cathode) → Na\]
Los iones cloruro migran hacia el otro lado, hacia el ánodo, ceden sus electrones al ánodo y se oxidan a gas cloro:
\[Cl^- → \frac{1}{2} Cl_{2} + e^-(to\; anode)\]
La reacción general es la descomposición del cloruro de sodio en sus elementos:
\[Na^+ + CI^- → Na + \frac{1}{2}Cl_2\]
Los iones de sodio se reducen y los iones cloruro se oxidan. La electrólisis también se puede llevar a cabo haciendo pasar corriente eléctrica a través de soluciones de sales (Figura 1-9). Si se electroliza una solución de cloruro de sodio en agua, se desprende cloro gaseoso en el ánodo como en el caso del cloruro de sodio fundido, pero el producto del cátodo es gas hidrógeno en lugar de sodio metálico:
\[Na^+ + Cl^- + H_2O \rightarrow Na + \frac{1}{2} Cl_2 + \frac{1}{2} H_2 + OH^- \label{1-1}\]
Este es el mismo resultado que se obtendría si el cloruro de sodio líquido se electrolizara primero para dar sodio metálico:
\[Na^+ + Cl^- → Na + \frac{1}{2} Cl_2 \label{1-2}\]
y luego se arrojó el sodio al agua:
\[Na + H_2O → Na^+ + \frac{1}{2}H_2 + OH^- \label{1-3}\]
La ecuación\(\ref{1-1}\) es solo la suma de las Ecuaciones\(\ref{1-2}\) y\(\ref{1-3}\), ya que el metal de sodio que se produce en la Ecuación\(\ref{1-2}\) se agota en la Ecuación\(\ref{1-3}\). No hay nada misterioso en los diferentes productos catódicos durante la electrólisis del cloruro de sodio en una masa fundida o en solución, Si el agua está presente, algunas de las moléculas de H 2 O se disociarán en iones H + y OH -. Debido a que H + tiene una mayor afinidad por los electrones que Na+, los iones H+ quitarán electrones del sodio metálico, haciendo que el ánodo sea producto H 2 en lugar de Na, y dejando iones Na + en solución. En contraste, los iones Cu 2+ tienen una mayor afinidad por los electrones que los iones H +, por lo que el producto anódico de la electrólisis del CuCl 2 es el cobre metálico, ya sea que el proceso se lleve a cabo en fusión o en solución (Figura 1-9). Los productos típicos de electrólisis de soluciones y fundidos se dan en la Tabla 1-8. Las reacciones electroquímicas y las celdas se discuten en detalle en el Capítulo 19. Por el momento, nos estamos enfocando en lo que las reacciones electroquímicas nos dicen sobre la unión química.
| Electrolito tt | Catodo Producto tt | Producto de ánodo |
| Ácido sulfúrico (H 2 SO 4) en H 2 O tt | H 2 tt | O 2 |
| Sulfato de sodio (Na 2 SO 4) en H 2 O tt | H 2 tt | O 2 |
| Cloruro de sodio (NaCl) en H 2 O tt | H 2 tt | Cl 2 |
| Yoduro de potasio (Kl) en H 2 0 tt | H 2 tt | I 2 |
| Sulfato de cobre (Cu 2 SO 4) en H 2 0 tt | Cu tt | O 2 |
| Nitrato de plata (AgnO 3) en H 2 O tt | Ag tt | O 2 |
| Nitrato mercúrico [Hg (NO 3) 2] en H 2 0 tt | Hg tt | O 2 |
| Nitrato de plomo [Pb (NO 3) 2] en H 2 0 tt | Pb tt | O 2 y algunos PbO 2 |
| Lejía fundida (NaOH); no en H 2 O tt | Na tt | O 2 |
- Pasar la misma cantidad de electricidad a través de una celda siempre conduce a la misma cantidad de cambio químico para una reacción dada. El peso de un elemento depositado o liberado en un electrodo es proporcional a la cantidad de electricidad por la que se pasa.
- Se necesitan 96.485 culombios de electricidad para depositar o liberar 1 mol de una sustancia que gana o pierde un electrón durante la reacción celular. Si n electrones están involucrados en la reacción, entonces se requieren 96.485 n culombios de electricidad para liberar un mol de producto.
La cantidad 96.485 culombios de electricidad se ha dado a conocer como 1 faraday en su honor, y se le ha dado el símbolo . Las leyes de Faraday se vuelven evidentes cuando te das cuenta de que 1
. Las leyes de Faraday se vuelven evidentes cuando te das cuenta de que 1 es simplemente la carga sobre 1 mol de electrones, o 6.022 X 10 23 electrones. El factor de escalado de 6.022 X 10 23 de moléculas a moles es paralelo por el mismo factor de escalado de carga de 1 electrón a 1
es simplemente la carga sobre 1 mol de electrones, o 6.022 X 10 23 electrones. El factor de escalado de 6.022 X 10 23 de moléculas a moles es paralelo por el mismo factor de escalado de carga de 1 electrón a 1 de carga. En su momento, claro, Faraday no conocía ni el valor del número de Avogadro ni la carga sobre un electrón. Sus experimentos sí le dijeron, sin embargo, que las cargas sobre iones venían en múltiplos de una unidad fundamental, de tal manera que 96.485 culombios correspondían a un mol de estas unidades. La palabra electrón apareció por primera vez en 1881, cuando el físico británico G. J. Stoney la acuñó para denotar esta unidad fundamental de carga iónica. Su aplicación a una partícula real cargada negativamente llegó una década después.
de carga. En su momento, claro, Faraday no conocía ni el valor del número de Avogadro ni la carga sobre un electrón. Sus experimentos sí le dijeron, sin embargo, que las cargas sobre iones venían en múltiplos de una unidad fundamental, de tal manera que 96.485 culombios correspondían a un mol de estas unidades. La palabra electrón apareció por primera vez en 1881, cuando el físico británico G. J. Stoney la acuñó para denotar esta unidad fundamental de carga iónica. Su aplicación a una partícula real cargada negativamente llegó una década después.
Escribir ecuaciones para las reacciones que ocurren cuando la corriente pasa a través de NaCl fundido. ¿Cuántos gramos de sodio y cloro se liberan cuando se pasa 1 de carga a través de la celda? de carga a través de la celda? |
|
Solución La reacción catódica es Na + + e - → Na, y la reacción del ánodo es Cl - → |
¿Cuántos gramos de metal magnesio y gas cloro se liberan cuando 1 de electricidad pasa a través de una celda electrolítica que contiene cloruro de magnesio fundido, MgC1 2? de electricidad pasa a través de una celda electrolítica que contiene cloruro de magnesio fundido, MgC1 2? |
|
Solución La reacción catódica es Mg 2+ + 2 e - → Mg, y la reacción del ánodo es la siguiente: 2Cl - → Cl 2 + 2 e -. Dado que se requieren dos electrones para reducir cada ion de Mg 2+, 1 mol de electrones será suficiente para reducir medio mol de iones magnesio, depositando 12.153 g de magnesio. (El peso atómico del magnesio es 24.305 g mol -1.) Al igual que en el Ejemplo 16, se oxida 1 mol de iones Cl -, liberando medio mol o 35.453 g de gas Cl 2. |
| La principal fuente comercial de aluminio metálico es la electrólisis de sales fundidas de Al 3+. ¿Cuántos faradays de carga, y cuántos culombios, se deben pasar a través de la masa fundida para depositar 1 kg de metal? |
|
Solución Un kilogramo de aluminio es 1000 g/26.98 g mol -1, o 37.06 moles. Dado que cada átomo de aluminio depositado requiere tres electrones, 37.06 moles requerirán 3 X 37.06, o 111.2, moles de electrones. De ahí que se necesitarán 111.2 |
| El flujo de electrones a la velocidad de 1 culombio por segundo (culombio seg -1) es una corriente de 1 amperio (A). Las corrientes en la producción electrolítica industrial de aluminio se encuentran ordinariamente en el rango de 20,000 a 50,000 A. Si una celda se opera a 40,000 A (40,000 culombios seg -1), ¿cuánto tiempo tardará en producir el kilogramo de aluminio metálico mencionado en el Ejemplo 18? |
|
Solución El tiempo requerido será
|

 ) por cada mol de cobre. Cada faraday es suficiente para oxidar 1 mol de iones Cl - a
) por cada mol de cobre. Cada faraday es suficiente para oxidar 1 mol de iones Cl - a mol de gas Cl 2. (b) Solo se requiere 1
mol de gas Cl 2. (b) Solo se requiere 1 de carga para reducir 1 mol de iones Ag + a plata metálica. ya que la carga iónica en Ag + es solo +1. El gas cloro se libera a la misma tasa por faraday que antes.
de carga para reducir 1 mol de iones Ag + a plata metálica. ya que la carga iónica en Ag + es solo +1. El gas cloro se libera a la misma tasa por faraday que antes.Las leyes de Faraday se representan diagramáticamente en la Figura 1-10. Hemos estado usando estas leyes con un conocimiento previo de las cargas en diferentes iones, y el conocimiento de que 96.485 culombios es la carga total en 6.022 X 10 23 electrones. La historia realmente operaba a la inversa: Faraday y otros utilizaron experimentos de electrólisis para averiguar cuáles eran las cargas sobre los iones. El razonamiento utilizado se ilustra en el Cuadro 1-9. Si se requiere el doble de electricidad para liberar un mol de cobre que un mol de plata (asumiendo que conoces los pesos atómicos de los dos metales y puedes calcular los pesos de un mol de cada uno), entonces el ion cobre debe tener el doble de carga del ion plata. En el Cuadro 1-9, el número de faradays de carga requeridos para liberar 1 mol de un elemento es el mismo que el número de cargas, positivas o negativas, sobre el ión.
|
Producto de electrólisis |
Electrodo |
Faradays por mol de átomos depositados |
Ion en solución |
|---|---|---|---|
| Plata (Ag) | Cátodo | 1 a | Ag+ |
| Cloro (Cl 2) | Ánodo | 1 | Cl - |
| Cobre (Cu) | Cátodo | 2 | Cu 2+ |
| Hidrógeno (H 2) | Cátodo | 1 | H + |
| Yodo (I 2) | Ánodo | 2 | I - |
| Oxígeno (O 2) b | Ánodo | 2 | O 2- |
| Zinc (Zn) | Cátodo | 2 | Zn 2+ |
a Por ejemplo, la electrólisis de la solución de nitrato de plata por 1 hora mediante el uso de una corriente de 0.5 A deposita 2.015 g de plata; 2.015/107.9 = 0.0187 mol de plata.
(0.5 culombios seg^-1) x 3600 seg = 0.0187
-
- 96.485 culombios
 -1
-1
- 96.485 culombios
b En realidad, el oxígeno (0 2) es producido por una reacción complicada del electrodo. La especie O 2- puede existir en óxidos fundidos, pero en agua 0 2- se convierte en 2OH -por reacción con una molécula de agua.
Colaboradores y Atribuciones
R. E. Dickerson, H. B. Gray, and G. P. Haight, Jr. Content was used from "Chemical Principles", an introductory college-level text for General Chemistry with permission of the Caltech library and Harry B. Gray, on behalf of the authors.


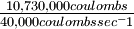 = 268 seg o 4.5 min
= 268 seg o 4.5 min