2.4: Fórmulas químicas
- Page ID
- 77615
- Simbolizar la composición de moléculas usando fórmulas moleculares y fórmulas empíricas
- Representar la disposición de enlace de los átomos dentro de las moléculas usando fórmulas estructurales
Una fórmula molecular es una representación de una molécula que utiliza símbolos químicos para indicar los tipos de átomos seguidos de subíndices para mostrar el número de átomos de cada tipo en la molécula. (Un subíndice se usa solo cuando está presente más de un átomo de un tipo dado). Las fórmulas moleculares también se utilizan como abreviaturas para los nombres de los compuestos.
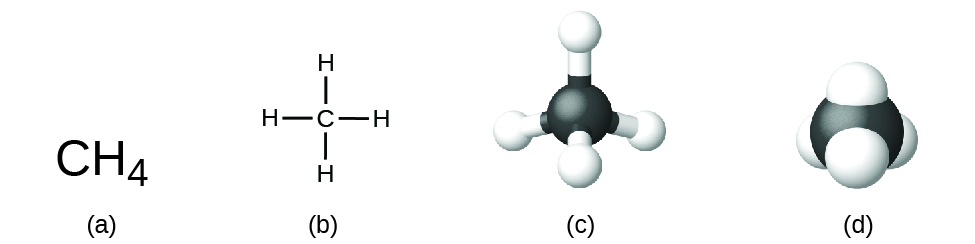
La fórmula estructural de un compuesto da la misma información que su fórmula molecular (los tipos y números de átomos en la molécula) pero también muestra cómo los átomos están conectados en la molécula. La fórmula estructural del metano contiene símbolos para un átomo de C y cuatro átomos de H, indicando el número de átomos en la molécula (Figura\(\PageIndex{1}\)). Las líneas representan enlaces que mantienen unidos a los átomos. (Un enlace químico es una atracción entre átomos o iones que los mantiene unidos en una molécula o un cristal). Discutiremos los enlaces químicos y veremos cómo predecir la disposición de los átomos en una molécula más adelante. Por ahora, simplemente sepa que las líneas son una indicación de cómo están conectados los átomos en una molécula. Un modelo de bola y varilla muestra la disposición geométrica de los átomos con tamaños atómicos no a escala, y un modelo de relleno de espacio muestra los tamaños relativos de los átomos.
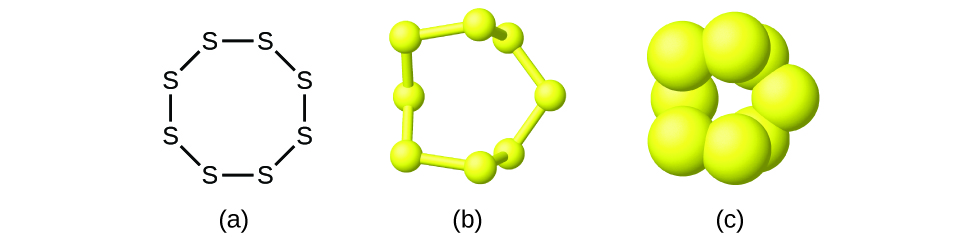
Aunque muchos elementos consisten en átomos individuales discretos, algunos existen como moléculas compuestas por dos o más átomos del elemento unidos químicamente entre sí. Por ejemplo, la mayoría de las muestras de los elementos hidrógeno, oxígeno y nitrógeno están compuestas por moléculas que contienen dos átomos cada una (llamadas moléculas diatómicas) y por lo tanto tienen las fórmulas moleculares H 2, O 2 y N 2, respectivamente. Otros elementos comúnmente encontrados como moléculas diatómicas son flúor (F 2), cloro (Cl 2), bromo (Br 2) y yodo (I 2). La forma más común del elemento azufre está compuesta por moléculas que constan de ocho átomos de azufre; su fórmula molecular es S 8 (Figura\(\PageIndex{2}\)).
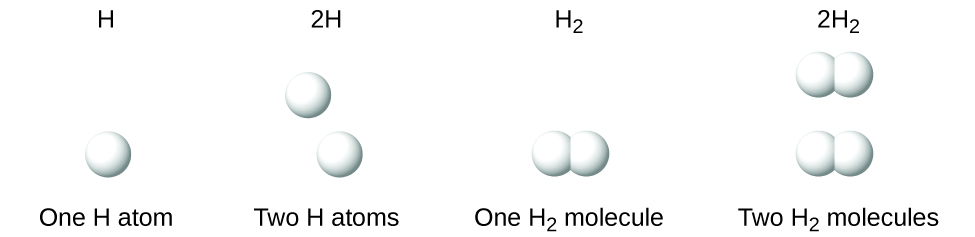
Es importante señalar que un subíndice que sigue a un símbolo y un número delante de un símbolo no representan lo mismo; por ejemplo, H 2 y 2H representan especies claramente diferentes. H 2 es una fórmula molecular; representa una molécula diatómica de hidrógeno, que consiste en dos átomos del elemento que están unidos químicamente entre sí. La expresión 2H, por otro lado, indica dos átomos de hidrógeno separados que no se combinan como una unidad. La expresión 2H 2 representa dos moléculas de hidrógeno diatómico (Figura\(\PageIndex{3}\)).
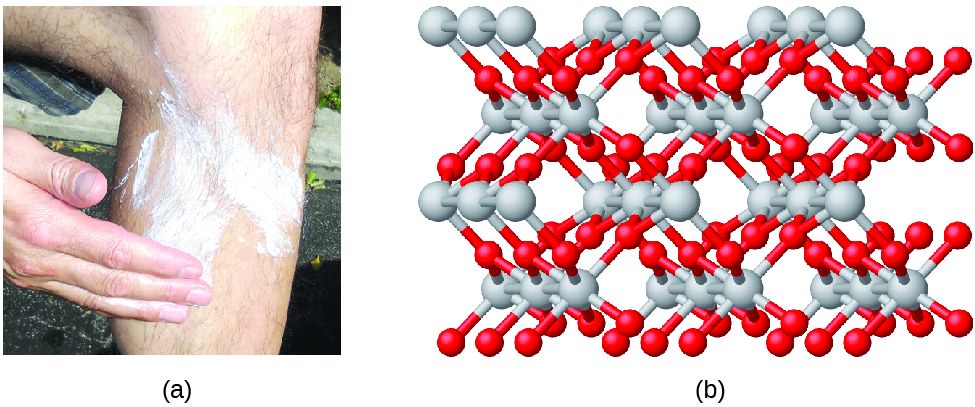
Los compuestos se forman cuando dos o más elementos se combinan químicamente, dando como resultado la formación de enlaces. Por ejemplo, el hidrógeno y el oxígeno pueden reaccionar para formar agua, y el sodio y el cloro pueden reaccionar para formar sal de mesa. A veces se describe la composición de estos compuestos con una fórmula empírica, que indica los tipos de átomos presentes y la relación de número entero más simple del número de átomos (o iones) en el compuesto. Por ejemplo, el dióxido de titanio (utilizado como pigmento en la pintura blanca y en el tipo de protector solar grueso, blanco y bloqueante) tiene una fórmula empírica de TiO 2. Esto identifica los elementos titanio (Ti) y oxígeno (O) como los constituyentes del dióxido de titanio, e indica la presencia del doble de átomos del elemento oxígeno que átomos del elemento titanio (Figura\(\PageIndex{4}\)).
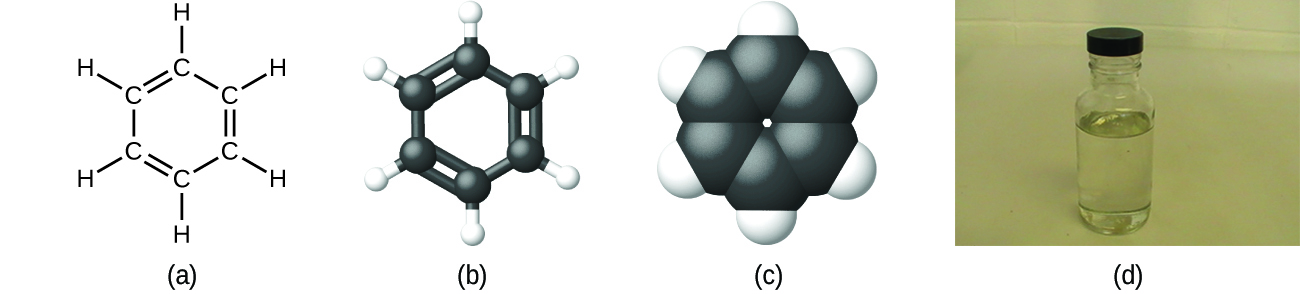
Como se discutió anteriormente, podemos describir un compuesto con una fórmula molecular, en la que los subíndices indican los números reales de átomos de cada elemento en una molécula del compuesto. En muchos casos, la fórmula molecular de una sustancia se deriva de la determinación experimental tanto de su fórmula empírica como de su masa molecular (la suma de las masas atómicas para todos los átomos que componen la molécula). Por ejemplo, se puede determinar experimentalmente que el benceno contiene dos elementos, carbono (C) e hidrógeno (H), y que por cada átomo de carbono en benceno, hay un átomo de hidrógeno. Así, la fórmula empírica es CH. Una determinación experimental de la masa molecular revela que una molécula de benceno contiene seis átomos de carbono y seis átomos de hidrógeno, por lo que la fórmula molecular para el benceno es C 6 H 6 (Figura\(\PageIndex{5}\)).
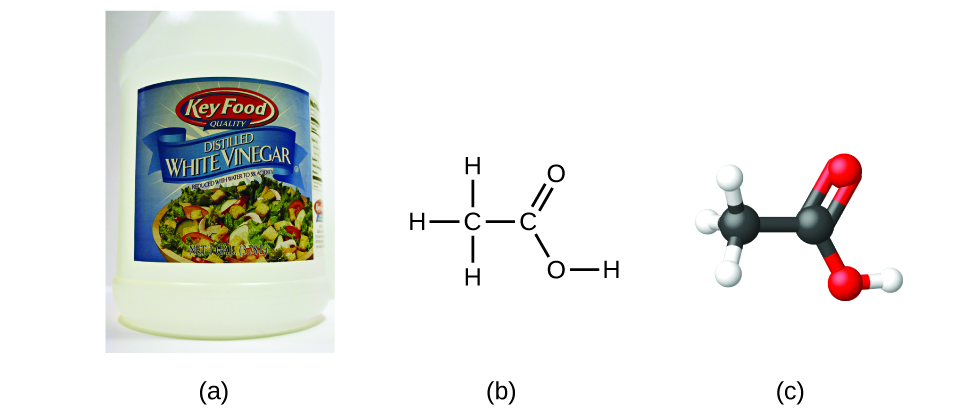
Si conocemos la fórmula de un compuesto, podemos determinar fácilmente la fórmula empírica. (Esto es algo así como un ejercicio académico; la cronología inversa generalmente se sigue en la práctica real). Por ejemplo, la fórmula molecular para el ácido acético, el componente que le da al vinagre su sabor agudo, es C 2 H 4 O 2. Esta fórmula indica que una molécula de ácido acético (Figura\(\PageIndex{6}\)) contiene dos átomos de carbono, cuatro átomos de hidrógeno y dos átomos de oxígeno. La relación de átomos es de 2:4:2. Dividir por el denominador común más bajo (2) da la relación de número entero más simple de átomos, 1:2:1, por lo que la fórmula empírica es CH 2 O. Tenga en cuenta que una fórmula molecular es siempre un múltiplo de número entero de una fórmula empírica.
Las moléculas de glucosa (azúcar en la sangre) contienen 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno. ¿Cuáles son las fórmulas moleculares y empíricas de la glucosa?
Solución
La fórmula molecular es C 6 H 12 O 6 porque una molécula en realidad contiene 6 átomos de C, 12 H y 6 átomos de O. La relación de número entero más simple de átomos de C a H a O en glucosa es 1:2:1, por lo que la fórmula empírica es CH 2 O.
Una molécula de metaldehído (un pesticida utilizado para caracoles y babosas) contiene 8 átomos de carbono, 16 átomos de hidrógeno y 4 átomos de oxígeno. ¿Cuáles son las fórmulas moleculares y empíricas del metaldehído?
- Responder
-
Fórmula molecular, C 8 H 16 O 4; fórmula empírica, C 2 H 4 O
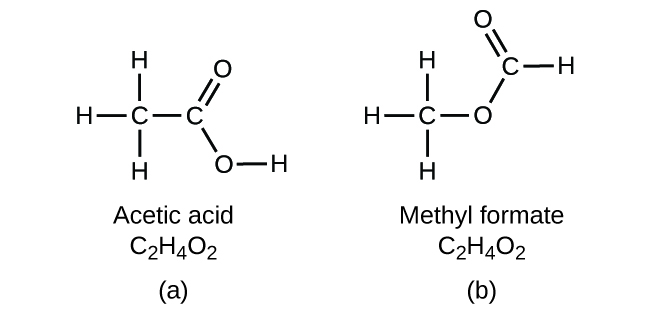
Es importante tener en cuenta que puede ser posible que los mismos átomos estén dispuestos de diferentes maneras: Los compuestos con la misma fórmula molecular pueden tener diferentes enlaces átomo a átomo y por lo tanto diferentes estructuras. Por ejemplo, ¿podría haber otro compuesto con la misma fórmula que el ácido acético, C 2 H 4 O 2? Y de ser así, ¿cuál sería la estructura de sus moléculas?
Si predices que podría existir otro compuesto con la fórmula C 2 H 4 O 2, entonces demostraste un buen conocimiento químico y eres correcto. También se pueden disponer dos átomos de C, cuatro átomos de H y dos átomos de O para formar formiato de metilo, que se utiliza en la fabricación, como insecticida y para acabados de secado rápido. Las moléculas de formiato de metilo tienen uno de los átomos de oxígeno entre los dos átomos de carbono, que difiere de la disposición en las moléculas de ácido acético. El ácido acético y el formiato de metilo son ejemplos de isómeros, compuestos con la misma fórmula química pero diferentes estructuras moleculares (Figura\(\PageIndex{7}\)). Tenga en cuenta que esta pequeña diferencia en la disposición de los átomos tiene un efecto importante en sus respectivas propiedades químicas. Ciertamente no querrás usar una solución de formiato de metilo como sustituto de una solución de ácido acético (vinagre) cuando hagas aderezo para ensaladas.
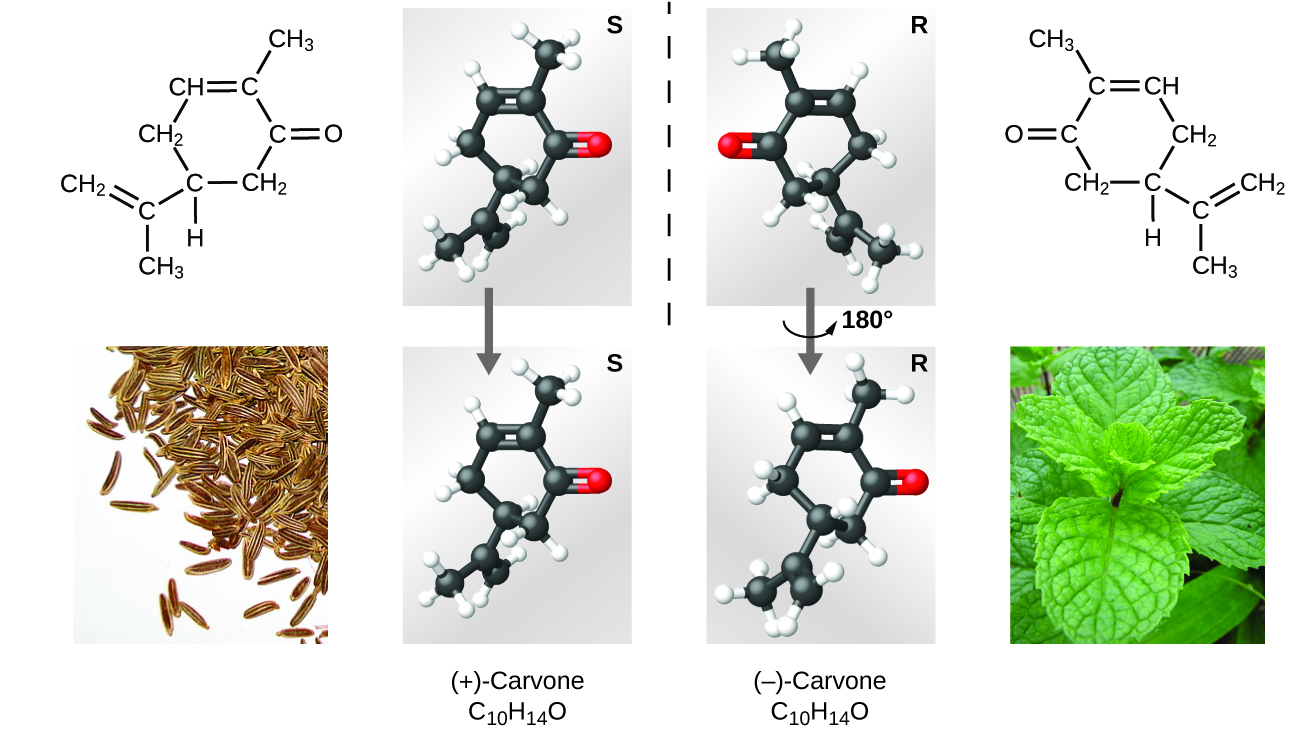
Existen muchos tipos de isómeros (Figura\(\PageIndex{8}\)). El ácido acético y el formiato de metilo son isómeros estructurales, compuestos en los que las moléculas difieren en la forma en que los átomos están conectados entre sí. También existen diversos tipos de isómeros espaciales, en los que las orientaciones relativas de los átomos en el espacio pueden ser diferentes. Por ejemplo, el compuesto carvona (que se encuentra en semillas de alcaravea, menta verde y cáscaras de mandarina) consiste en dos isómeros que son imágenes especulares entre sí. S - (+) -carvone huele a alcaparra, y R - (−) -carvone huele a menta verde.
Resumen
Una fórmula molecular utiliza símbolos químicos y subíndices para indicar los números exactos de diferentes átomos en una molécula o compuesto. Una fórmula empírica da la relación de número entero más simple de átomos en un compuesto. Una fórmula estructural indica la disposición de unión de los átomos en la molécula. Los modelos de bola y palo y relleno de espacio muestran la disposición geométrica de los átomos en una molécula. Los isómeros son compuestos con la misma fórmula molecular pero diferentes disposiciones de átomos.
Glosario
- fórmula empírica
- fórmula que muestra la composición de un compuesto dada como la relación de número entero más simple de átomos
- isómeros
- compuestos con la misma fórmula química pero diferentes estructuras
- fórmula molecular
- fórmula que indica la composición de una molécula de un compuesto y que da el número real de átomos de cada elemento en una molécula del compuesto.
- isómeros espaciales
- compuestos en los que las orientaciones relativas de los átomos en el espacio difieren
- isómero estructural
- una de las dos sustancias que tienen la misma fórmula molecular pero diferentes propiedades físicas y químicas porque sus átomos están unidos de manera diferente
- fórmula estructural
- muestra los átomos en una molécula y cómo están conectados


