2.3: Estructura atómica y simbolismo
- Page ID
- 77606
- Escribir e interpretar símbolos que representen el número atómico, el número de masa y la carga de un átomo o ion
- Definir la unidad de masa atómica y la masa atómica promedio
- Calcular la masa atómica promedio y la abundancia isotópica
El desarrollo de la teoría atómica moderna reveló mucho sobre la estructura interna de los átomos. Se supo que un átomo contiene un núcleo muy pequeño compuesto por protones cargados positivamente y neutrones no cargados, rodeado por un volumen mucho mayor de espacio que contiene electrones cargados negativamente. El núcleo contiene la mayor parte de la masa de un átomo porque los protones y neutrones son mucho más pesados que los electrones, mientras que los electrones ocupan casi todo el volumen de un átomo. El diámetro de un átomo es del orden de 10 −10 m, mientras que el diámetro del núcleo es aproximadamente 10 −15 m—aproximadamente 100.000 veces menor. Para una perspectiva sobre sus tamaños relativos, considere esto: Si el núcleo fuera del tamaño de un arándano, el átomo sería aproximadamente del tamaño de un estadio de fútbol (Figura\(\PageIndex{1}\)).

Los átomos —y los protones, neutrones y electrones que los componen— son extremadamente pequeños. Por ejemplo, un átomo de carbono pesa menos de 2\(\times\) 10 −23 g, y un electrón tiene una carga de menos de 2\(\times\) 10 −19 C (culombio). Al describir las propiedades de objetos diminutos como los átomos, utilizamos apropiadamente pequeñas unidades de medida, como la unidad de masa atómica (amu) y la unidad fundamental de carga (e). El amu se definió originalmente en base al hidrógeno, el elemento más ligero, luego más tarde en términos de oxígeno. Desde 1961, se ha definido con respecto al isótopo de carbono más abundante, a los átomos de los cuales se les asignan masas de exactamente 12 amu. (Este isótopo se conoce como “carbono-12" como se discutirá más adelante en este módulo). Así, un amu es exactamente\(1/12\) de la masa de un átomo de carbono-12:1 amu = 1.6605\(\times\) 10 −24 g. (El Dalton (Da) y la unidad de masa atómica unificada (u) son unidades alternativas que son equivalentes a la amu.) La unidad fundamental de carga (también llamada carga elemental) es igual a la magnitud de la carga de un electrón (e) con e = 1.602\(\times\) 10 −19 C.
Un protón tiene una masa de 1.0073 amu y una carga de 1+. Un neutrón es una partícula ligeramente más pesada con una masa de 1.0087 amu y una carga de cero; como su nombre indica, es neutra. El electrón tiene una carga de 1− y es una partícula mucho más ligera con una masa de aproximadamente 0.00055 amu (tomaría alrededor de 1800 electrones para igualar la masa de un protón. Las propiedades de estas partículas fundamentales se resumen en la Tabla\(\PageIndex{1}\). (Un estudiante observador podría notar que la suma de las partículas subatómicas de un átomo no es igual a la masa real del átomo: La masa total de seis protones, seis neutrones y seis electrones es de 12.0993 amu, ligeramente mayor que las 12.00 amu de un átomo de carbono-12 real. Esta masa “faltante” se conoce como el defecto de masa, y lo aprenderás en el capítulo sobre química nuclear.)
| Nombre | Ubicación | Carga (C) | Carga por unidad | Masa (amu) | Masa (g) |
|---|---|---|---|---|---|
| electrón | núcleo exterior | \(−1.602 \times 10^{−19}\) | 1− | 0.00055 | \(0.00091 \times 10^{−24}\) |
| protón | núcleo | \(1.602 \times 10^{−19}\) | 1+ | 1.00727 | \(1.67262 \times 10^{−24}\) |
| neutrones | núcleo | 0 | 0 | 1.00866 | \(1.67493 \times10^{−24}\) |
El número de protones en el núcleo de un átomo es su número atómico (\(Z\)). Este es el rasgo definitorio de un elemento: Su valor determina la identidad del átomo. Por ejemplo, cualquier átomo que contenga seis protones es el elemento carbono y tiene el número atómico 6, independientemente de cuántos neutrones o electrones pueda tener. Un átomo neutro debe contener el mismo número de cargas positivas y negativas, por lo que el número de protones es igual al número de electrones. Por lo tanto, el número atómico también indica el número de electrones en un átomo. El número total de protones y neutrones en un átomo se denomina su número de masa (A). El número de neutrones es, por lo tanto, la diferencia entre el número de masa y el número atómico: A — Z = número de neutrones.
\ [\ begin {alinear*}
\ ce {atómico\: número\ :( Z)\: &=\ :número\: de\: protones\\
masa\: número\ :( A)\: &=\ :número\: de\: protones + número\: de\: neutrones\\
A-Z\: &=\ :número\: de\: neutrones}
\ fin {alineación*} nonumber\]
Los átomos son eléctricamente neutros si contienen el mismo número de protones cargados positivamente y electrones cargados negativamente. Cuando los números de estas partículas subatómicas no son iguales, el átomo se carga eléctricamente y se denomina ion. La carga de un átomo se define de la siguiente manera:
Carga atómica = número de protones − número de electrones
Como se discutirá con más detalle más adelante en este capítulo, los átomos (y las moléculas) suelen adquirir carga al ganar o perder electrones. Un átomo que gana uno o más electrones exhibirá una carga negativa y se llama anión. Los átomos cargados positivamente llamados cationes se forman cuando un átomo pierde uno o más electrones. Por ejemplo, un átomo de sodio neutro (Z = 11) tiene 11 electrones. Si este átomo pierde un electrón, se convertirá en un catión con una carga 1+ (11 − 10 = 1+). Un átomo de oxígeno neutro (Z = 8) tiene ocho electrones, y si gana dos electrones se convertirá en un anión con una carga 2− (8 − 10 = 2−).
El yodo es un oligoelemento esencial en nuestra dieta; es necesario para producir la hormona tiroidea. La insuficiencia de yodo en la dieta puede conducir al desarrollo de un bocio, un agrandamiento de la glándula tiroides (Figura\(\PageIndex{2}\)).
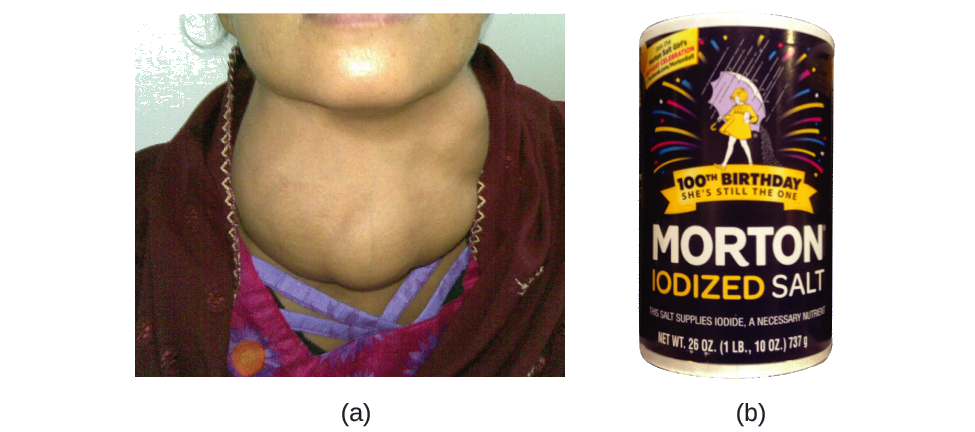
La adición de pequeñas cantidades de yodo a la sal de mesa (sal yodada) esencialmente ha eliminado este problema de salud en Estados Unidos, pero hasta el 40% de la población mundial sigue en riesgo de deficiencia de yodo. Los átomos de yodo se agregan como aniones, y cada uno tiene una carga 1− y un número de masa de 127. Determinar el número de protones, neutrones y electrones en uno de estos aniones yodo.
Solución
El número atómico de yodo (53) nos dice que un átomo de yodo neutro contiene 53 protones en su núcleo y 53 electrones fuera de su núcleo. Debido a que la suma de los números de protones y neutrones es igual al número de masa, 127, el número de neutrones es 74 (127 − 53 = 74). Dado que el yodo se agrega como anión 1−, el número de electrones es 54 [53 — (1—) = 54].
Un ion de platino tiene un número de masa de 195 y contiene 74 electrones. ¿Cuántos protones y neutrones contiene y cuál es su carga?
- Responder
-
78 protones; 117 neutrones; la carga es 4+
Símbolos Químicos
Un símbolo químico es una abreviatura que usamos para indicar un elemento o un átomo de un elemento. Por ejemplo, el símbolo para mercurio es Hg (Figura\(\PageIndex{3}\)). Utilizamos el mismo símbolo para indicar un átomo de mercurio (dominio microscópico) o para etiquetar un contenedor de muchos átomos del elemento mercurio (dominio macroscópico).

Los símbolos para varios elementos comunes y sus átomos se enumeran en la Tabla\(\PageIndex{2}\). Algunos símbolos se derivan del nombre común del elemento; otros son abreviaturas del nombre en otro idioma. Los símbolos tienen una o dos letras, por ejemplo, H para hidrógeno y Cl para cloro. Para evitar confusiones con otras notaciones, solo se pone en mayúscula la primera letra de un símbolo. Por ejemplo, Co es el símbolo para el elemento cobalto, pero CO es la notación para el monóxido de carbono compuesto, que contiene átomos de los elementos carbono (C) y oxígeno (O). Todos los elementos conocidos y sus símbolos están en la tabla periódica.
| Elemento | Símbolo | Elemento | Símbolo |
|---|---|---|---|
| aluminio | Al | hierro | Fe (de ferrum) |
| bromo | Br | plomo | Pb (de plumbum) |
| calcio | Ca | magnesio | Mg |
| carbono | C | mercurio | Hg (de hidrargiro) |
| cloro | Cl | nitrógeno | N |
| cromo | Cr | oxígeno | O |
| cobalto | Co | potasio | K (de kalium) |
| cobre | Cu (de cuprum) | silicio | Si |
| flúor | F | plata | Ag (de argentum) |
| oro | Au (de aurum) | sodio | Na (de natrium) |
| helio | Él | azufre | S |
| hidrógeno | H | hojalata | Sn (de stannum) |
| yodo | I | zinc | Zn |
Tradicionalmente, el descubridor (o descubridores) de un nuevo elemento nombra al elemento. No obstante, hasta que el nombre sea reconocido por la Unión Internacional de Química Pura y Aplicada (IUPAC), el nombre recomendado del nuevo elemento se basa en la (s) palabra (s) latina (s) para su número atómico. Por ejemplo, al elemento 106 se le llamó unnilhexium (Unh), al elemento 107 se le llamó unnilseptio (Uns) y al elemento 108 se le llamó unniloctium (Uno) durante varios años. Estos elementos ahora llevan el nombre de científicos o localizaciones; por ejemplo, el elemento 106 ahora se conoce como seaborgium (Sg) en honor a Glenn Seaborg, ganador del Premio Nobel que estuvo activo en el descubrimiento de varios elementos pesados.
Isótopos
El símbolo para un isótopo específico de cualquier elemento se escribe colocando el número de masa como un superíndice a la izquierda del símbolo del elemento (Figura\(\PageIndex{4}\)). El número atómico a veces se escribe como un subíndice que precede al símbolo, pero como este número define la identidad del elemento, al igual que su símbolo, a menudo se omite. Por ejemplo, el magnesio existe como una mezcla de tres isótopos, cada uno con un número atómico de 12 y con números de masa de 24, 25 y 26, respectivamente. Estos isótopos pueden identificarse como 24 Mg, 25 Mg y 26 Mg. Estos símbolos isótopos se leen como “elemento, número de masa” y pueden simbolizarse de manera consistente con esta lectura. Por ejemplo, 24 Mg se lee como “magnesio 24” y se puede escribir como “magnesio-24" o “Mg-24". 25 Mg se lee como “magnesio 25” y se puede escribir como “magnesio-25” o “Mg-25". Todos los átomos de magnesio tienen 12 protones en su núcleo. Se diferencian sólo porque un átomo de 24 Mg tiene 12 neutrones en su núcleo, un átomo de 25 Mg tiene 13 neutrones y un 26 Mg tiene 14 neutrones.
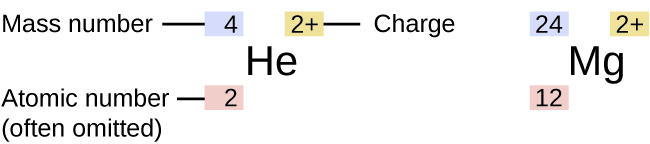
La información sobre los isótopos naturales de elementos con números atómicos del 1 al 10 se da en la Tabla\(\PageIndex{2}\). Tenga en cuenta que además de los nombres y símbolos estándar, a menudo se hace referencia a los isótopos de hidrógeno usando nombres comunes y símbolos acompañantes. El hidrógeno-2, simbolizado 2 H, también se llama deuterio y a veces simboliza D. El hidrógeno-3, simbolizado 3 H, también se llama tritio y a veces simbolizado T.
| Elemento | Símbolo | Número atómico | Número de protones | Número de Neutrones | Masa (amu) | % Abundancia Natural |
|---|---|---|---|---|---|---|
| hidrógeno | \(\ce{^1_1H}\) (protio) |
1 | 1 | 0 | 1.0078 | 99.989 |
| \(\ce{^2_1H}\) (deuterio) |
1 | 1 | 1 | 2.0141 | 0.0115 | |
| \(\ce{^3_1H}\) (tritio) |
1 | 1 | 2 | 3.01605 | — (traza) | |
| helio | \(\ce{^3_2He}\) | 2 | 2 | 1 | 3.01603 | 0.00013 |
| \(\ce{^4_2He}\) | 2 | 2 | 2 | 4.0026 | 100 | |
| litio | \(\ce{^6_3Li}\) | 3 | 3 | 3 | 6.0151 | 7.59 |
| \(\ce{^7_3Li}\) | 3 | 3 | 4 | 7.0160 | 92.41 | |
| berilio | \(\ce{^9_4Be}\) | 4 | 4 | 5 | 9.0122 | 100 |
| boro | \(\ce{^{10}_5B}\) | 5 | 5 | 5 | 10.0129 | 19.9 |
| \(\ce{^{11}_5B}\) | 5 | 5 | 6 | 11.0093 | 80.1 | |
| carbono | \(\ce{^{12}_6C}\) | 6 | 6 | 6 | 12.0000 | 98.89 |
| \(\ce{^{13}_6C}\) | 6 | 6 | 7 | 13.0034 | 1.11 | |
| \(\ce{^{14}_6C}\) | 6 | 6 | 8 | 14.0032 | — (traza) | |
| nitrógeno | \(\ce{^{14}_7N}\) | 7 | 7 | 7 | 14.0031 | 99.63 |
| \(\ce{^{15}_7N}\) | 7 | 7 | 8 | 15.0001 | 0.37 | |
| oxígeno | \(\ce{^{16}_8O}\) | 8 | 8 | 8 | 15.9949 | 99.757 |
| \(\ce{^{17}_8O}\) | 8 | 8 | 9 | 16.9991 | 0.038 | |
| \(\ce{^{18}_8O}\) | 8 | 8 | 10 | 17.9992 | 0.205 | |
| flúor | \(\ce{^{19}_9F}\) | 9 | 9 | 10 | 18.9984 | 100 |
| neón | \(\ce{^{20}_{10}Ne}\) | 10 | 10 | 10 | 19.9924 | 90.48 |
| \(\ce{^{21}_{10}Ne}\) | 10 | 10 | 11 | 20.9938 | 0.27 | |
| \(\ce{^{22}_{10}Ne}\) | 10 | 10 | 12 | 21.9914 | 9.25 |
Masa atómica
Debido a que cada protón y cada neutrón aportan aproximadamente una amu a la masa de un átomo, y cada electrón contribuye mucho menos, la masa atómica de un solo átomo es aproximadamente igual a su número de masa (un número entero). Sin embargo, las masas promedio de átomos de la mayoría de los elementos no son números enteros porque la mayoría de los elementos existen naturalmente como mezclas de dos o más isótopos.
La masa de un elemento que se muestra en una tabla periódica o enumerada en una tabla de masas atómicas es una masa promedio ponderada de todos los isótopos presentes en una muestra natural de ese elemento. Esto es igual a la suma de la masa de cada isótopo individual multiplicada por su abundancia fraccional.
\[\mathrm{average\: mass}=\sum_{i}(\mathrm{fractional\: abundance\times isotopic\: mass})_i \nonumber \]
Por ejemplo, el elemento boro está compuesto por dos isótopos: Alrededor del 19.9% de todos los átomos de boro son 10 B con una masa de 10.0129 amu, y el restante 80,1% son 11 B con una masa de 11.0093 amu. La masa atómica promedio para el boro se calcula de manera que sea:
\ [\ begin {align*}
\ textrm {boro masa promedio} &=\ mathrm {(0.199\ times10.0129\: amu) + (0.801\ times11.0093\: amu)}\\
&=\ mathrm {1.99\: amu+8.82\: amu}\\
&=\ mathrm {10.81\: amu}
\ end {align*}\ nonumber\]
Es importante entender que ningún átomo de boro solo pesa exactamente 10.8 amu; 10.8 amu es la masa promedio de todos los átomos de boro, y los átomos de boro individuales pesan aproximadamente 10 amu o 11 amu.
Un meteorito encontrado en el centro de Indiana contiene rastros del neón de gas noble recogido del viento solar durante el viaje del meteorito a través del sistema solar. El análisis de una muestra del gas mostró que consistió en 91.84% 20 Ne (masa 19.9924 amu), 0.47% 21 Ne (masa 20.9940 amu) y 7.69% 22 Ne (masa 21.9914 amu). ¿Cuál es la masa promedio del neón en el viento solar?
Solución n
\ [\ begin {align*}
\ mathrm {promedio\: masa} &=\ mathrm {(0.9184\ horas19.9924\: amu) + (0.0047\ horas20.9940\: amu) + (0.0769\ horas21.9914\: amu)}\\
&=\ mathrm {(18.36+0.099+1.69)\ :amu}\\
&= mathrm {20.15\: amu}
\ end {align*}\ nonumber\]
La masa promedio de un átomo de neón en el viento solar es de 20.15 amu. (La masa promedio de un átomo de neón terrestre es de 20.1796 amu. Este resultado demuestra que podemos encontrar ligeras diferencias en la abundancia natural de isótopos, dependiendo de su origen).
Se encontró que una muestra de magnesio contiene 78.70% de 24 átomos de Mg (masa 23.98 amu), 10.13% de 25 átomos de Mg (masa 24.99 amu) y 11.17% de 26 átomos de Mg (masa 25.98 amu). Calcular la masa promedio de un átomo de Mg.
- Responder
-
24.31 amu
También podemos hacer variaciones de este tipo de cálculo, como se muestra en el siguiente ejemplo.
El cloro natural consiste en 35 Cl (masa 34.96885 amu) y 37 Cl (masa 36.96590 amu), con una masa promedio de 35.453 amu. ¿Cuál es la composición porcentual del Cl en términos de estos dos isótopos?
Solución
La masa promedio de cloro es la fracción que es 35 Cl veces la masa de 35 Cl más la fracción que es 37 Cl por la masa de 37 Cl.
\[\mathrm{average\: mass=(fraction\: of\: ^{35}Cl\times mass\: of\: ^{35}Cl)+(fraction\: of\: ^{37}Cl\times mass\: of\: ^{37}Cl)} \nonumber \]
Si dejamos que x represente la fracción que es 35 Cl, entonces la fracción que es 37 Cl está representada por 1.00 − x.
(La fracción que es 35 Cl + la fracción que es 37 Cl debe sumar hasta 1, por lo que la fracción de 37 Cl debe ser igual a 1.00 − la fracción de 35 Cl.)
Sustituyendo esto en la ecuación de masa promedio, tenemos:
\ [\ begin {align*}
\ mathrm {35.453\: amu} & =( x\ times 34.96885\:\ ce {amu}) + [(1.00-x)\ times 36.96590\:\ ce {amu}]\\
35.453 &=34.96885x+36.96590-36.96590x\\
1.99705x &=1.513\
x&=\ dfrac {1.513} {1.99705} =0.7576
\ final {alinear*}\ nonumber\]
Entonces resolviendo rendimientos: x = 0.7576, lo que significa que 1.00 − 0.7576 = 0.2424. Por lo tanto, el cloro consiste en 75.76% 35 Cl y 24.24% 37 Cl.
El cobre natural consiste en 63 Cu (masa 62.9296 amu) y 65 Cu (masa 64.9278 amu), con una masa promedio de 63.546 amu. ¿Cuál es la composición porcentual del Cu en términos de estos dos isótopos?
- Responder
-
69.15% Cu-63 y 30.85% Cu-65
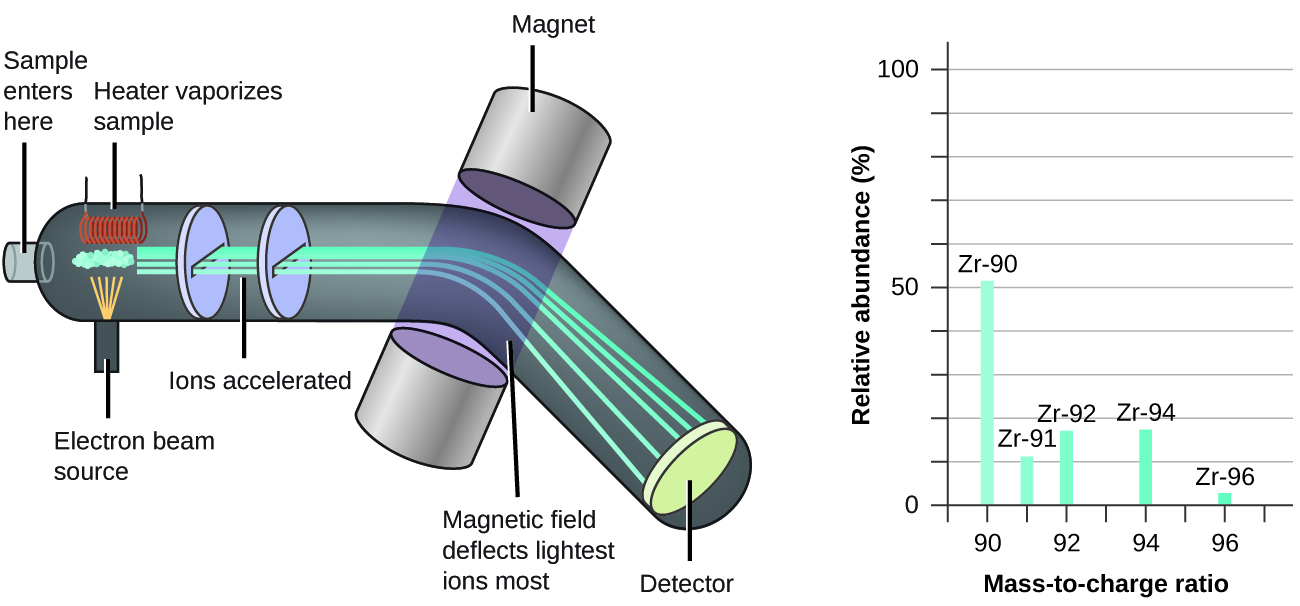
La ocurrencia y abundancias naturales de isótopos se pueden determinar experimentalmente usando un instrumento llamado espectrómetro de masas. La espectrometría de masas (EM) es ampliamente utilizada en química, forense, medicina, ciencias ambientales y muchos otros campos para analizar y ayudar a identificar las sustancias en una muestra de material. En un espectrómetro de masas típico (Figura\(\PageIndex{5}\)), la muestra se vaporiza y se expone a un haz de electrones de alta energía que hace que los átomos (o moléculas) de la muestra se carguen eléctricamente, típicamente al perder uno o más electrones. Estos cationes luego pasan a través de un campo eléctrico o magnético (variable) que desvía la trayectoria de cada catión en una medida que depende tanto de su masa como de su carga (similar a como la trayectoria de un gran rodamiento de bolas de acero rodando más allá de un imán se desvía en menor medida que la de un pequeño BB de acero). Se detectan los iones y se realiza una gráfica del número relativo de iones generados frente a sus relaciones masa-carga (un espectro de masas). La altura de cada característica vertical o pico en un espectro de masas es proporcional a la fracción de cationes con la relación masa/carga especificada. Desde su uso inicial durante el desarrollo de la teoría atómica moderna, la EM ha evolucionado hasta convertirse en una poderosa herramienta para el análisis químico en una amplia gama de aplicaciones.
Video\(\PageIndex{1}\): Vea este video de la Royal Society for Chemistry para una breve descripción de los rudimentos de la espectrometría de masas.
Resumen
Un átomo consiste en un núcleo pequeño, cargado positivamente, rodeado de electrones. El núcleo contiene protones y neutrones; su diámetro es aproximadamente 100.000 veces menor que el del átomo. La masa de un átomo generalmente se expresa en unidades de masa atómica (amu), que se conoce como la masa atómica. Una amu se define como exactamente\(1/12\) de la masa de un átomo de carbono-12 y es igual a 1.6605\(\times\) 10 −24 g.
Los protones son partículas relativamente pesadas con una carga de 1+ y una masa de 1.0073 amu. Los neutrones son partículas relativamente pesadas sin carga y una masa de 1.0087 amu. Los electrones son partículas ligeras con una carga de 1− y una masa de 0.00055 amu. El número de protones en el núcleo se denomina número atómico (Z) y es la propiedad que define la identidad elemental de un átomo. La suma de los números de protones y neutrones en el núcleo se denomina número de masa y, expresada en amu, es aproximadamente igual a la masa del átomo. Un átomo es neutro cuando contiene igual número de electrones y protones.
Los isótopos de un elemento son átomos con el mismo número atómico pero diferentes números de masa; los isótopos de un elemento, por lo tanto, difieren entre sí solo en el número de neutrones dentro del núcleo. Cuando un elemento natural está compuesto por varios isótopos, la masa atómica del elemento representa el promedio de las masas de los isótopos involucrados. Un símbolo químico identifica los átomos en una sustancia usando símbolos, que son abreviaturas de una, dos o tres letras para los átomos.
Ecuaciones Clave
- \(\mathrm{average\: mass}=\sum_{i}(\mathrm{fractional\: abundance \times isotopic\: mass})_i\)
Glosario
- anión
- átomo o molécula cargada negativamente (contiene más electrones que protones)
- masa atómica
- masa promedio de átomos de un elemento, expresada en amu
- unidad de masa atómica (amu)
- (también, unidad unificada de masa atómica, u, o Dalton, Da) unidad de masa igual a\(\dfrac{1}{12}\) la masa de un átomo de 12 C
- número atómico (Z)
- número de protones en el núcleo de un átomo
- catión
- átomo o molécula cargada positivamente (contiene menos electrones que protones)
- símbolo químico
- abreviatura de una, dos o tres letras utilizada para representar un elemento o sus átomos
- Dalton
- unidad alternativa equivalente a la unidad de masa atómica
- unidad fundamental de carga
- (también llamada carga elemental) es igual a la magnitud de la carga de un electrón (e) con e = 1.602\(\times\) 10 −19 C
- ion
- átomo o molécula cargada eléctricamente (contiene números desiguales de protones y electrones)
- número de masa (A)
- suma de los números de neutrones y protones en el núcleo de un átomo
- unidad unificada de masa atómica (u)
- unidad alternativa equivalente a la unidad de masa atómica
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).


