3.3: Desarrollo de la Teoría Cuántica
- Page ID
- 77626
- Extender también a la materia el concepto de dualidad onda-partícula que se observó en la radiación electromagnética
- Comprender la idea general de la descripción mecánica cuántica de los electrones en un átomo, y que utiliza la noción de funciones de onda tridimensionales, u orbitales, que definen la distribución de probabilidad para encontrar un electrón en una parte particular del espacio
- Enumere y describa rasgos de los cuatro números cuánticos que forman la base para especificar completamente el estado de un electrón en un átomo
El modelo de Bohr explicó los datos experimentales para el átomo de hidrógeno y fue ampliamente aceptado, pero también planteó muchas preguntas. ¿Por qué los electrones orbitaron solo a distancias fijas definidas por un solo número cuántico n = 1, 2, 3, y así sucesivamente, pero nunca en el medio? ¿Por qué el modelo funcionó tan bien describiendo hidrógeno e iones de un electrón, pero no pudo predecir correctamente el espectro de emisión para helio o cualquier átomo más grande? Para responder a estas preguntas, los científicos necesitaban revisar completamente la forma en que pensaban sobre la materia.
Comportamiento en el Mundo Microscópico
Sabemos cómo se comporta la materia en el mundo macroscópico: los objetos que son lo suficientemente grandes como para ser vistos a simple vista siguen las reglas de la física clásica. Una bola de billar que se mueve sobre una mesa se comportará como una partícula: Continuará en línea recta a menos que choque con otra bola o el cojín de la mesa, o sea actuada por alguna otra fuerza (como la fricción). La pelota tiene una posición y velocidad bien definidas (o un momento bien definido,\(p = mv\), definido por la masa\(m\) y la velocidad\(v\)) en cualquier momento dado. Es decir, la pelota se mueve en una trayectoria clásica. Este es el comportamiento típico de un objeto clásico.
Cuando las olas interactúan entre sí, muestran patrones de interferencia que no son mostrados por partículas macroscópicas como la bola de billar. Por ejemplo, las olas que interactúan en la superficie del agua pueden producir patrones de interferencia similares a los que se muestran en la Figura\(\PageIndex{1}\). Este es un caso de comportamiento de onda en la escala macroscópica, y es claro que las partículas y las ondas son fenómenos muy diferentes en el ámbito macroscópico.

A medida que las mejoras tecnológicas permitieron a los científicos sondear el mundo microscópico con mayor detalle, se hizo cada vez más claro para la década de 1920 que piezas muy pequeñas de materia siguen un conjunto de reglas diferente a las que observamos para objetos grandes. La incuestionable separación de ondas y partículas ya no era el caso para el mundo microscópico.
Una de las primeras personas en prestar atención al comportamiento especial del mundo microscópico fue Louis de Broglie. Hizo la pregunta: Si la radiación electromagnética puede tener un carácter similar a partículas, ¿pueden los electrones y otras partículas submicroscópicas exhibir un carácter ondular? En su tesis doctoral de 1925, de Broglie extendió la dualidad onda-partícula de la luz que Einstein utilizó para resolver la paradoja del efecto fotoeléctrico a las partículas materiales. Predijo que una partícula con masa m y velocidad v (es decir, con impulso lineal p) también debería exhibir el comportamiento de una onda con un valor de longitud de onda λ, dado por esta expresión en la que h es la constante familiar de Planck
\[\lambda=\dfrac{h}{mv}=\dfrac{h}{p} \label{6.4.1} \]
A esto se le llama la longitud de onda de Broglie. A diferencia de los otros valores de λ discutidos en este capítulo, la longitud de onda de Broglie es una característica de las partículas y otros cuerpos, no de la radiación electromagnética (nótese que esta ecuación involucra velocidad [v, m/s], no frecuencia [ν, Hz]. Aunque estos dos símbolos son idénticos, significan cosas muy diferentes). Donde Bohr había postulado que el electrón era una partícula que orbita el núcleo en órbitas cuantificadas, de Broglie argumentó que la suposición de Bohr de cuantificación puede explicarse si el electrón no se considera como una partícula, sino como una onda estacionaria circular tal que solo un número entero de longitudes de onda podría encajar exactamente dentro de la órbita (Figura\(\PageIndex{2}\)).
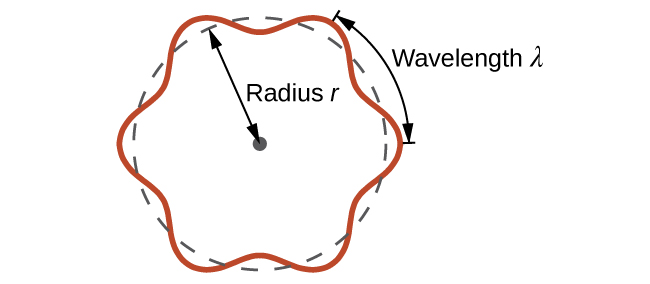
Para una órbita circular de radio r, la circunferencia es 2πr, y así la condición de Broglie es:
\[2πr=nλ \label{6.4.3} \]
con\(n=1,2,3,...\)
Dado que la expresión de Broglie relaciona la longitud de onda con el momento y, por lo tanto, la velocidad, esto implica:
\[2πr=nλ=\dfrac{nh}{p}=\dfrac{nh}{mv}=\dfrac{nhr}{mvr}=\dfrac{nhr}{L} \label{6.4.3b} \]
Esta expresión se puede reorganizar para dar la fórmula de Bohr para la cuantificación del momento angular:
\[L=\dfrac{nh}{2π}=n \hbar \label{6.4.4} \]
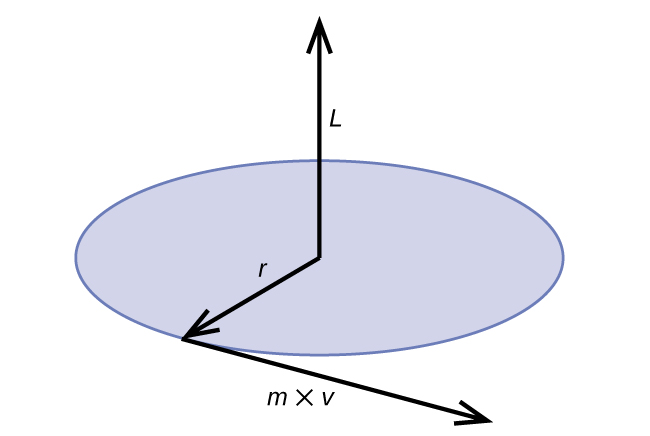
El momento angular clásico L para un movimiento circular es igual al producto del radio del círculo y el momento de la partícula móvil p.
\[L=rp=rmv \;\;\; \text{(for a circular motion)} \label{6.4.5} \]
Poco después de que de Broglie propusiera la naturaleza de onda de la materia, dos científicos de los Laboratorios Bell, C. J. Davisson y L. H. Germer, demostraron experimentalmente que los electrones pueden exhibir un comportamiento similar a una onda al mostrar un patrón de interferencia para electrones que viajan a través de un patrón atómico en un cristal. Las capas atómicas regularmente espaciadas sirvieron como hendiduras, como se usa en otros experimentos de interferencia. Dado que el espaciamiento entre las capas que sirven como hendiduras debe ser similar en tamaño a la longitud de onda de la onda probada para que se forme un patrón de interferencia, Davisson y Germer usaron un objetivo de níquel cristalino para sus “hendiduras”, ya que el espaciamiento de los átomos dentro de la red era aproximadamente el mismo que el de Longitudes de onda Broglie de los electrones que utilizaron. La figura\(\PageIndex{4}\) muestra un patrón de interferencia.
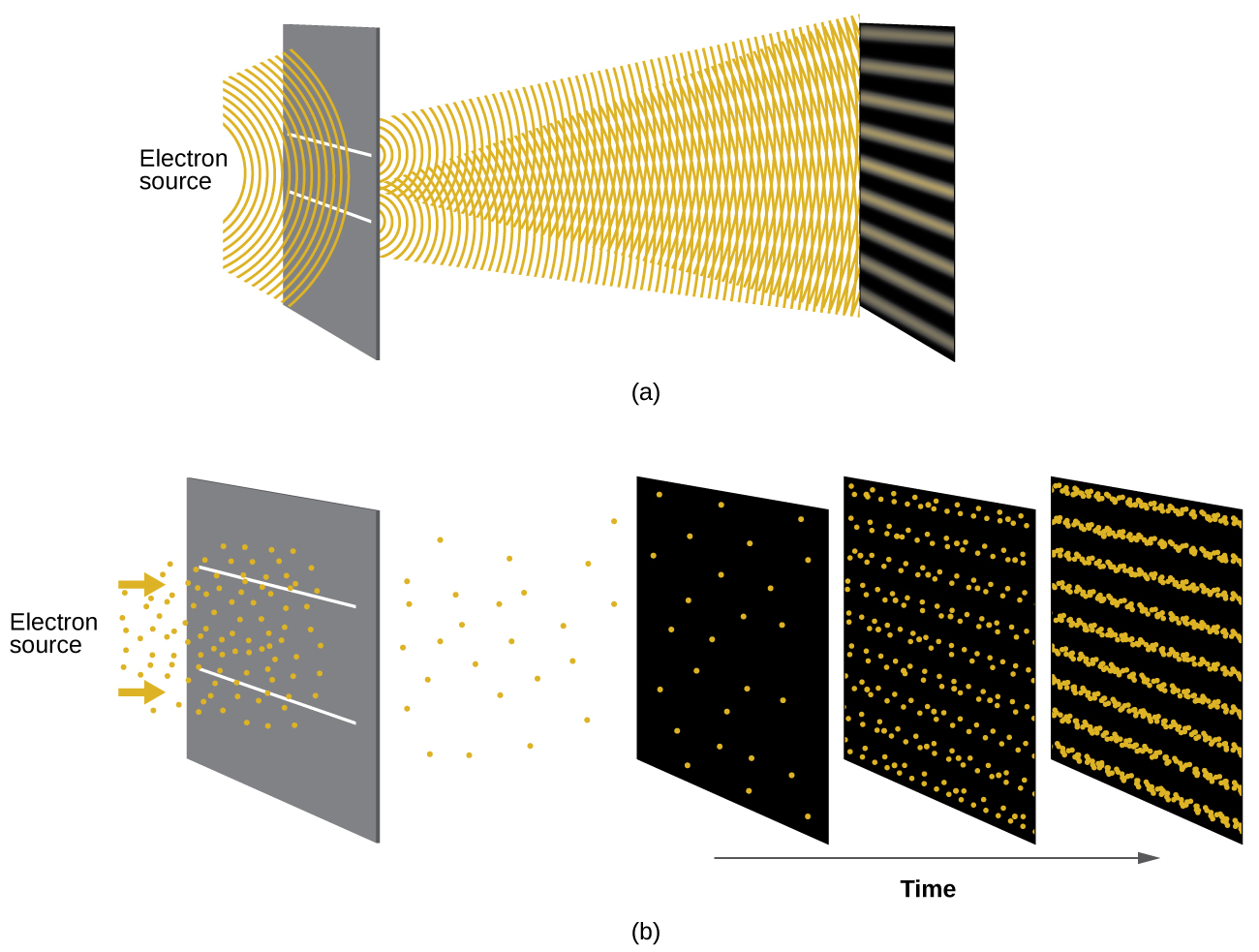
La dualidad onda-partícula de la materia se puede ver observando lo que sucede si las colisiones de electrones se registran durante un largo período de tiempo. Inicialmente, cuando sólo se han registrado unos pocos electrones, muestran un claro comportamiento similar a las partículas, habiendo llegado en pequeños paquetes localizados que parecen ser aleatorios. A medida que más y más electrones llegaban y se registraban, surgió un claro patrón de interferencia que es el sello distintivo del comportamiento ondular. Así, parece que si bien los electrones son pequeñas partículas localizadas, su movimiento no sigue las ecuaciones de movimiento implícitas por la mecánica clásica, sino que se rige por algún tipo de ecuación de onda que gobierna una distribución de probabilidad incluso para el movimiento de un solo electrón. Así, la dualidad onda-partícula observada por primera vez con fotones es en realidad un comportamiento fundamental intrínseco a todas las partículas cuánticas.
Si un electrón viaja a una velocidad de 1.000 × 10 7 m s —1 y tiene una masa de 9.109 × 10 —28 g, ¿cuál es su longitud de onda?
Solución
Podemos usar la ecuación de Broglie para resolver este problema, pero primero debemos hacer una conversión unitaria de la constante de Planck. Aprendiste antes que 1 J = 1 kg m 2 /s 2. Así, podemos escribir h = 6.626 × 10 —34 J s como 6.626 × 10 —34 kg m 2 /s.
\[\begin{align*} λ&=\dfrac{h}{mv} \\[4pt] &=\mathrm{\dfrac{6.626×10^{−34}\:kg\: m^2/s}{(9.109×10^{−31}\:kg)(1.000×10^7\:m/s)}}\\[4pt] &= \mathrm{7.274×10^{−11}\:m} \end{align*} \nonumber \]
Este es un valor pequeño, pero es significativamente mayor que el tamaño de un electrón en la vista clásica (partícula). Este tamaño es del mismo orden de magnitud que el tamaño de un átomo. Esto significa que el comportamiento de tipo onda de electrones va a ser notable en un átomo.
Calcular la longitud de onda de un softbol con una masa de 100 g viajando a una velocidad de 35 m s —1, asumiendo que puede modelarse como una sola partícula.
- Contestar
-
1.9 × 10 —34 m.
Nunca pensamos en un softbol lanzado que tenga una longitud de onda, ya que esta longitud de onda es tan pequeña que es imposible que nuestros sentidos o cualquier instrumento conocido detecten (estrictamente hablando, la longitud de onda de un beisbol real correspondería a las longitudes de onda de sus átomos y moléculas constituyentes, que, aunque mucho más grandes que este valor, seguiría siendo microscópicamente minúsculo). La longitud de onda de Broglie solo es apreciable por materia que tiene una masa muy pequeña y/o una velocidad muy alta.
Werner Heisenberg consideró los límites de la precisión con la que podemos medir las propiedades de un electrón u otras partículas microscópicas. Determinó que existe un límite fundamental para la precisión con la que se puede medir tanto la posición de una partícula como su impulso simultáneamente. Cuanto más exactamente medimos el impulso de una partícula, con menor precisión podremos determinar su posición en ese momento, y viceversa. Esto se resume en lo que ahora llamamos el principio de incertidumbre de Heisenberg: Es fundamentalmente imposible determinar simultánea y exactamente tanto el impulso como la posición de una partícula. Para una partícula de masa m que se mueve con velocidad v x en la dirección x (o equivalentemente con el impulso p x), el producto de la incertidumbre en la posición, Δ x, y la incertidumbre en el momento, Δ p x, debe ser mayor o igual a\(\dfrac{ℏ}{2}\) (recordemos que\(ℏ=\dfrac{h}{2π}\), el valor de la constante de Planck dividido por 2 π).
\[Δx×Δp_x=(Δx)(mΔv)≥\dfrac{ℏ}{2} \nonumber \]
Esta ecuación nos permite calcular el límite a la precisión con la que podemos conocer tanto la posición simultánea de un objeto como su impulso. Por ejemplo, si mejoramos nuestra medición de la posición de un electrón para que la incertidumbre en la posición (Δ x) tenga un valor de, digamos, 1 pm (10 —12 m, aproximadamente 1% del diámetro de un átomo de hidrógeno), entonces nuestra determinación de su impulso debe tener una incertidumbre con un valor de al menos
\[\left [Δp=mΔv=\dfrac{h}{(2Δx)} \right ]=\mathrm{\dfrac{(1.055×10^{−34}\:kg\: m^2/s)}{(2×1×10^{−12}\:m)}=5×10^{−23}\:kg\: m/s.} \nonumber \]
El valor de no es grande, por lo que la incertidumbre en la posición o ímpetu de un objeto macroscópico como una pelota de béisbol es demasiado insignificante de observar. Sin embargo, la masa de un objeto microscópico como un electrón es lo suficientemente pequeña como para que la incertidumbre pueda ser grande y significativa.
Cabe señalar que el principio de incertidumbre de Heisenberg no solo se limita a las incertidumbres en la posición y el impulso, sino que también vincula otras variables dinámicas. Por ejemplo, cuando un átomo absorbe un fotón y realiza una transición de un estado energético a otro, la incertidumbre en la energía y la incertidumbre en el tiempo requerido para la transición se relacionan de manera similar, como Δ E Δ t ≥\(\dfrac{ℏ}{2}\). Como se discutirá más adelante, incluso los componentes vectoriales del momento angular no pueden especificarse todos exactamente simultáneamente.
El principio de Heisenberg impone límites finales a lo que es cognoscible en la ciencia. Se puede demostrar que el principio de incertidumbre es consecuencia de la dualidad onda-partícula, que se encuentra en el centro de lo que distingue a la teoría cuántica moderna de la mecánica clásica. Recordemos que las ecuaciones de movimiento obtenidas de la mecánica clásica son trayectorias donde, en cualquier instante dado en el tiempo, tanto la posición como el momento de una partícula pueden determinarse con exactitud. El principio de incertidumbre de Heisenberg implica que tal visión es insostenible en el dominio microscópico y que existen limitaciones fundamentales que rigen el movimiento de las partículas cuánticas. Esto no quiere decir que las partículas microscópicas no se muevan en trayectorias, es solo que las mediciones de trayectorias están limitadas en su precisión. En el ámbito de la mecánica cuántica, las mediciones introducen cambios en el sistema que se está observando.
El modelo cuántico mecánico de un átomo
Poco después de que de Broglie publicara sus ideas de que el electrón en un átomo de hidrógeno podría pensarse mejor como una onda estacionaria circular en lugar de una partícula que se mueve en órbitas circulares cuantificadas, como Bohr había argumentado, Erwin Schrödinger extendió la obra de Broglie incorporando la relación de Broglie en un ecuación de onda, derivando lo que hoy se conoce como la ecuación de Schrödinger. Cuando Schrödinger aplicó su ecuación a átomos similares al hidrógeno, pudo reproducir la expresión de Bohr para la energía y, por lo tanto, la fórmula de Rydberg que rige los espectros de hidrógeno, y lo hizo sin tener que invocar las suposiciones de Bohr de estados estacionarios y órbitas cuantificadas, momentos angulares y energías; La cuantificación en la teoría de Schrödinger fue una consecuencia natural de las matemáticas subyacentes de la ecuación de onda. Al igual que de Broglie, Schrödinger inicialmente vio al electrón en hidrógeno como una onda física en lugar de una partícula, pero donde de Broglie pensó en el electrón en términos de ondas estacionarias circulares, Schrödinger pensó adecuadamente en términos de ondas estacionarias tridimensionales, o funciones de onda, representado por la letra griega psi, ψ. Unos años después, Max Born propuso una interpretación de la función de onda ψ que todavía se acepta hoy en día: Los electrones siguen siendo partículas, y así las ondas representadas por ψ no son ondas físicas sino, en cambio, son amplitudes de probabilidad complejas. El cuadrado de la magnitud de una función de onda\(∣ψ∣^2\) describe la probabilidad de que la partícula cuántica esté presente cerca de una determinada ubicación en el espacio. Esto significa que las funciones de onda pueden ser utilizadas para determinar la distribución de la densidad del electrón con respecto al núcleo en un átomo. En la forma más general, la ecuación de Schrödinger puede escribirse como:
\[\hat{H}ψ=Eψ \nonumber \]
\(\hat{H}\)es el operador hamiltoniano, un conjunto de operaciones matemáticas que representan la energía total de la partícula cuántica (como un electrón en un átomo), ψ es la función de onda de esta partícula que se puede utilizar para encontrar la distribución especial de la probabilidad de encontrar la partícula, y \(E\)es el valor real de la energía total de la partícula.
El trabajo de Schrödinger, así como el de Heisenberg y muchos otros científicos que siguen sus pasos, generalmente se conoce como mecánica cuántica.
Comprensión de la teoría cuántica de los electrones en los átomos
El objetivo de esta sección es comprender los orbitales de electrones (ubicación de los electrones en los átomos), sus diferentes energías y otras propiedades. El uso de la teoría cuántica proporciona la mejor comprensión de estos temas. Este conocimiento es un precursor de la unión química.
Como se describió anteriormente, los electrones en los átomos solo pueden existir en niveles discretos de energía pero no entre ellos. Se dice que la energía de un electrón en un átomo se cuantifica, es decir, puede ser igual sólo a ciertos valores específicos y puede saltar de un nivel de energía a otro pero no hacer una transición suave o permanecer entre estos niveles.
Los niveles de energía se etiquetan con un valor n, donde n = 1, 2, 3,... En términos generales, la energía de un electrón en un átomo es mayor para mayores valores de n. Este número, n, se conoce como el número cuántico principal. El número cuántico principal define la ubicación del nivel de energía. Es esencialmente el mismo concepto que la n en la descripción del átomo de Bohr. Otro nombre para el número cuántico principal es el número de shell. Las conchas de un átomo pueden pensarse en círculos concéntricos que irradian desde el núcleo. Los electrones que pertenecen a una cáscara específica son más probables que se encuentren dentro del área circular correspondiente. Cuanto más avanzamos del núcleo, mayor será el número de conchas, y así mayor será el nivel de energía (Figura\(\PageIndex{5}\)). Los protones cargados positivamente en el núcleo estabilizan los orbitales electrónicos por atracción electrostática entre las cargas positivas de los protones y las cargas negativas de los electrones. Entonces, cuanto más lejos está el electrón del núcleo, mayor es la energía que tiene.
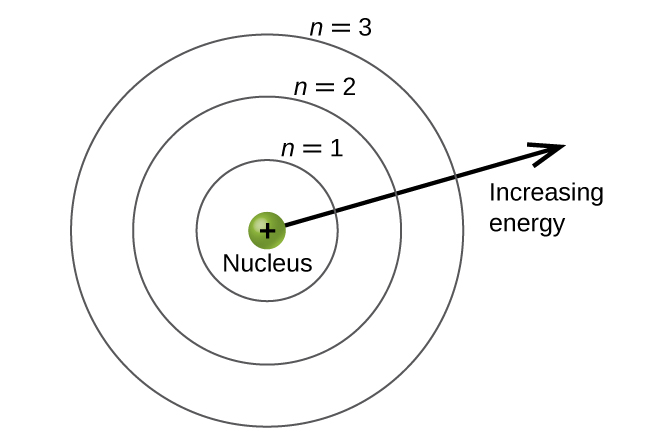
Este modelo mecánico cuántico para donde residen los electrones en un átomo puede ser utilizado para observar las transiciones electrónicas, los eventos cuando un electrón se mueve de un nivel de energía a otro. Si la transición es a un nivel de energía más alto, la energía se absorbe, y el cambio de energía tiene un valor positivo. Para obtener la cantidad de energía necesaria para la transición a un nivel de energía superior, un fotón es absorbido por el átomo. Una transición a un nivel de energía más bajo implica una liberación de energía, y el cambio de energía es negativo. Este proceso va acompañado de la emisión de un fotón por el átomo. La siguiente ecuación resume estas relaciones y se basa en el átomo de hidrógeno:
\[ \begin{align*} ΔE &=E_\ce{final}−E_\ce{initial} \\[4pt] &=−2.18×10^{−18}\left(\dfrac{1}{n^2_\ce f}−\dfrac{1}{n^2_\ce i}\right)\:\ce J \end{align*} \nonumber \]
Los valores n f y n i son los estados de energía final e inicial del electrón.
El número cuántico principal es uno de los tres números cuánticos utilizados para caracterizar un orbital. Un orbital atómico, que es distinto de una órbita, es una región general en un átomo dentro del cual es más probable que resida un electrón. El modelo mecánico cuántico especifica la probabilidad de encontrar un electrón en el espacio tridimensional alrededor del núcleo y se basa en soluciones de la ecuación de Schrödinger. Además, el número cuántico principal define la energía de un electrón en un átomo de hidrógeno o similar al hidrógeno o un ion (un átomo o un ion con un solo electrón) y la región general en la que se localizan los niveles de energía discretos de electrones en átomos e iones multielectrón.
Otro número cuántico es l, el número cuántico de momento angular. Se trata de un entero que define la forma del orbital, y toma los valores, l = 0, 1, 2,..., n — 1. Esto significa que un orbital con n = 1 puede tener solo un valor de l, l = 0, mientras que n = 2 permite l = 0 y l = 1, y así sucesivamente. El número cuántico principal define el tamaño general y la energía de la órbita. El valor l especifica la forma de la órbita. Los orbitales con el mismo valor de l forman un subshell. Además, cuanto mayor es el número cuántico de momento angular, mayor es el momento angular de un electrón en este orbital.
Los orbitales con l = 0 se denominan s orbitales (o las subconchas s). El valor l = 1 corresponde a los orbitales p. Para un n dado, p orbitales constituyen una subcapa p (e.g., 3 p si n = 3). Los orbitales con l = 2 se denominan orbitales d, seguidos de los orbitales f-, g- y h- para l = 3, 4, 5, y hay valores más altos que no consideraremos.
Existen ciertas distancias desde el núcleo en las que la densidad de probabilidad de encontrar un electrón localizado en un orbital particular es cero. En otras palabras, el valor de la función de onda ψ es cero a esta distancia para este orbital. Tal valor de radio r se llama nodo radial. El número de los nudos radiales en la órbita es n — l — 1.
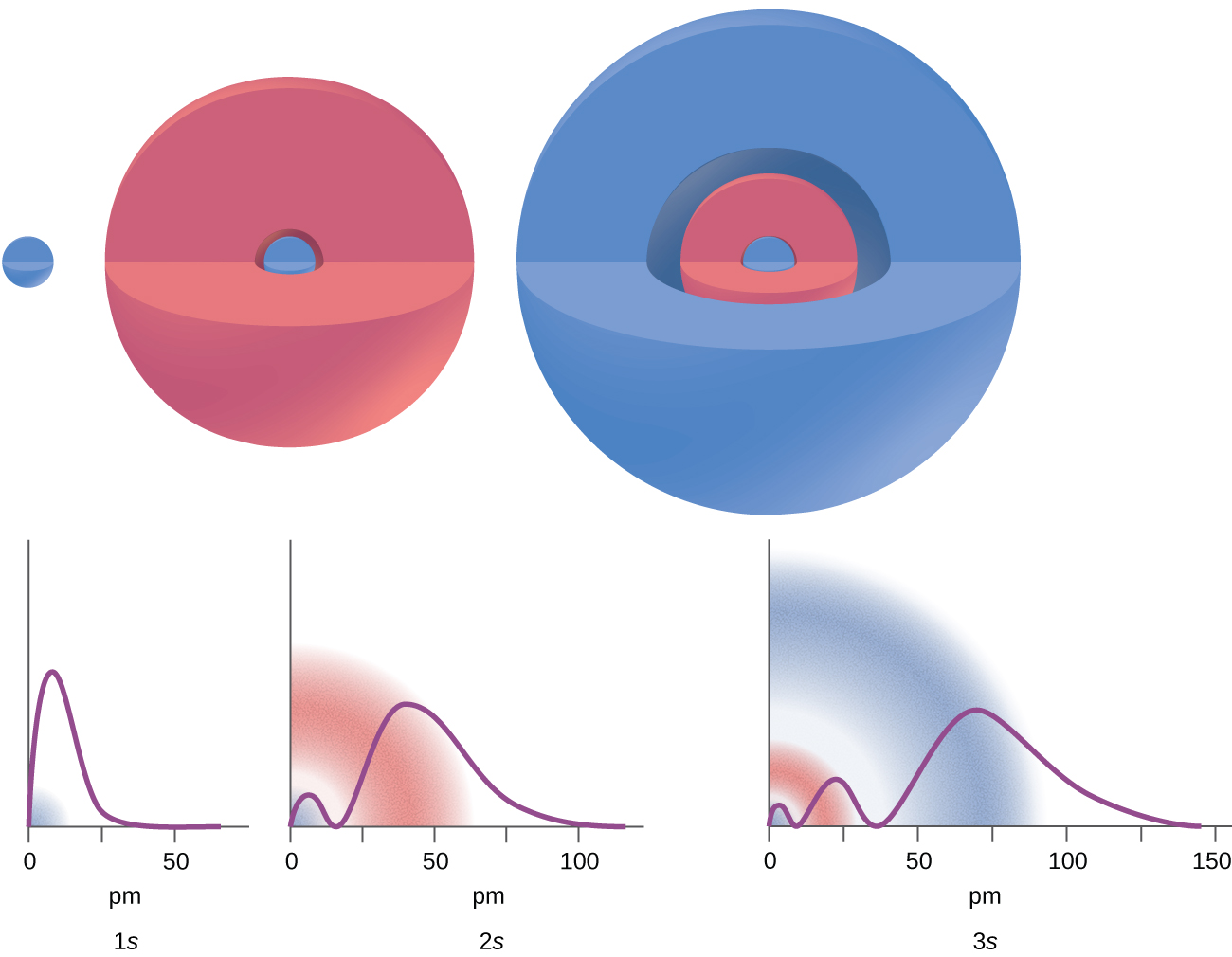
Considera los ejemplos en la Figura\(\PageIndex{7}\). Los orbitales representados son del tipo s, así l = 0 para todos ellos. Se puede observar a partir de las gráficas de las densidades de probabilidad que hay 1 — 0 — 1 = 0 lugares donde la densidad es cero (nodos) para 1 s (n = 1), 2 — 0 — 1 = 1 nodo para 2 s, y 3 — 0 — 1 = 2 nodos para los orbitales de 3 s.
La distribución de densidad electrónica de la subcapa s es esférica y la subcapa p tiene forma de mancuerna. Los orbitales d y f son más complejos. Estas formas representan las regiones tridimensionales dentro de las cuales es probable que se encuentre el electrón.
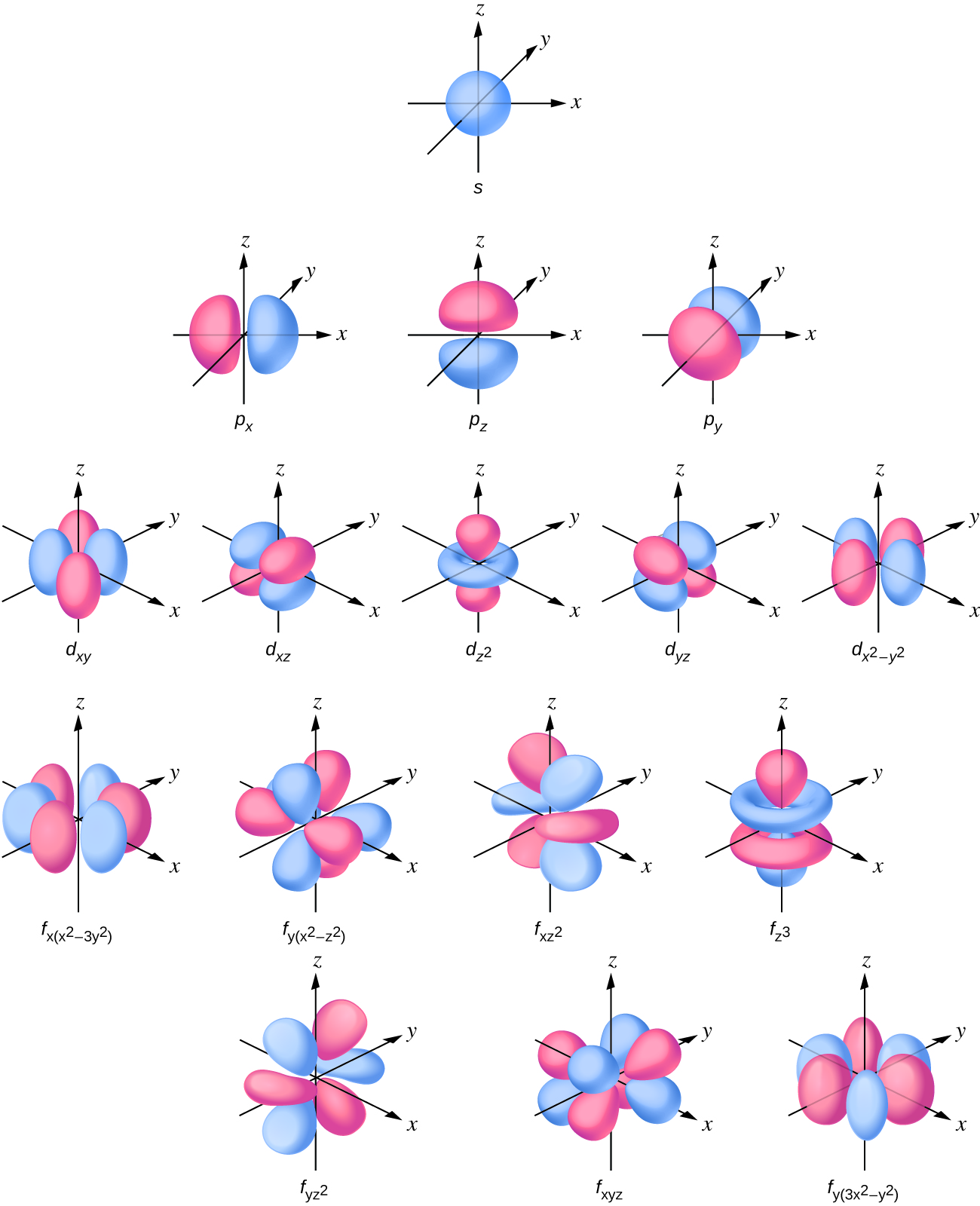
Si un electrón tiene un momento angular (l ≠ 0), entonces este vector puede apuntar en diferentes direcciones. Además, el componente z del momento angular puede tener más de un valor. Esto significa que si se aplica un campo magnético en la dirección z, los orbitales con diferentes valores de la componente z del momento angular tendrán diferentes energías resultantes de interactuar con el campo. El número cuántico magnético, llamado m l, especifica la componente z del momento angular para un orbital particular. Por ejemplo, para un orbital s, l = 0, y el único valor de m l es cero. Para p orbitales, l = 1, y m l puede ser igual a —1, 0 o +1. En términos generales, m l puede ser igual a — l, — (l — 1),..., —1, 0, +1,..., (l — 1), l. El número total de orbitales posibles con el mismo valor de l (un subshell) es de 2 l + 1. Así, hay un s-orbital para ml = 0, hay tres p -orbitales para ml = 1, cinco d-orbitales para ml = 2, siete f-orbitales para ml = 3, y así sucesivamente. El número cuántico principal define el valor general de la energía electrónica. El número cuántico de momento angular determina la forma de la órbita. Y el número cuántico magnético especifica la orientación de la órbita en el espacio, como puede verse en la Figura\(\PageIndex{7}\).
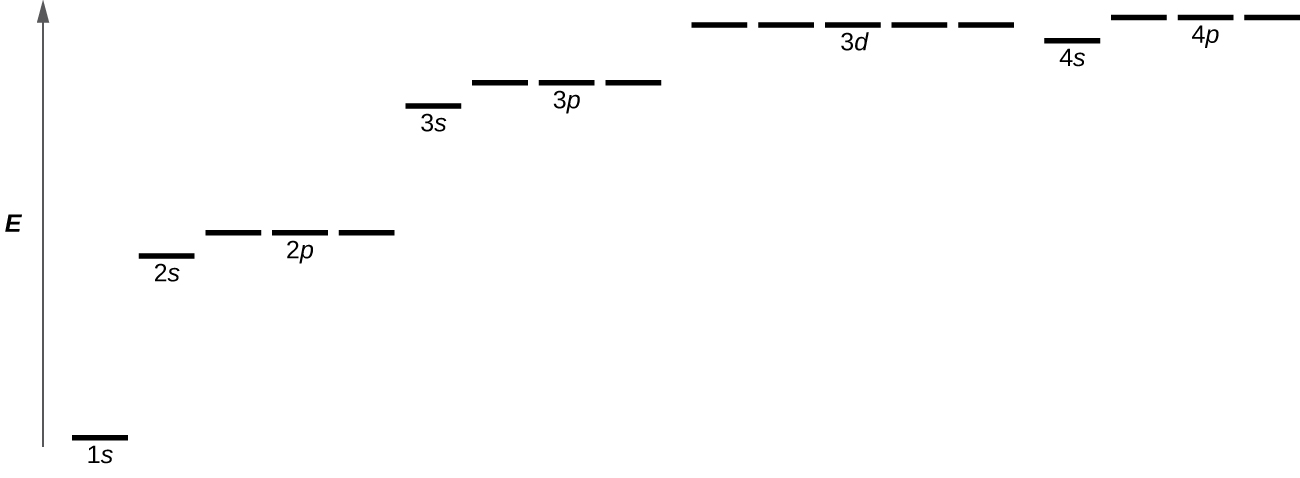
La figura\(\PageIndex{8}\) ilustra los niveles de energía para diversos orbitales. El número antes del nombre orbital (como 2 s, 3 p, y así sucesivamente) representa el número cuántico principal, n. La letra en el nombre orbital define la subcapa con un número cuántico de momento angular específico l = 0 para s orbitales, 1 para p orbitales, 2 para d orbitales. Por último, hay más de un orbitales posibles para l ≥ 1, cada uno correspondiente a un valor específico de m l. En el caso de un átomo de hidrógeno o un ion de un electrón (como He +, Li 2 +, y así sucesivamente), las energías de todos los orbitales con la misma n son las mismas. Esto se llama degeneración, y los niveles de energía para el mismo número cuántico principal, n, se denominan niveles de energía degenerada. Sin embargo, en átomos con más de un electrón, esta degeneración es eliminada por las interacciones electrón-electrón, y los orbitales que pertenecen a diferentes subcapas tienen diferentes energías. Los orbitales dentro de la misma subcapa (por ejemplo ns, np, nd, nf, como 2 p, 3 s) siguen degenerados y tienen la misma energía.
Si bien los tres números cuánticos discutidos en los párrafos anteriores funcionan bien para describir orbitales electrónicos, algunos experimentos mostraron que no fueron suficientes para explicar todos los resultados observados. Se demostró en la década de 1920 que cuando se examinan los espectros de líneas de hidrógeno a una resolución extremadamente alta, algunas líneas en realidad no son picos únicos sino, más bien, pares de líneas muy próximas. Esta es la llamada estructura fina del espectro, e implica que existen pequeñas diferencias adicionales en las energías de los electrones incluso cuando están ubicados en el mismo orbital. Estas observaciones llevaron a Samuel Goudsmit y George Uhlenbeck a proponer que los electrones tienen un cuarto número cuántico. Llamaron a esto el número cuántico de espín, o m s.
Los otros tres números cuánticos, n, l y m l, son propiedades de orbitales atómicos específicos que también definen en qué parte del espacio es más probable que se ubique un electrón. Los orbitales son el resultado de resolver la ecuación de Schrödinger para electrones en átomos. El espín electrónico es un tipo diferente de propiedad. Se trata de un fenómeno completamente cuántico sin análogos en el ámbito clásico. Además, no se puede derivar de la resolución de la ecuación de Schrödinger y no está relacionada con las coordenadas espaciales normales (como las cartesianas x, y y z). El espín electrónico describe una “rotación” o “rotación” intrínseca de electrones. Cada electrón actúa como un pequeño imán o un pequeño objeto giratorio con un momento angular, aunque esta rotación no se pueda observar en términos de las coordenadas espaciales.
La magnitud del espín electrónico global solo puede tener un valor, y un electrón solo puede “girar” en uno de los dos estados cuantificados. Uno se denomina estado α, con el componente z del giro en la dirección positiva del eje z. Esto corresponde al número cuántico de espín\(m_s=\dfrac{1}{2}\). El otro se llama el estado β, siendo el componente z del giro negativo y\(m_s=−\dfrac{1}{2}\). Cualquier electrón, independientemente del orbital atómico en el que se encuentre, solo puede tener uno de esos dos valores del número cuántico de espín. Las energías de los electrones que tienen\(m_s=−\dfrac{1}{2}\) y\(m_s=\dfrac{1}{2}\) son diferentes si se aplica un campo magnético externo.
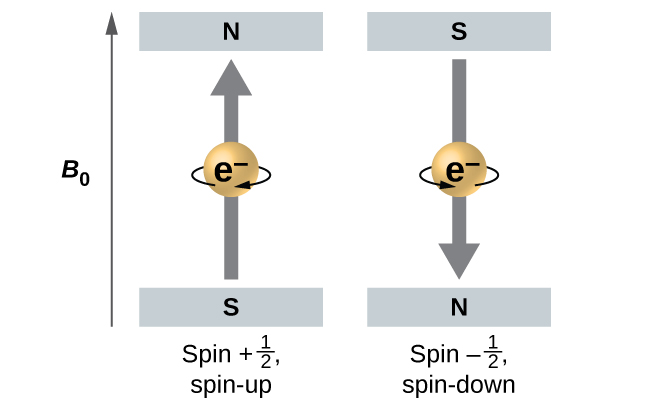
La figura\(\PageIndex{9}\) ilustra este fenómeno. Un electrón actúa como un pequeño imán. Su momento se dirige hacia arriba (en la dirección positiva del eje z) para el número cuántico de\(\dfrac{1}{2}\) giro y hacia abajo (en la dirección z negativa) para el número cuántico de espín de\(−\ce{1/2}\). Un imán tiene una energía menor si su momento magnético está alineado con el campo magnético externo (el electrón izquierdo) y una mayor energía para el momento magnético siendo opuesto al campo aplicado. Es por ello que un electrón con\(m_s=\dfrac{1}{2}\) tiene una energía ligeramente menor en un campo externo en la dirección z positiva, y un electrón con\(m_s=−\dfrac{1}{2}\) tiene una energía ligeramente mayor en el mismo campo. Esto es cierto incluso para un electrón que ocupa el mismo orbital en un átomo. Una línea espectral correspondiente a una transición para electrones del mismo orbital pero con diferentes números cuánticos de espín tiene dos posibles valores de energía; así, la línea en el espectro mostrará una división de estructura fina.
El principio de exclusión de Pauli
Un electrón en un átomo está completamente descrito por cuatro números cuánticos: n, l, m l y m s. Los tres primeros números cuánticos definen el orbital y el cuarto número cuántico describe la propiedad intrínseca del electrón llamada espín. Un físico austriaco Wolfgang Pauli formuló un principio general que da la última pieza de información que necesitamos para entender el comportamiento general de los electrones en los átomos. El principio de exclusión de Pauli puede formularse de la siguiente manera: No hay dos electrones en un mismo átomo que puedan tener exactamente el mismo conjunto de los cuatro números cuánticos. Lo que esto significa es que los electrones pueden compartir el mismo orbital (el mismo conjunto de los números cuánticos n, l y m l), pero sólo si sus números cuánticos de espín m s tienen valores diferentes. Dado que el número cuántico de espín solo puede tener dos valores\(\left(±\dfrac{1}{2}\right)\), no más de dos electrones pueden ocupar el mismo orbital (y si dos electrones están ubicados en el mismo orbital, deben tener espines opuestos). Por lo tanto, cualquier orbital atómico puede ser poblado por solo cero, uno o dos electrones. Las propiedades y el significado de los números cuánticos de electrones en átomos se resumen brevemente en la Tabla\(\PageIndex{1}\).
| Nombre | Símbolo | Valores permitidos | Significado físico |
|---|---|---|---|
| número cuántico principal | n | 1, 2, 3, 4,... | shell, la región general para el valor de la energía para un electrón en la órbita |
| momento angular o número cuántico acimutal | l | 0 ≤ l ≤ n — 1 | subshell, la forma de la órbita |
| número cuántico magnético | m l | — l ≤ m l ≤ l | orientación de la órbita |
| número cuántico de giro | m s | \(\dfrac{1}{2},\:−\dfrac{1}{2}\) | dirección del “giro” cuántico intrínseco del electrón |
Indicar el número de subconchas, el número de orbitales en cada subcaparazón y los valores de l y m l para los orbitales en el caparazón n = 4 de un átomo.
Solución
Para n = 4, l puede tener valores de 0, 1, 2 y 3. Así, las subconchas s, p, d y f se encuentran en el caparazón n = 4 de un átomo. Para l = 0 (el subshell s), m l solo puede ser 0. Así, sólo hay una órbita de 4 s. Para l = 1 (orbitales tipo p), m puede tener valores de —1, 0, +1, por lo que encontramos tres orbitales de 4 p. Para l = 2 (orbitales tipo d), m l puede tener valores de —2, —1, 0, +1, +2, entonces tenemos cinco orbitales de 4 d. Cuando l = 3 (orbitales tipo f), m l puede tener valores de —3, —2, —1, 0, +1, +2, +3, y podemos tener siete orbitales de 4 f. Así, encontramos un total de 16 orbitales en el caparazón n = 4 de un átomo.
Identificar la subcapa en la que se encuentran los electrones con los siguientes números cuánticos:
- n = 3, l = 1;
- n = 5, l = 3;
- n = 2, l = 0.
- Contestar a
-
3 p
- Respuesta b
-
5 f
- Respuesta c
-
2s
Calcular el número máximo de electrones que pueden ocupar un caparazón con (a) n = 2, (b) n = 5, y (c) n como variable. Tenga en cuenta que solo está mirando los orbitales con el valor n especificado, no los de energías más bajas.
Solución
(a) Cuando n = 2, hay cuatro orbitales (un solo orbital de 2 s y tres orbitales etiquetados como 2 p). Estos cuatro orbitales pueden contener ocho electrones.
(b) Cuando n = 5, hay cinco subconchas de orbitales que necesitamos sumar:
&\ phantom {+}\ textrm {1 orbital etiquetado} 5s\\
&\ phantom {+}\ textrm {3 orbitales etiquetados} 5p\\
&\ phantom {+}\ textrm {5 orbitales etiquetados} 5d\\
&\ phantom {+}\ textrm {7 orbitales etiquetados} 5f\
&\ subrayado {+\ textrm m {9 orbitales etiquetados} 5g}\\
&\,\ textrm {25 orbitales totales}
\ end {alinear*}\)
Nuevamente, cada orbital contiene dos electrones, por lo que 50 electrones pueden caber en este caparazón.
c) El número de orbitales en cualquier shell n será igual a n 2. Puede haber hasta dos electrones en cada orbital, por lo que el número máximo de electrones será de 2 × n 2
Si un caparazón contiene un máximo de 32 electrones, ¿cuál es el número cuántico principal, n?
- Contestar
-
n = 4
Complete la siguiente tabla para orbitales atómicos:
| Orbital | n | l | m l degeneración | Nodos radiales (no.) |
|---|---|---|---|---|
| 4 f | ||||
| 4 | 1 | |||
| 7 | 7 | 3 | ||
| 5 d |
Solución
La tabla se puede completar utilizando las siguientes reglas:
- La designación orbital es nl, donde l = 0, 1, 2, 3, 4, 5,... se mapea a la secuencia de letras s, p, d, f, g, h,...,
- La degeneración m l es el número de orbitales dentro de una subcapa l, y así es 2 l + 1 (hay una s orbital, tres orbitales p, cinco orbitales d, siete orbitales f, etc.).
- El número de nodos radiales es igual a n — l — 1.
| Orbital | n | l | m l degeneración | Nodos radiales (no.) |
|---|---|---|---|---|
| 4 f | 4 | 3 | 7 | 0 |
| 4 p | 4 | 1 | 3 | 2 |
| 7 f | 7 | 3 | 7 | 3 |
| 5 d | 5 | 2 | 5 | 2 |
¿Cuántos orbitales tienen l = 2 y n = 3?
- Contestar
-
Los cinco orbitales degenerados de 3 d
Resumen
Los objetos macroscópicos actúan como partículas. Los objetos microscópicos (como los electrones) tienen propiedades tanto de una partícula como de una onda. Sus trayectorias exactas no pueden ser determinadas. El modelo mecánico cuántico de átomos describe la posición tridimensional del electrón de manera probabilística de acuerdo con una función matemática llamada función de onda, a menudo denotada como ψ. Las funciones de onda atómica también se llaman orbitales. La magnitud cuadrada de la función de onda describe la distribución de la probabilidad de encontrar el electrón en una región particular en el espacio. Por lo tanto, los orbitales atómicos describen las áreas en un átomo donde es más probable que se encuentren electrones.
Un orbital atómico se caracteriza por tres números cuánticos. El número cuántico principal, n, puede ser cualquier entero positivo. La región general para el valor de energía de la órbita y la distancia promedio de un electrón desde el núcleo están relacionadas con n. Se dice que los orbitales que tienen el mismo valor de n están en el mismo caparazón. El número cuántico de momento angular, l, puede tener cualquier valor entero de 0 a n — 1. Este número cuántico describe la forma o tipo de la órbita. Los orbitales con el mismo número cuántico principal y el mismo valor l pertenecen a la misma subcapa. El número cuántico magnético, m l, con 2 l + 1 valores que van desde — l a + l, describe la orientación de la órbita en el espacio. Además, cada electrón tiene un número cuántico de espín, m s, que puede ser igual a\(±\dfrac{1}{2}\). No hay dos electrones en un mismo átomo que puedan tener el mismo conjunto de valores para los cuatro números cuánticos.
Glosario
- número cuántico de momento angular (l)
- número cuántico que distingue las diferentes formas de los orbitales; también es una medida del momento angular orbital
- orbital atómico
- función matemática que describe el comportamiento de un electrón en un átomo (también llamada función de onda), se puede utilizar para encontrar la probabilidad de localizar un electrón en una región específica alrededor del núcleo, así como otras variables dinámicas
- d orbital
- región del espacio con alta densidad de electrones que es de cuatro lóbulos o contiene forma de mancuerna y toro; describe orbitales con l = 2. Un electrón en este orbital se llama un electrón d
- densidad de electrones
- una medida de la probabilidad de localizar un electrón en una región particular del espacio, es igual al valor absoluto cuadrado de la función de onda ψ
- f orbital
- región multilobular del espacio con alta densidad de electrones, describe orbitales con l = 3. Un electrón en este orbital se llama un electrón f
- Principio de incertidumbre de Heisenberg
- regla que establece que es imposible determinar exactamente tanto ciertas propiedades dinámicas conjugadas como el momento y la posición de una partícula al mismo tiempo. El principio de incertidumbre es una consecuencia de partículas cuánticas que exhiben dualidad onda-partícula
- número cuántico magnético (m l)
- número cuántico que significa la orientación de un orbital atómico alrededor del núcleo; orbitales que tienen diferentes valores de m l pero el mismo valor de subcapa de l tienen la misma energía (son degenerados), pero esta degeneración se puede eliminar mediante la aplicación de un magnético externo campo
- p orbital
- región del espacio en forma de mancuerna con alta densidad de electrones, describe orbitales con l = 1. Un electrón en este orbital se llama electrón p
- Principio de exclusión de Pauli
- especifica que no hay dos electrones en un átomo pueden tener el mismo valor para los cuatro números cuánticos
- número cuántico principal (n)
- número cuántico que especifica la capa que ocupa un electrón en un átomo
- mecánica cuántica
- campo de estudio que incluye la cuantificación de la energía, la dualidad onda-partícula y el principio de incertidumbre de Heisenberg para describir la materia
- s orbital
- región esférica del espacio con alta densidad de electrones, describe orbitales con l = 0. Un electrón en este orbital se llama un electrón s
- shell
- conjunto de orbitales con el mismo número cuántico principal, n
- número cuántico de giro (m s)
- número que especifica la dirección del espín electrónico, ya\(+\dfrac{1}{2}\) sea\(−\dfrac{1}{2}\)
- subshell
- conjunto de orbitales en un átomo con los mismos valores de n y l
- función de onda (ψ)
- descripción matemática de un orbital atómico que describe la forma del orbital; se puede utilizar para calcular la probabilidad de encontrar el electrón en cualquier ubicación dada en el orbital, así como variables dinámicas como la energía y el momento angular


