Los ionistas salvajes
- Page ID
- 74916
Habilidades para Desarrollar
- Discutir la importancia de los electrolitos y la ósmosis
Faraday demostró que el agua pura no conduce electricidad, pero la conductividad aumenta cuando se agregan algunos tipos de solutos. Estos solutos se llaman electrolitos. Durante mucho tiempo, la gente pensó que los iones que permiten que el agua conduzca la electricidad (para conducir, las partículas cargadas deben moverse, como los electrones a través de un cable metálico o los iones a través de la solución) estaban formados por la electricidad.
Svante Arrhenius era hijo de un empleado universitario menor en Suecia. Para su investigación doctoral, quiso estudiar si los pesos moleculares de los compuestos podían medirse utilizando la conductividad de sus soluciones (un tema en el que su asesor le dijo que no trabajara, a menudo ignoraba los consejos de sus asesores). Para ello, necesitaba entender cómo la conductividad de las soluciones electrolíticas depende de la concentración, pero encontró que sus datos eran inesperadamente confusos. Sabiamente, se dio cuenta de que explicar las conductividades en realidad sería más interesante y útil que su plan original para medir los pesos moleculares. Encontró que los electrolitos cayeron en 2 tipos: fuertes y débiles. Los electrolitos fuertes (como la sal y el HCl) conducen fácilmente la electricidad, y su conductividad es proporcional a la concentración. Los electrolitos débiles (como el vinagre y el amoníaco) conducen la electricidad mucho menos, pero su conductividad no es directamente proporcional a la concentración. A medida que disminuye la concentración, la conductividad también lo hace, pero la conductividad/masa de soluto aumenta. Propuso que los electrolitos tenían un estado activo (que conduce) y un estado inactivo (que no conduce la electricidad); los electrolitos fuertes estaban completamente en estado activo, mientras que los electrolitos débiles tendrían algunas moléculas en el estado activo y algunas en el estado inactivo. A medida que se diluyera una solución de electrolito débil, el% de moléculas en estado activo aumentaría hacia el 100%. Pero esto fue vago, y a sus asesores no les gustó y le dieron una nota muy baja. Debido a que la nota era tan baja, tuvo que viajar e investigar sin sueldo en otros laboratorios durante muchos años para establecerse, en lugar de convertirse él mismo en profesor.

Arrhenius viajó y conoció a otros científicos. Un profesor llamado Ostwald ayudó a presentarlo. Se hizo amigo de Nernst (quien más tarde haría algún trabajo importante sobre termodinámica y electroquímica). Nernst era un joven salvaje que pensaba en convertirse en actor, tenía cicatrices por pelear y muchas veces se emborrachaba mucho. También comenzó a corresponder (escribir cartas) con van 't Hoff, a quien mencionamos anteriormente. Van 't Hoff había pasado de la química del carbono y estaba estudiando ósmosis. La ósmosis ocurre cuando el agua se mueve a través de una membrana (como la membrana de una célula biológica) para pasar de una solución diluida en un lado a una solución concentrada en el otro. Esto puede crear una diferencia de presión. Así es como algunos antibióticos matan a las bacterias: las bacterias explotan por la presión porque la solución fuera de la célula está más diluida que la solución dentro de la célula. Van 't Hoff encontró que la presión osmótica depende de la concentración de las soluciones, pero para los electrolitos, hay un “factor dulce de azúcar” extra; la concentración parece mayor de lo esperado. Parecía que los electrolitos se estaban rompiendo en pedazos, y estas piezas aumentan la concentración aparente de la solución al determinar la presión osmótica. Arrhenius notó que el “factor dulce de azúcar” en los datos de Van 't Hoff estaba relacionado con las fracciones en los estados activos de Arrhenius.
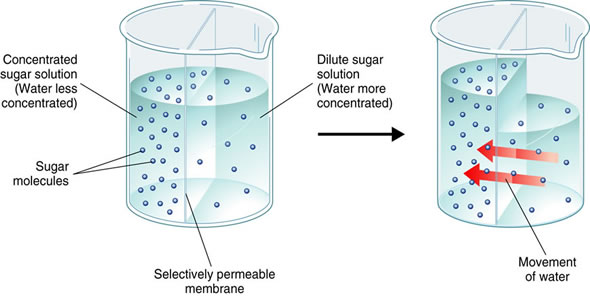
En este momento, los electrones aún no habían sido descubiertos. La gente pensaba que los iones se forman en solución solo cuando pasa la electricidad. Sin embargo, Arrhenius se dio cuenta de que los electrolitos deben dividirse en piezas cargadas (iones) cuando se disuelven, incluso sin electricidad, porque estas piezas cargadas afectaron las mediciones de presión osmótica de van 't Hoff. La idea de que la sal, que se forma tan ansiosamente a partir de los elementos, se separaría completamente en el agua, le pareció una locura a la mayoría de los científicos. (Ahora, sabemos que dividirse en iones vs dividirse en átomos es muy diferente!) Pero Ostwald, Nernst y van 't Hoff coincidieron con Arrhenius, y fueron llamados “el ejército salvaje de los ionistas”. Convencieron bastante rápido a otros químicos de que esta nueva teoría de la ionización era correcta.
Agradecimiento
Esta discusión se inspiró en el primer capítulo del libro Catedrales de la Ciencia de Patrick Coffey.
Enlace exterior
Colaboradores y Atribuciones
Emily V Eames (City College of San Francisco)

