Introducción a los sólidos
- Page ID
- 74803
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para Desarrollar
- Relacionar los diferentes tipos de sólidos con los 3 tipos principales de unión
- Describir algunas de las propiedades de los sólidos
Los sólidos son uno de los temas más interesantes e importantes en la química general porque son importantes para tantas cosas. Utilizamos sólidos como materiales de construcción, para hacer herramientas de todo tipo, para hacer chips de computadora, dispositivos de almacenamiento de energía, células solares, catalizadores... Casi toda la tecnología depende de las propiedades de los sólidos.
Tipos de Sólidos
Podemos categorizar los sólidos de muchas maneras. La forma más común es por el tipo de unión. Hay tres tipos principales de unión. Hasta el momento nos hemos centrado en el enlace covalente. Existen dos tipos de sólidos covalentes: molecular y de red covalente. Los sólidos moleculares están hechos de moléculas covalentes, y los sólidos se mantienen unidos por las fuerzas de Van der Waals entre las moléculas. Estos sólidos moleculares suelen tener bajos puntos de fusión y son fáciles de romper, debido a que las fuerzas entre las moléculas son débiles. Los sólidos de la red covalente son diferentes porque no hay moléculas separadas: todo el sólido se mantiene unido por enlaces covalentes entre átomos. Por ejemplo, en el diamante, cada átomo de C hace 4 enlaces covalentes a otros 4 átomos de C en una disposición tetraédrica. Los sólidos de red covalente suelen tener altos puntos de fusión y son relativamente duros porque se mantienen unidos por enlaces muy fuertes. El diamante es el material más duro conocido, porque los enlaces C-C se encuentran entre los enlaces simples más fuertes conocidos. (¿Podría hacer sólida una red covalente usando los vínculos aún más fuertes?)
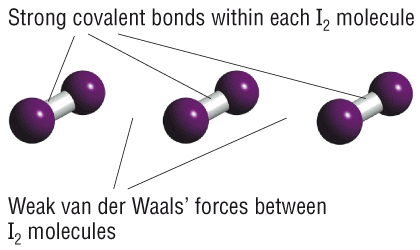

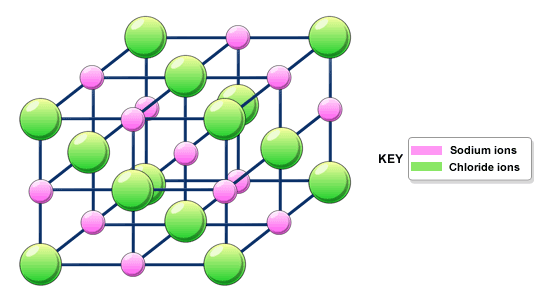
También hemos hablado un poco sobre la unión iónica. Básicamente, probablemente sepas que la mayoría de los materiales iónicos son sólidos a temperatura ambiente, y están hechos de iones, como un catión metálico y un anión no metálico. Los sólidos iónicos se mantienen unidos por fuertes fuerzas electrostáticas (ley de Coulomb) entre los iones, por lo que suelen ser duros y tienen altos puntos de ebullición.
También hay muchos sólidos que están en el límite entre covalente e iónico: están hechos de metales y no metales, pero tanto el enlace covalente como el enlace iónico son importantes. Esto incluye la mayoría de las rocas, minerales y cerámicas. Por ejemplo, el zafiro, otro de los materiales más duros, es el óxido de aluminio.

Por último, hay unión metálica. La unión metálica es una especie de enlace covalente, porque implica compartir electrones. El modelo más simple de unión metálica es el modelo del “mar de electrones”, que imagina que los átomos se asientan en un mar de electrones de valencia que están deslocalizados (dispersos) sobre todos los átomos. Debido a que no hay enlaces específicos entre los átomos individuales, los metales son más flexibles que los sólidos de la red covalente. Los átomos pueden moverse y el mar de electrones los mantendrá unidos. Algunos metales son muy duros y tienen puntos de fusión muy altos, mientras que otros son blandos y tienen puntos de fusión bajos. Esto depende aproximadamente del número de electrones de valencia que forman el mar.
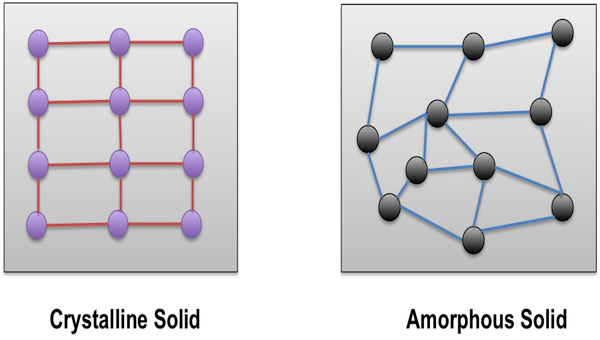
En realidad también hay algunos otros tipos de sólidos. Una forma en la que podemos separar los sólidos en categorías es cristalino o amorfo. Los sólidos cristalinos tienen disposiciones ordenadas de átomos o iones. Los sólidos amorfos (que significa “sin forma”) tienen arreglos desorganizados. Los metales, los sólidos iónicos, la red covalente y los sólidos moleculares suelen ser al menos cristalinos y ordenados, aunque nunca son completamente perfectos. Los sólidos cristalinos suelen tener caras o facetas (superficies planas en ángulos particulares), como la mayoría de las piedras preciosas utilizadas para hacer joyas. Un tipo importante de materiales amorfos son los polímeros, que incluyen la mayoría de los plásticos. Los polímeros suelen estar hechos de moléculas covalentes muy largas y flacas que se enredan entre sí. A menudo son flexibles. También hay piedras amorfas, como el ópalo (que suele ser pulido a una forma redondeada, porque no hace facetas bonitas).
También podemos clasificar los sólidos por su tamaño. Los nanomateriales son sólidos que tienen tamaños muy pequeños. Los nanomateriales pueden estar hechos de materiales metálicos o de red covalente, pero debido a su pequeño tamaño, tienen diferentes propiedades.
Propiedades de los Sólidos
Al leer sobre los sólidos, piense en cómo la estructura se relaciona con las importantes propiedades de los sólidos que determinan cómo podemos usarlo. Aquí describiremos algunas de estas propiedades.
Para los materiales estructurales (materiales que utilizamos para construir, soportar, proteger) la resistencia y dureza pueden ser muy importantes. Dureza significa lo fácil que es cambiar la forma del material, como por ejemplo por estrangularlo o abollarlo, o qué tan elástico es en una colisión. La resistencia de los materiales significa qué tan bien resisten las fuerzas aplicadas, como la compresión o el estiramiento. Esto es importante si quieres construir un puente o un edificio, por ejemplo. Describiremos los sólidos como quebradizos si se rompen en pedazos, como sólidos iónicos o covalentes. Los metales no suelen romperse en pedazos, pero pueden estirarse en alambres (ductilidad) y ser machacados en láminas (maleabilidad).
La conductividad es otro tipo importante de propiedad. ¿Los materiales conducen la electricidad? Si es así, ¿cuánto? ¿Conducen sonido o calor, y qué tan bien? También podríamos querer saber sobre la reactividad de los sólidos. ¿Son inertes (no reactivos) a alta temperatura en ácido? ¿Catalizan (aceleran) ciertas reacciones en sus superficies? ¿Absorben o emiten luz y, de ser así, a qué energía? ¿Son magnéticos? ¿Son porosos (llenos de pequeños agujeros)? Todas estas propiedades pueden ser importantes para diferentes aplicaciones.
Valencia y Sólidos
Al leer sobre sólidos, puede ser útil recordar las ideas sobre valencia que hemos discutido anteriormente. Los diferentes átomos tienen diferentes números de electrones de valencia, lo que determina cuántos electrones suelen perder o ganar, y cuántos enlaces suelen hacer. Otra forma de pensar sobre esto es con el número de coordinación, que es con cuántos otros átomos interactúa un átomo. En las moléculas, los números de coordinación suelen ser bastante bajos, como 1-4. En los sólidos iónicos, cada ion podría tener 2-8 vecinos. En los metales, cada átomo podría tener 12 vecinos. El número de coordinación estable de un átomo o ion depende de la situación, y de cuántos electrones necesita. Para formar un sólido de red covalente, al menos algunos de los átomos en la fórmula tienen que hacer muchos enlaces (como el carbono o el silicio, que generalmente hace 4 enlaces). No se puede hacer una buena red con solo átomos que forman 2 enlaces, porque no se pueden tener ramas. En sólidos moleculares, todos los enlaces están dentro de la molécula. En los metales, para ganar los electrones que quieren, porque empiezan con menos electrones de valencia, suelen tener números de coordinación altos, lo que requiere que tengan ciertas estructuras.
Defectos
Un tema muy importante en los sólidos son los defectos o lugares donde la disposición de los átomos no es perfecta. Todos los ejemplos de una molécula en particular son exactamente iguales, porque si uno de los átomos es diferente o el arreglo es diferente, sería una molécula diferente. Pero los sólidos pueden ser principalmente una fórmula y estructura, con algunas impurezas o lugares donde la estructura no es exactamente ordenada. De hecho, los sólidos siempre tienen defectos. Muchas de las propiedades más importantes de los sólidos dependen de los defectos, como tener algunos átomos de diferentes tipos, o falta un átomo, etc. Así que recuerda que a veces la descripción masiva (cómo es la mayor parte del sólido) no es en realidad la parte más importante. La parte más importante podría ser el raro lugar donde algunos átomos no están en su lugar. ¡Esto puede hacer que los sólidos sean muy confusos de estudiar!
Enlaces externos
Colaboradores y Atribuciones
Emily V Eames (City College of San Francisco)

