20.5: Estabilidad Termodinámica de Núcleos
- Page ID
- 72736
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
- Comprender los factores que afectan la estabilidad nuclear.
Aunque la mayoría de los elementos conocidos tienen al menos un isótopo cuyo núcleo atómico es estable indefinidamente, todos los elementos tienen isótopos que son inestables y se desintegran, o se desintegran, a tasas medibles al emitir radiación. Algunos elementos no tienen isótopos estables y eventualmente se descomponen en otros elementos. En contraste con las reacciones químicas que fueron el foco principal de capítulos anteriores y se deben a cambios en las disposiciones de los electrones de valencia de los átomos, el proceso de desintegración nuclear da como resultado cambios dentro de un núcleo atómico. Comenzamos nuestra discusión sobre las reacciones nucleares revisando las convenciones utilizadas para describir los componentes del núcleo.
El Núcleo Atómico
Cada elemento puede ser representado por la notación\(^A_Z \textrm X\), donde A, el número de masa, es la suma del número de protones y el número de neutrones, y Z, el número atómico, es el número de protones. Los protones y neutrones que componen el núcleo de un átomo se denominan nucleones, y un átomo con un número particular de protones y neutrones se llama nucleido. Los nucleidos con el mismo número de protones pero diferentes números de neutrones se denominan isótopos. Los isótopos también pueden ser representados por una notación alternativa que utiliza el nombre del elemento seguido del número de masa, como el carbono-12. Los isótopos estables de oxígeno, por ejemplo, se pueden representar de cualquiera de las siguientes maneras:
| \(^A_Z \textrm X\) | \(\ce{^{16}_8 O}\) | \(\ce{^{17}_8 O}\) | \(\ce{^{18}_8 O}\) |
|---|---|---|---|
| \ (^A_Z\ textrm X\)” style="text-align:center; ">\(^A \textrm X\) | \ (\ ce {^ {16} _8 O}\)” style="text-align:center; ">\(\ce{^{16} O}\) | \ (\ ce {^ {17} _8 O}\)” style="text-align:center; ">\(\ce{^{17} O}\) | \ (\ ce {^ {18} _8 O}\)” style="text-align:center; ">\(\ce{^{18} O}\) |
| \ (^A_Z\ textrm X\)” style="text-align:center; ">\(\textrm{element-A:}\) | \ (\ ce {^ {16} _8 O}\)” style="text-align:center; ">\(\textrm{oxygen-16}\) | \ (\ ce {^ {17} _8 O}\)” style="text-align:center; ">\(\textrm{oxygen-17}\) | \ (\ ce {^ {18} _8 O}\)” style="text-align:center; ">\(\textrm{oxygen-18}\) |
Debido a que el número de neutrones es igual a A − Z, vemos que el primer isótopo de oxígeno tiene 8 neutrones, el segundo isótopo 9 neutrones y el tercer isótopo 10 neutrones. Los isótopos de todos los elementos naturales en la Tierra están presentes en proporciones casi fijas, constituyendo cada proporción la abundancia natural de un isótopo. Por ejemplo, en una muestra terrestre típica de oxígeno, 99.76% de los átomos de O es oxígeno-16, 0.20% es oxígeno-18 y 0.04% es oxígeno-17. Cualquier núcleo que sea inestable y decae espontáneamente se dice que es radiactivo, emitiendo partículas subatómicas y radiación electromagnética. Las emisiones se denominan colectivamente radiactividad y se pueden medir. Los isótopos que emiten radiación se denominan radioisótopos.
Estabilidad Nuclear
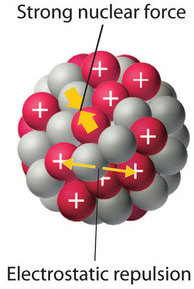
El núcleo de un átomo ocupa una pequeña fracción del volumen de un átomo y contiene el número de protones y neutrones que es característico de un isótopo dado. Las repulsiones electrostáticas normalmente harían que los protones cargados positivamente se repelan entre sí, pero el núcleo no se separa por la fuerte fuerza nuclear, una fuerza de atracción extremadamente poderosa pero de muy corto alcance entre los nucleones (Figura\(\PageIndex{1}\)). Todos los núcleos estables excepto el núcleo de hidrógeno-1 (1 H) contienen al menos un neutrón para superar la repulsión electrostática entre protones. A medida que aumenta el número de protones en el núcleo, el número de neutrones necesarios para un núcleo estable aumenta aún más rápidamente. Demasiados protones (o muy pocos neutrones) en el núcleo dan como resultado un desequilibrio entre las fuerzas, lo que conduce a la inestabilidad nuclear.
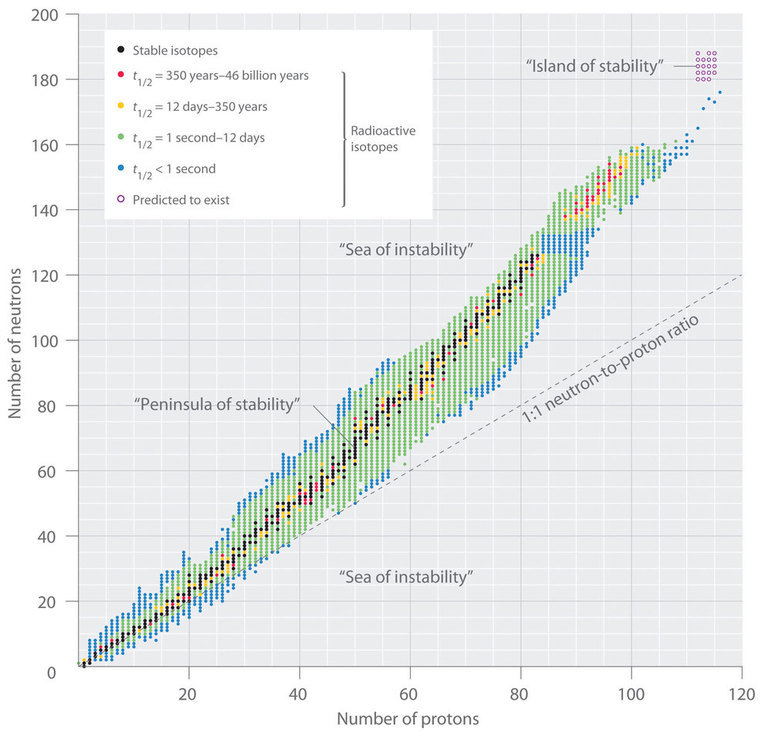
La relación entre el número de protones y el número de neutrones en núcleos estables, definidos arbitrariamente como tener una vida media superior a 10 veces la edad de la Tierra, se muestra gráficamente en la Figura\(\PageIndex{2}\). Los isótopos estables forman una “península de estabilidad” en un “mar de inestabilidad”. Sólo dos isótopos estables, 1 H y 3 He, tienen una relación neutrón-protón menor a 1. Varios isótopos estables de átomos de luz tienen una relación neutrón-protón igual a 1 (por ejemplo,\(^4_2 \textrm{He}\),\(^{10}_5 \textrm{B}\), y\(^{40}_{20} \textrm{Ca}\)). Todos los demás núcleos estables tienen una mayor relación neutrón-protón, lo que aumenta constantemente a aproximadamente 1.5 para los núcleos más pesados. Sin embargo, independientemente del número de neutrones, todos los elementos con Z > 83 son inestables y radiactivos.
Como se muestra en la Figura\(\PageIndex{3}\), más de la mitad de los núcleos estables (166 de 279) tienen números pares tanto de neutrones como de protones; solo 6 de los 279 núcleos estables no tienen números impares de ambos. Además, ciertos números de neutrones o protones dan como resultado núcleos especialmente estables; estos son los llamados números mágicos 2, 8, 20, 50, 82 y 126. Por ejemplo, el estaño (Z = 50) tiene 10 isótopos estables, pero los elementos a cada lado del estaño en la tabla periódica, indio (Z = 49) y antimonio (Z = 51), tienen solo 2 isótopos estables cada uno. Se dice que los núcleos con números mágicos tanto de protones como de neutrones son “doblemente mágicos” y son aún más estables. Ejemplos de elementos con núcleos doblemente mágicos son\(^4_2 \textrm{He}\), con 2 protones y 2 neutrones, y\(^{208}_{82} \textrm{Pb}\), con 82 protones y 126 neutrones, que es el isótopo estable más pesado conocido de cualquier elemento.
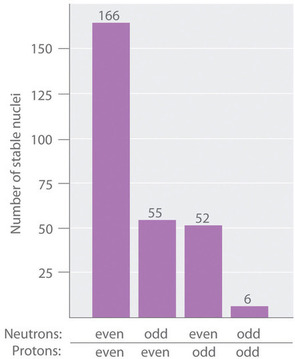
La mayoría de los núcleos estables contienen números pares de neutrones y protones
El patrón de estabilidad sugerido por los números mágicos de nucleones recuerda a la estabilidad asociada con las configuraciones de electrones de concha cerrada de los gases nobles en el grupo 18 y ha llevado a la hipótesis de que el núcleo contiene conchas de nucleones que son de alguna manera análogas a las conchas ocupado por electrones en un átomo. Como se muestra en la Figura\(\PageIndex{2}\), la “península” de isótopos estables está rodeada por un “arrecife” de isótopos radiactivos, los cuales son lo suficientemente estables como para existir durante diferentes períodos de tiempo antes de que finalmente se desintegren para producir otros núcleos.
Se han formulado múltiples modelos para explicar el origen de los números mágicos y dos populares son el Nuclear Shell Model y el Liquid Drop Model. Desgraciadamente, ambos requieren una mecánica cuántica avanzada para comprender completamente y están más allá del alcance de este texto.
Clasificar cada nucleido como estable o radiactivo.
- \(\ce{_{15}^{30} P}\)
- \(\ce{_{43}^{98} Tc}\)
- estaño-118
- \(\ce{_{94}^{239} Pu}\)
Dado: número de masa y número atómico
Preguntado por: estabilidad nuclear pronosticada
Estrategia:
Utilizar el número de protones, la relación neutrón-protón y la presencia de números pares o impares de neutrones y protones para predecir la estabilidad o radiactividad de cada nucleido.
Solución:
a. Este isótopo de fósforo tiene 15 neutrones y 15 protones, dando una relación neutrón-protón de 1.0. Si bien el número atómico, 15, es mucho menor que el valor de 83 por encima del cual todos los nucleidos son inestables, la relación neutrón-protón es menor que la esperada para la estabilidad de un elemento con esta masa. Como se muestra en la Figura\(\PageIndex{2}\), su relación neutrón-protón debe ser mayor a 1. Además, este isótopo tiene un número impar tanto de neutrones como de protones, lo que también tiende a hacer que un nucleido sea inestable. En consecuencia,\(_{15}^{30} \textrm P\) se predice que sea radiactivo, y lo es.
b. Este isótopo del tecnecio tiene 55 neutrones y 43 protones, dando una relación neutrón-protón de 1.28, que se sitúa\(_{43}^{98} \textrm{Tc}\) cerca del borde de la banda de estabilidad. El número atómico, 55, es mucho menor que el valor de 83 por encima del cual todos los isótopos son inestables. Estos hechos sugieren que\(_{43}^{98} \textrm{Tc}\) podría ser estable. Sin embargo,\(_{43}^{98} \textrm{Tc}\) tiene un número impar tanto de neutrones como de protones, combinación que rara vez da un núcleo estable. En consecuencia,\(_{43}^{98} \textrm{Tc}\) se predice que sea radiactivo, y lo es.
c. El Tin-118 tiene 68 neutrones y 50 protones, para una relación neutrón-protón de 1.36. Al igual que en la parte b, este valor y el número atómico sugieren estabilidad. Además, el isótopo tiene un número par tanto de neutrones como de protones, lo que tiende a aumentar la estabilidad nuclear. Lo más importante es que el núcleo tiene 50 protones, y 50 es uno de los números mágicos asociados con núcleos especialmente estables. Por lo tanto,\(_{50}^{118} \textrm{Sn}\) debe ser particularmente estable.
d. Este nucleido tiene un número atómico de 94. Debido a que todos los núcleos con Z > 83 son inestables,\(_{94}^{239} \textrm{Pu}\) deben ser radiactivos.
Clasificar cada nucleido como estable o radiactivo.
- \(\ce{_{90}^{232} Th}\)
- \(\ce{_{20}^{40} Ca}\)
- \(\ce{_8^{15} O}\)
- \(\ce{_{57}^{139} La}\)
- Contestar a
-
radiactivo
- Respuesta b
-
estable
- Respuesta c
-
radiactivo
- Respuesta d
-
estable
Elementos Superpesados
Además de la “península de estabilidad” hay una pequeña “isla de estabilidad” que se prevé que exista en la esquina superior derecha. Esta isla corresponde a los elementos superpesados, con números atómicos cercanos al número mágico 126. Debido a que el siguiente número mágico para neutrones debería ser 184, se sugirió que un elemento con 114 protones y 184 neutrones podría ser lo suficientemente estable como para existir en la naturaleza. Si bien estas afirmaciones fueron atendidas con escepticismo durante muchos años, desde 1999 se han preparado algunos átomos de isótopos con Z = 114 y Z = 116 y se ha encontrado que son sorprendentemente estables. Un isótopo del elemento 114 dura 2.7 segundos antes de descomponerse, descrito como una “eternidad” por los químicos nucleares. Además, hay evidencia reciente de la existencia de un núcleo con A = 292 que se encontró en 232 Th. Con una vida media estimada superior a 10 8 años, el isótopo es particularmente estable. Su masa medida es consistente con predicciones para la masa de un isótopo con Z = 122. Por lo tanto, una serie de núcleos de vida relativamente larga pueden ser accesibles entre los elementos superpesados.
Resumen
Las partículas subatómicas del núcleo (protones y neutrones) se llaman nucleones. Un nucleido es un átomo con un número particular de protones y neutrones. Un núcleo inestable que decae espontáneamente es radiactivo, y sus emisiones se denominan colectivamente radiactividad. Los isótopos que emiten radiación se denominan radioisótopos. Cada nucleón es atraído hacia otros nucleones por la fuerte fuerza nuclear. Los núcleos estables generalmente tienen números pares de protones y neutrones y una relación neutrón-protón de al menos 1. Los núcleos que contienen números mágicos de protones y neutrones suelen ser especialmente estables. Los elementos superpesados, con números atómicos cercanos a 126, pueden incluso ser lo suficientemente estables como para existir en la naturaleza.

