5.1: Una visión general de los estados físicos de la materia
- Page ID
- 78660
- Describir las características de un gas.
Las tres fases (o estados) comunes de la materia son gases, líquidos y sólidos. Los gases tienen la densidad más baja de los tres, son altamente compresibles y llenan completamente cualquier recipiente en el que se coloquen. Los gases se comportan de esta manera porque sus fuerzas intermoleculares son relativamente débiles, por lo que sus moléculas se mueven constantemente independientemente de las otras moléculas presentes. Los sólidos, por el contrario, son relativamente densos, rígidos e incompresibles porque sus fuerzas intermoleculares son tan fuertes que las moléculas están esencialmente bloqueadas en su lugar. Los líquidos son relativamente densos e incompresibles, como los sólidos, pero fluyen fácilmente para adaptarse a la forma de sus contenedores, como los gases. Por lo tanto, podemos concluir que la suma de las fuerzas intermoleculares en los líquidos se encuentra entre las de los gases y los sólidos. La figura\(\PageIndex{1}\) compara los tres estados de la materia e ilustra las diferencias a nivel molecular.
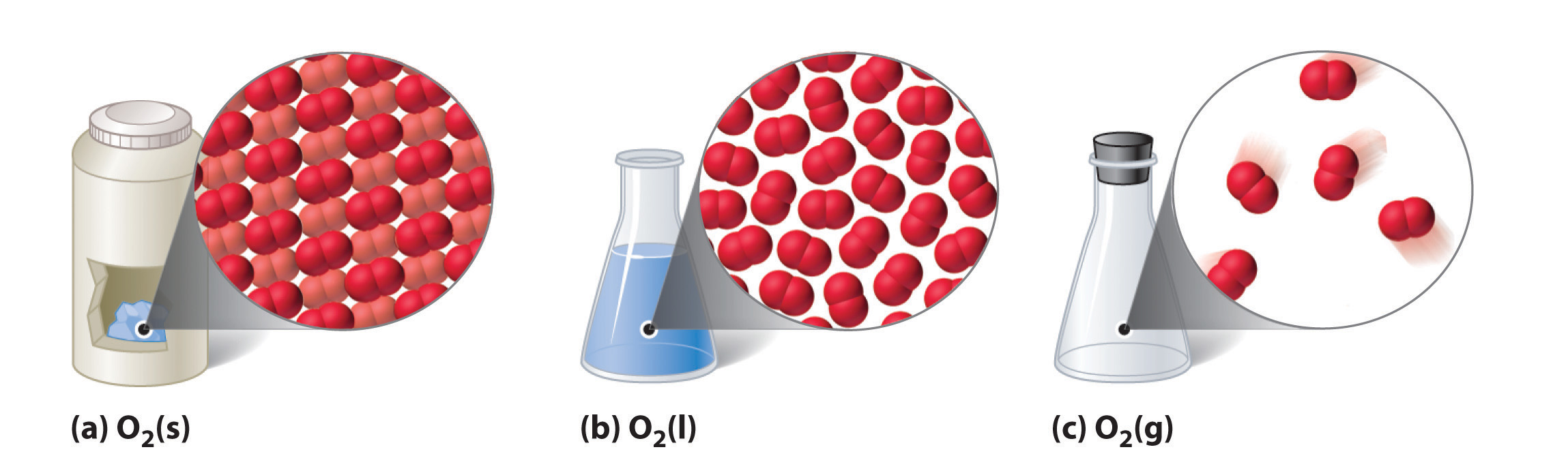
El estado de una sustancia determinada depende fuertemente de las condiciones. Por ejemplo, H 2 O se encuentra comúnmente en los tres estados: hielo sólido, agua líquida y vapor de agua (su forma gaseosa). En la mayoría de las condiciones, nos encontramos con el agua como el líquido que es esencial para la vida; la bebemos, cocinamos con ella y nos bañamos en ella. Cuando la temperatura es lo suficientemente fría como para transformar el líquido en hielo, podemos esquiar o patinar sobre él, empacarlo en una bola de nieve o cono de nieve, e incluso construir viviendas con él. El vapor de agua (el término vapor se refiere a la forma gaseosa de una sustancia que es un líquido o un sólido en condiciones normales por lo que el nitrógeno (N 2) y el oxígeno (O 2) se denominan gases, pero el agua gaseosa en la atmósfera se llama vapor de agua) es un componente del aire que respiramos, y se produce cada vez que calentamos agua para cocinar alimentos o hacer café o té. El vapor de agua a temperaturas superiores a 100°C se llama vapor. El vapor se utiliza para conducir maquinaria grande, incluyendo turbinas que generan electricidad. Las propiedades de los tres estados del agua se resumen en el Cuadro 10.1.
| Temperatura | Estado | Densidad (g/cm3) |
|---|---|---|
| ≤0° C | sólido (hielo) | 0.9167 (a 0.0°C) |
| 0°C—100°C | líquido (agua) | 0.9997 (a 4.0°C) |
| ≥100°C | vapor (vapor) | 0.005476 (a 127°C) |
La estructura geométrica y las propiedades físicas y químicas de los átomos, iones y moléculas generalmente no dependen de su estado físico; las moléculas de agua individuales en el hielo, el agua líquida y el vapor, por ejemplo, son todas idénticas. En contraste, las propiedades macroscópicas de una sustancia dependen fuertemente de su estado físico, el cual está determinado por fuerzas y condiciones intermoleculares como temperatura y presión.
La figura\(\PageIndex{2}\) muestra las ubicaciones en la tabla periódica de aquellos elementos que se encuentran comúnmente en los estados gaseoso, líquido y sólido. A excepción del hidrógeno, los elementos que ocurren de forma natural como gases se encuentran en el lado derecho de la tabla periódica. De estos, todos los gases nobles (grupo 18) son gases monoatómicos, mientras que los demás elementos gaseosos son moléculas diatómicas (H 2, N 2, O 2, F 2 y Cl 2). El oxígeno también puede formar un segundo alótropo, la molécula triatómica altamente reactiva ozono (O 3), que también es un gas. Por el contrario, el bromo (como Br 2) y el mercurio (Hg) son líquidos en condiciones normales (25°C y 1.0 atm, comúnmente denominados “temperatura y presión ambiente”). El galio (Ga), que se funde a tan solo 29.76°C, se puede convertir en un líquido simplemente sosteniendo un recipiente en la mano o manteniéndolo en una habitación sin aire acondicionado en un caluroso día de verano. El resto de los elementos son todos sólidos en condiciones normales.
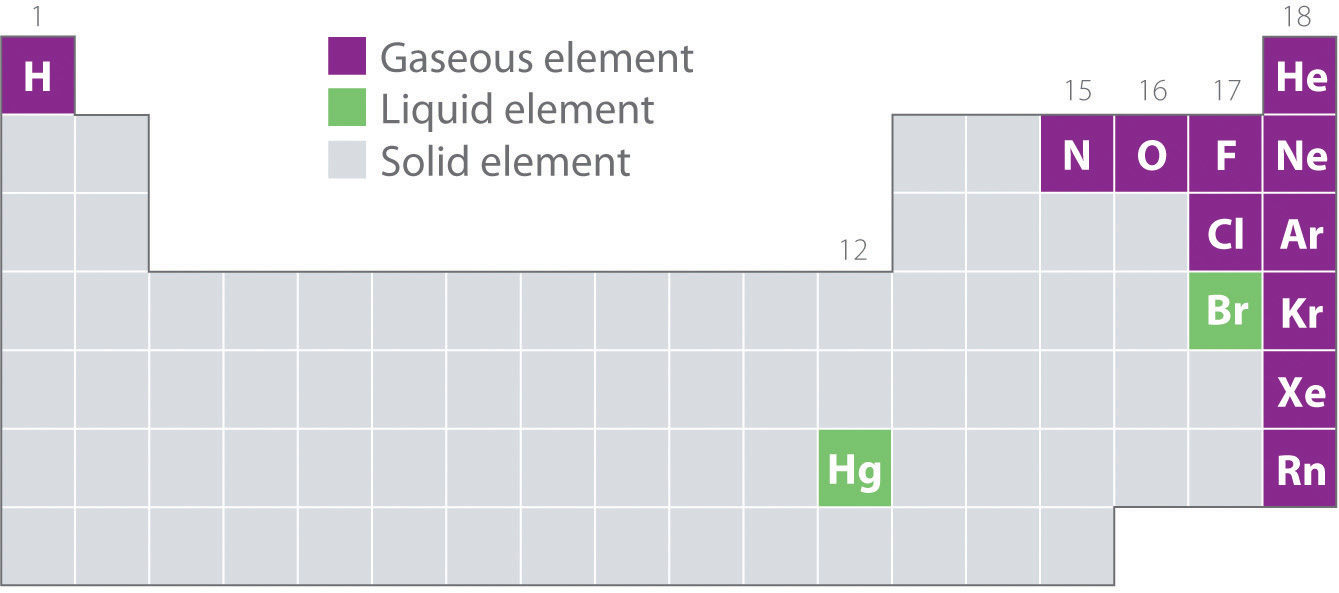
Todos los elementos gaseosos (distintos de los gases nobles monatómicos) son moléculas. Cuando en el mismo grupo (1, 15, 16 y 17), los elementos más ligeros son los gases. Todas las sustancias gaseosas se caracterizan por interacciones débiles entre las moléculas o átomos constituyentes.
Resumen
La materia a granel puede existir en tres estados: gas, líquido y sólido. Los gases tienen la densidad más baja de los tres, son altamente compresibles y llenan completamente sus contenedores. Los elementos que existen como gases a temperatura y presión ambiente se agrupan en el lado derecho de la tabla periódica; ocurren como gases monoatómicos (los gases nobles) o moléculas diatómicas (algunos halógenos, N 2, O 2).

