5.2: Presión de gas y su medición
- Page ID
- 78672
- para describir y medir la presión de un gas.
A nivel macroscópico, una descripción física completa de una muestra de un gas requiere cuatro cantidades:
- temperatura (expresada en kelvins),
- volumen (expresado en litros),
- cantidad (expresada en moles), y
- presión (en atmósferas).
Como demostramos a continuación, estas variables no son independientes (es decir, no pueden variarse arbitrariamente). Si conocemos los valores de cualquiera de estas tres cantidades, podemos calcular la cuarta y así obtener una descripción física completa del gas. La temperatura, el volumen y la cantidad han sido discutidos en capítulos anteriores. Ahora discutimos la presión y sus unidades de medida.
Unidades de Presión
Cualquier objeto, ya sea su computadora, una persona, o una muestra de gas, ejerce una fuerza sobre cualquier superficie con la que entre en contacto. El aire en un globo, por ejemplo, ejerce una fuerza contra la superficie interior del globo, y un líquido inyectado en un molde ejerce una fuerza contra la superficie interior del molde, así como una silla ejerce una fuerza contra el suelo debido a su masa y los efectos de la gravedad. Si el aire en un globo se calienta, el aumento de la energía cinética del gas eventualmente hace que el globo explote debido al aumento de la presión (\(P\)) del gas, la fuerza (\(F\)) por unidad de área (\(A\)) de superficie:
\[P=\dfrac{\rm Force}{\rm Area}=\dfrac{F}{A}\label{10.2.1} \]
La presión depende tanto de la fuerza ejercida como del tamaño del área a la que se aplica la fuerza. Sabemos por Ecuación\(\ref{10.2.1}\) que aplicar la misma fuerza a un área más pequeña produce una mayor presión. Cuando usamos una manguera para lavar un auto, por ejemplo, podemos aumentar la presión del agua reduciendo el tamaño de la abertura de la manguera con un pulgar.
Las unidades de presión se derivan de las unidades utilizadas para medir la fuerza y el área. La unidad SI para presión, derivada de las unidades SI para fuerza (newtons) y área (metros cuadrados), es el newton por metro cuadrado (\(N/m^2\)), que se llama Pascal (Pa), después del matemático francés Blaise Pascal (1623—1662):
\[\rm 1 \;Pa=1\;N/m^2 \label{10.2.2} \]
Suponiendo que un libro de bolsillo tiene una masa de 2.00 kg, una longitud de 27.0 cm, un ancho de 21.0 cm y un grosor de 4.5 cm, qué presión ejerce sobre una superficie si es
- tumbado?
- de pie sobre el borde en una estantería?
Dado: masa y dimensiones del objeto
Preguntado por: presión
Estrategia:
- Calcular la fuerza ejercida por el libro y luego computar el área que está en contacto con una superficie.
- Sustituya estos dos valores en Ecuación\(\ref{10.2.1}\) para encontrar la presión ejercida sobre la superficie en cada orientación.
Solución:
La fuerza ejercida por el libro no depende de su orientación. Recordemos que la fuerza ejercida por un objeto es F = ma, donde m es su masa y a es su aceleración. En el campo gravitacional de la Tierra, la aceleración se debe a la gravedad (9.8067 m/s 2 en la superficie de la Tierra). En las unidades SI, la fuerza ejercida por el libro es por lo tanto
\[F = ma = 2.00 \;\rm kg\times 9.8067 \dfrac{\rm m}{\rm s^2} = 19.6 \dfrac{\rm kg·m}{\rm s^2} = 19.6\;\rm N \nonumber \]
A Calculamos la fuerza como 19.6 N. Cuando el libro está tumbado plano, el área es
\[A=\rm0.270 \;m\times0.210 \;m= 0.0567 \;m^2. \nonumber \]
B La presión ejercida por el texto tumbado es así
\[P=\dfrac{F}{A}=\dfrac{19.6\;\rm N}{0.0567\;\rm m^2}=3.46\times10^2 \rm Pa \nonumber \]
A Si el libro está de pie sobre su extremo, la fuerza sigue siendo la misma, pero el área disminuye:
\[\rm A=\rm21.0 \;cm\times4.5 \;cm = 0.210 \;m\times0.045 \;m = 9.5 \times 10^{−3} \;\rm m^2 \nonumber \]
B La presión ejercida por el texto tumbado es así
\[P=\dfrac{19.6\;\rm N}{9.5\times10^{-3}\;\rm m^2}=2.06\times10^3 \;\rm Pa \nonumber \]
¿Qué presión ejerce un estudiante de 60.0 kg en el piso?
- al estar de pie plano en el laboratorio en un par de zapatillas de tenis (la superficie de las suelas es de aproximadamente 180 cm 2)?
- mientras pisa el talón primero en una pista de baile con zapatos de tacón alto (la zona del talón = 1.0 cm 2)?
- Contestar a
-
3.27 × 10 4 Pa
- Respuesta b
-
5.9 × 10 6 Pa
Presión Barométrica
Así como ejercemos presión sobre una superficie debido a la gravedad, también lo hace nuestra atmósfera. Vivimos en el fondo de un océano de gases que se vuelve progresivamente menos denso con el aumento de la altitud. Aproximadamente el 99% de la masa de la atmósfera se encuentra a 30 km de la superficie de la Tierra (Figura\(\PageIndex{1}\)). Cada punto de la superficie de la Tierra experimenta una presión neta llamada presión barométrica. La presión ejercida por la atmósfera es considerable: una columna de 1 m 2, medida desde el nivel del mar hasta la cima de la atmósfera, tiene una masa de aproximadamente 10,000 kg, lo que da una presión de aproximadamente 101 kPa:

La presión barométrica se puede medir utilizando un barómetro, un dispositivo inventado en 1643 por uno de los estudiantes de Galileo, Evangelista Torricelli (1608—1647). Se puede construir un barómetro a partir de un tubo de vidrio largo que está cerrado en un extremo. Se llena de mercurio y se coloca boca abajo en un plato de mercurio sin permitir que entre aire en el tubo. Parte del mercurio se quedará sin el tubo, pero una columna relativamente alta permanece en su interior (Figura\(\PageIndex{2}\)). ¿Por qué no se acaba todo el mercurio? La gravedad ciertamente está ejerciendo una fuerza descendente sobre el mercurio en el tubo, pero se opone a la presión de la atmósfera que empuja hacia abajo sobre la superficie del mercurio en el plato, lo que tiene el efecto neto de empujar el mercurio hacia arriba en el tubo. Debido a que no hay aire por encima del mercurio dentro del tubo en un barómetro debidamente llenado (contiene vacío), no hay presión empujando hacia abajo sobre la columna. Así, el mercurio sale del tubo hasta que la presión ejercida por la propia columna de mercurio equilibra exactamente la presión de la atmósfera. La presión ejercida por la columna de mercurio se puede expresar como:
\[\begin{align} P&=\dfrac{F}{A} \\[4pt] &= \dfrac{mg}{A} \\[4pt] &= \dfrac{\rho V\cdot g}{A} \\[4pt] &= \dfrac{ \rho \cdot Ah\cdot g}{A} \\[4pt] &= \rho gh \end{align} \nonumber \]
con
- \(g\)es la aceleración gravitacional,
- \(m\)es la masa,
- \(\rho\)es la densidad,
- \(V\)es el volumen,
- \(A\)es el área inferior, y
- \(h\)es la altura de la columna de mercurio.
En condiciones climáticas normales a nivel del mar, las dos fuerzas se equilibran cuando la parte superior de la columna de mercurio se encuentra aproximadamente 760 mm por encima del nivel del mercurio en el plato, como se muestra en la Figura\(\PageIndex{2}\). Este valor varía con las condiciones meteorológicas y la altitud. En Denver, Colorado, por ejemplo, a una altura de aproximadamente 1 milla, o 1609 m (5280 pies), la altura de la columna de mercurio es de 630 mm en lugar de 760 mm.
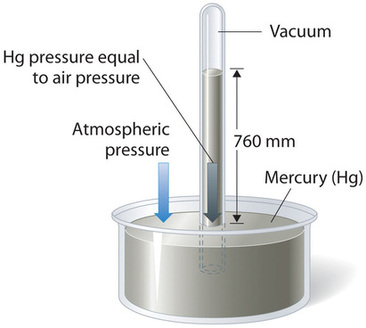
Los barómetros de mercurio se han utilizado para medir la presión barométrica durante tanto tiempo que tienen su propia unidad de presión: el milímetro de mercurio (mmHg), a menudo llamado torr, después de Torricelli. La presión barométrica estándar es la presión barométrica requerida para soportar una columna de mercurio exactamente 760 mm de altura; esta presión también se conoce como 1 atmósfera (atm). Estas unidades también están relacionadas con el pascal:
\[\begin{align} \rm 1\; atm &= 760 \; mmHg \\[4pt] &= 760 \; torr \\[4pt] &= 1.01325 \times 10^5 \; Pa \\[4pt] &= 101.325 \; kPa\label{10.2.3} \end{align} \]
Por lo tanto, una presión de 1 atm equivale exactamente a 760 mmHg.
Estamos tan acostumbrados a vivir bajo esta presión que nunca lo notamos. En cambio, lo que notamos son cambios en la presión, como cuando nuestras orejas aparecen en elevadores rápidos en rascacielos o en aviones durante rápidos cambios de altitud. Hacemos uso de la presión barométrica de muchas maneras. Podemos usar una pajita para beber porque al succionarla se elimina el aire y con ello se reduce la presión dentro de la pajita. La presión barométrica que empuja hacia abajo sobre el líquido en el vaso entonces obliga al líquido a subir por la pajita.
Uno de los autores visitó el Parque Nacional de las Montañas Rocosas hace varios años. Después de salir de un aeropuerto a nivel del mar en el este de Estados Unidos, llegó a Denver (altitud 5280 pies), rentó un automóvil y condujo hasta lo alto de la carretera fuera de Estes Park (elevación 14,000 pies). Se percató que incluso un ligero esfuerzo fue muy difícil a esta altitud, donde la presión barométrica es de sólo 454 mmHg. Convertir esta presión en
- atmósferas (atm).
- barra.
Dado: presión en milímetros de mercurio
Preguntado por: presión en atmósferas y bar
Estrategia:
Utilice los factores de conversión en Ecuación\(\ref{10.2.3}\) para convertir de milímetros de mercurio a atmósferas y kilopascales.
Solución:
De la Ecuación\(\ref{10.2.3}\), tenemos 1 atm = 760 mmHg = 101.325 kPa. La presión a 14,000 pies en atm es así
\[ \begin{align} P &=\rm 454 \;mmHg\times\dfrac{1\;atm}{760\;mmHg} \\[4pt] &= 0.597\;atm \nonumber \end{align} \nonumber \]
\[ \begin{align} P&=\rm 0.597\;atm\times\dfrac{1.01325\;bar}{1\;atm}\\[4pt] &= 0.605\;bar \nonumber \end{align} \nonumber \]
Mt. Everest, a 29,028 pies sobre el nivel del mar, es la montaña más alta del mundo. La presión barométrica normal a esta altitud es de aproximadamente 0.308 atm. Convertir esta presión en
- milímetros de mercurio.
- barra.
- Contestar a
-
234 mmHg;
- Respuesta b
-
0.312 bar
Manómetros
Los barómetros miden la presión barométrica, pero los manómetros miden las presiones de muestras de gases contenidos en un aparato. La característica clave de un manómetro es un tubo en forma de U que contiene mercurio (u ocasionalmente otro líquido no volátil). Un manómetro de extremo cerrado se muestra esquemáticamente en la parte (a) de la Figura\(\PageIndex{3}\). Cuando la bombilla no contiene gas (es decir, cuando su interior es un vacío cercano), las alturas de las dos columnas de mercurio son las mismas porque el espacio sobre el mercurio de la izquierda es un vacío cercano (contiene solo trazas de vapor de mercurio). Si se libera un gas en la bombilla de la derecha, ejercerá una presión sobre el mercurio en la columna derecha, y las dos columnas de mercurio ya no tendrán la misma altura. La diferencia entre las alturas de las dos columnas es igual a la presión del gas.
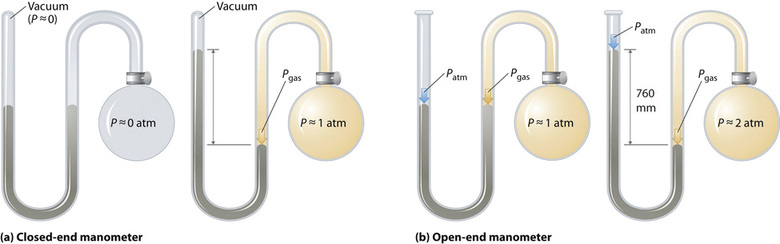
Si el tubo está abierto a la atmósfera en lugar de cerrado, como en el manómetro de extremo abierto mostrado en la parte (b) en la Figura\(\PageIndex{3}\), entonces las dos columnas de mercurio tienen la misma altura solo si el gas en la bombilla tiene una presión igual a la presión barométrica. Si el gas en la bombilla tiene una presión más alta, el mercurio en el tubo abierto será forzado hacia arriba por el gas que empuja hacia abajo sobre el mercurio en el otro brazo del tubo en forma de U. La presión del gas en el bulbo es por lo tanto la suma de la presión barométrica (medida con un barómetro) y la diferencia en las alturas de las dos columnas. Si el gas en la bombilla tiene una presión menor que la de la atmósfera, entonces la altura del mercurio será mayor en el brazo unido a la bombilla. En este caso, la presión del gas en la bombilla es la presión barométrica menos la diferencia en las alturas de las dos columnas.
Supongamos que desea construir un manómetro de extremo cerrado para medir presiones de gas en el rango de 0.000—0.200 atm. Debido a la toxicidad del mercurio, decides usar agua en lugar de mercurio. ¿Qué altura necesita una columna de agua? (La densidad del agua es 1.00 g/cm 3; la densidad del mercurio es 13.53 g/cm 3.)
Dado: rango de presión y densidades de agua y mercurio
Preguntado por: altura de columna
Estrategia:
- Calcular la altura de una columna de mercurio correspondiente a 0.200 atm en milímetros de mercurio. Esta es la altura necesaria para una columna llena de mercurio.
- A partir de las densidades dadas, utilice una proporción para calcular la altura necesaria para una columna llena de agua.
Solución:
A En milímetros de mercurio, una presión de gas de 0.200 atm es
\[P=\rm 0.200\;atm\times\dfrac{760\;mmHg}{1\;atm}=152\;mmHg \nonumber \]
Usando un manómetro de mercurio, necesitarías una columna de mercurio de al menos 152 mm de altura.
B Debido a que el agua es menos densa que el mercurio, se necesita una columna de agua más alta para lograr la misma presión que una columna dada de mercurio. La altura necesaria para una columna llena de agua correspondiente a una presión de 0.200 atm es proporcional a la relación de la densidad de mercurio a la densidad del agua
\[P=d_{\rm wat}gh_{\rm wat}=d_{\rm Hg}gh_{\rm Hg} \nonumber \]
\[h_{\rm wat}=h_{\rm Hg}\times\dfrac{d_{\rm Hg}}{g_{\rm wat}}=\rm152\;mm\times\dfrac{13.53\;g/cm^3}{1.00\;g/cm^3}=2070\;mm \nonumber \]
La respuesta tiene sentido: se necesita una columna más alta de un líquido menos denso para lograr la misma presión.
Supongamos que desea diseñar un barómetro para medir la presión barométrica en un ambiente que esté siempre más caliente que 30°C.Para evitar el uso de mercurio, decide usar galio, que se funde a 29.76°C; la densidad del galio líquido a 25°C es de 6.114 g/cm 3. ¿Qué altura necesita una columna de galio si P = 1.00 atm?
- Contestar
-
1.68 m
La respuesta a Ejemplo\(\PageIndex{3}\) también nos dice la profundidad máxima del pozo de un agricultor si se utilizará una simple bomba de succión para sacar el agua. El 1.00 atm corresponde a una altura de columna de
Una bomba de succión es solo una versión más sofisticada de una pajita: crea un vacío por encima de un líquido y depende de la presión barométrica para forzar al líquido a subir por un tubo. Si la presión de 1 atm corresponde a una columna de agua de 10.3 m (33.8 pies), entonces es físicamente imposible que la presión barométrica eleve el agua en un pozo por encima de esta. Hasta que se inventaron las bombas eléctricas para empujar el agua mecánicamente desde mayores profundidades, este factor limitó en gran medida el lugar donde las personas podían vivir porque obtener agua de pozos más profundos de aproximadamente 33 pies era difícil.
Resumen
La presión se define como la fuerza ejercida por unidad de área; se puede medir usando un barómetro o manómetro. Se deben conocer cuatro cantidades para una descripción física completa de una muestra de un gas: temperatura, volumen, cantidad y presión. La presión es fuerza por unidad de área de superficie; la unidad SI para presión es el pascal (Pa), definido como 1 newton por metro cuadrado (N/m 2). La presión ejercida por un objeto es proporcional a la fuerza que ejerce e inversamente proporcional al área sobre la que se ejerce la fuerza. La presión ejercida por la atmósfera terrestre, llamada presión barométrica, es de aproximadamente 101 kPa o 14.7 lb/in. 2 al nivel del mar. la presión barométrica se puede medir con un barómetro, un tubo cerrado, invertido lleno de mercurio. La altura de la columna de mercurio es proporcional a la presión barométrica, la cual a menudo se reporta en unidades de milímetros de mercurio (mmHg), también llamada torr. La presión barométrica estándar, la presión requerida para soportar una columna de mercurio de 760 mm de altura, es otra unidad de presión: 1 atmósfera (atm). Un manómetro es un aparato utilizado para medir la presión de una muestra de un gas.

