5.3: Las leyes del gas y sus fundamentos experimentales
- Page ID
- 78651
- Comprender las relaciones entre la presión, la temperatura, el volumen y la cantidad de un gas.
Los primeros científicos exploraron las relaciones entre la presión de un gas (P) y su temperatura (T), volumen (V) y cantidad (n) manteniendo constantes dos de las cuatro variables (cantidad y temperatura, por ejemplo), variando un tercio (como la presión), y medir el efecto del cambio en el cuarto (en este caso, volumen). La historia de sus descubrimientos proporciona varios ejemplos excelentes del método científico.
La relación entre presión y volumen: la ley de Boyle
A medida que aumenta la presión sobre un gas, el volumen del gas disminuye debido a que las partículas de gas son forzadas a acercarse entre sí. Por el contrario, a medida que disminuye la presión sobre un gas, el volumen de gas aumenta porque las partículas de gas ahora pueden separarse más. Los globos meteorológicos se hacen más grandes a medida que ascienden a través de la atmósfera a regiones de menor presión debido a que el volumen del gas ha aumentado; es decir, el gas atmosférico ejerce menos presión sobre la superficie del globo, por lo que el gas interior se expande hasta que las presiones interna y externa son iguales.
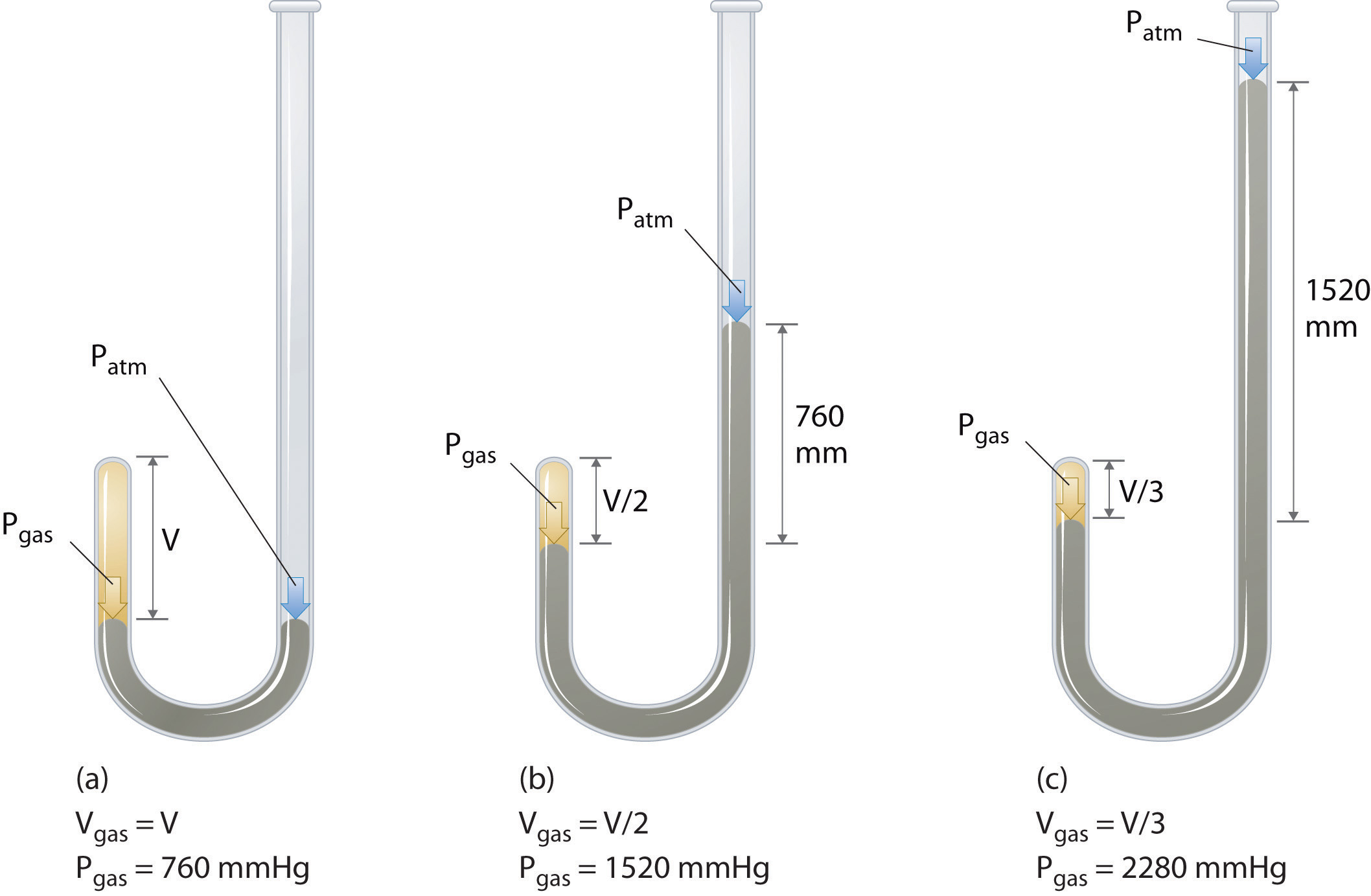
El químico irlandés Robert Boyle (1627—1691) realizó algunos de los primeros experimentos que determinaron la relación cuantitativa entre la presión y el volumen de un gas. Boyle utilizó un tubo en forma de J parcialmente lleno de mercurio, como se muestra en la Figura\(\PageIndex{1}\). En estos experimentos, una pequeña cantidad de un gas o aire queda atrapada por encima de la columna de mercurio, y su volumen se mide a presión atmosférica y temperatura constante. Luego se vierte más mercurio en el brazo abierto para aumentar la presión sobre la muestra de gas. La presión sobre el gas es la presión atmosférica más la diferencia en las alturas de las columnas de mercurio, y se mide el volumen resultante. Este proceso se repite hasta que o bien no hay más espacio en el brazo abierto o el volumen del gas es demasiado pequeño para ser medido con precisión. Datos como los de uno de los propios experimentos de Boyle se pueden trazar de varias maneras (Figura\(\PageIndex{2}\)). Una gráfica simple de\(V\) versus\(P\) da una curva llamada hipérbola y revela una relación inversa entre presión y volumen: a medida que la presión se duplica, el volumen disminuye en un factor de dos. Esta relación entre las dos cantidades se describe de la siguiente manera:
\[PV = \rm constant \label{10.3.1} \]
Dividir ambos lados por\(P\) da una ecuación que ilustra la relación inversa entre\(P\) y\(V\):
\[V=\dfrac{\rm const.}{P} = {\rm const.}\left(\dfrac{1}{P}\right) \label{10.3.2} \]
o
\[V \propto \dfrac{1}{P} \label{10.3.3} \]
donde se lee el símbolo “es proporcional a”. Una gráfica de V versus 1/ P es así una línea recta cuya pendiente es igual a la constante en Ecuaciones\(\ref{10.3.1}\) y\(\ref{10.3.3}\). Dividir ambos lados de la Ecuación\(\ref{10.3.1}\) por V en lugar de P da una relación similar entre P y 1/ V. El valor numérico de la constante depende de la cantidad de gas utilizado en el experimento y de la temperatura a la que se llevan a cabo los experimentos. Esta relación entre presión y volumen se conoce como ley de Boyle, después de su descubridor, y se puede afirmar de la siguiente manera: A temperatura constante, el volumen de una cantidad fija de un gas es inversamente proporcional a su presión. Esta ley en la práctica se muestra en la Figura\(\PageIndex{2}\).
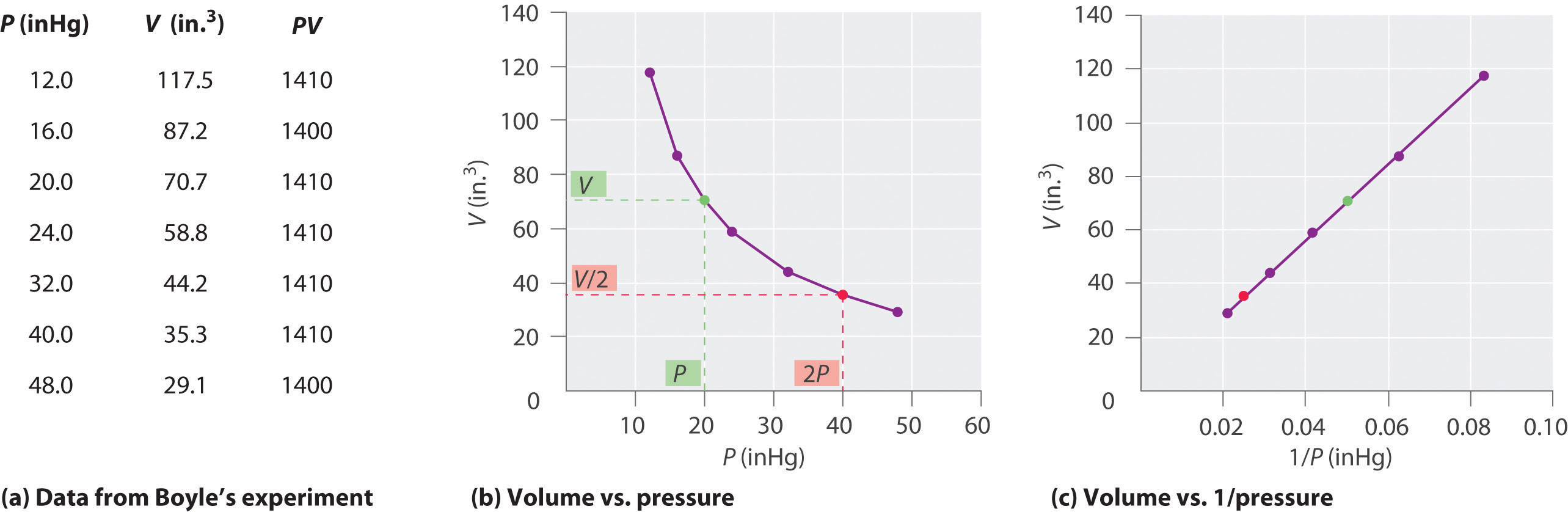
A temperatura constante, el volumen de una cantidad fija de un gas es inversamente proporcional a su presión
La relación entre temperatura y volumen: la ley de Carlos
El aire caliente sube, razón por la cual los globos aerostáticos ascienden por la atmósfera y por qué el aire caliente se acumula cerca del techo y el aire más frío se acumula a nivel del suelo. Debido a este comportamiento, los registros de calefacción se colocan en o cerca del piso, y las rejillas de ventilación para el aire acondicionado se colocan en o cerca del techo. La razón fundamental de este comportamiento es que los gases se expanden cuando se calientan. Debido a que la misma cantidad de sustancia ahora ocupa un mayor volumen, el aire caliente es menos denso que el aire frío. La sustancia con menor densidad, en este caso aire caliente, se eleva a través de la sustancia con mayor densidad, el aire más frío.
Los primeros experimentos para cuantificar la relación entre la temperatura y el volumen de un gas fueron realizados en 1783 por un ávido globo, el químico francés Jacques Alexandre César Charles (1746—1823). Los experimentos iniciales de Charles mostraron que una gráfica del volumen de una muestra dada de gas versus temperatura (en grados Celsius) a presión constante es una línea recta. Estudios similares pero más precisos fueron realizados por otro entusiasta del globo, el francés Joseph-Louis Gay-Lussac (1778—1850), quien demostró que una trama de V versus T era una línea recta que podía extrapolarse a un punto a volumen cero, condición teórica que ahora se sabe que corresponde a −273.15°C (Figura \(\PageIndex{3}\)) .Una muestra de gas no puede tener realmente un volumen de cero porque cualquier muestra de materia debe tener algún volumen. Además, a una presión de 1 atm todos los gases se licuan a temperaturas muy superiores a -273.15°C.\(\PageIndex{3}\) Obsérvese de la parte (a) en la Figura que la pendiente de la gráfica de V versus T varía para el mismo gas a diferentes presiones pero que la intercepción permanece constante a -273.15°C. De igual manera, como se muestra en la parte (b) en la Figura \(\PageIndex{3}\), las gráficas de V versus T para diferentes cantidades de gases variados son líneas rectas con diferentes pendientes pero la misma intercepción en el eje T.
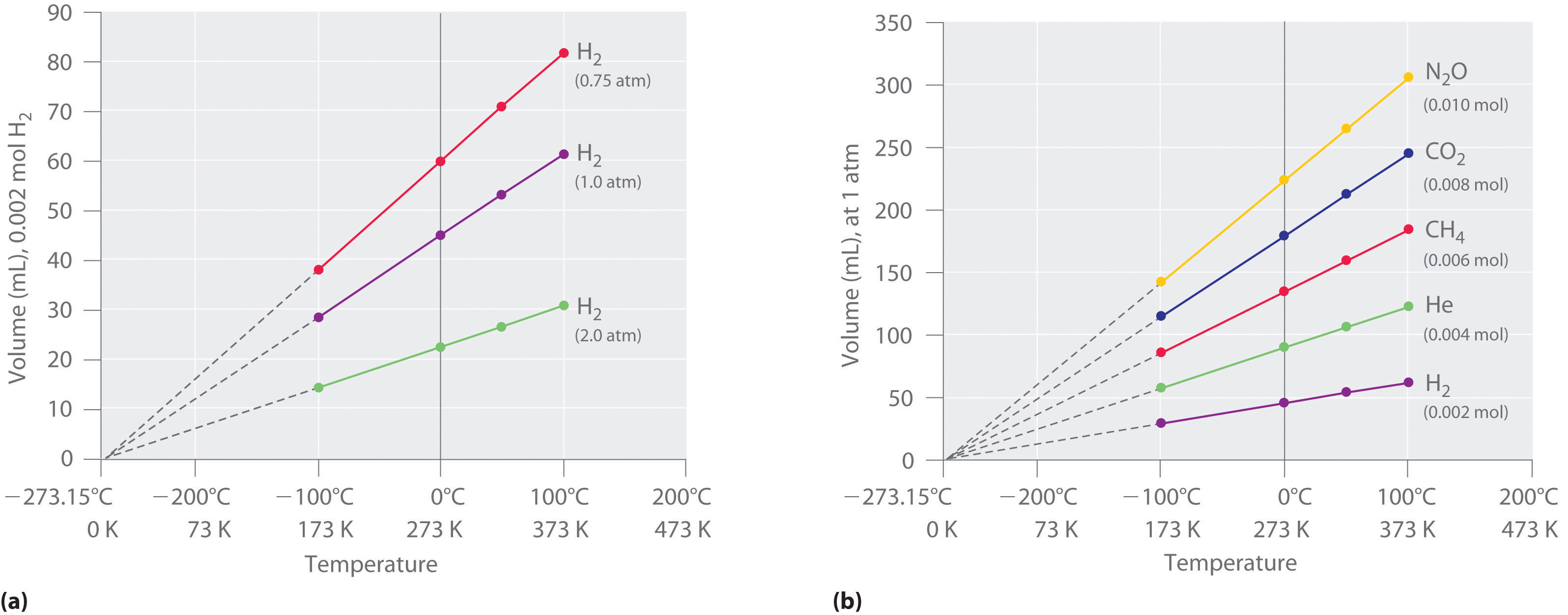
La importancia de la intercepción T invariante en tramas de V versus T fue reconocida en 1848 por el físico británico William Thomson (1824-1907), posteriormente llamado Lord Kelvin. Postuló que −273.15°C era la temperatura más baja posible que teóricamente se podía lograr, para lo cual acuñó el término cero absoluto (0 K).
Podemos exponer los hallazgos de Charles y Gay-Lussac en términos simples: A presión constante, el volumen de una cantidad fija de gas es directamente proporcional a su temperatura absoluta (en kelvin). Esta relación, ilustrada en la parte (b) en la Figura, a menudo\(\PageIndex{3}\) se conoce como la ley de Carlos y se afirma matemáticamente como
\[V ={\rm const.}\; T \label{10.3.4} \]
o
\[V \propto T \label{10.3.5} \]
con temperatura expresada en kelvins, no en grados Celsius. La ley de Charles es válida para prácticamente todos los gases a temperaturas muy superiores a sus puntos de ebullición.
La relación entre cantidad y volumen: Ley de Avogadro
Podemos demostrar la relación entre el volumen y la cantidad de un gas llenando un globo; a medida que agregamos más gas, el globo se hace más grande. La relación cuantitativa específica fue descubierta por el químico italiano Amedeo Avogadro, quien reconoció la importancia del trabajo de Gay-Lussac en la combinación de volúmenes de gases. En 1811, Avogadro postuló que, a la misma temperatura y presión, volúmenes iguales de gases contienen el mismo número de partículas gaseosas (Figura\(\PageIndex{4}\)). Esta es la histórica “hipótesis de Avogadro”.
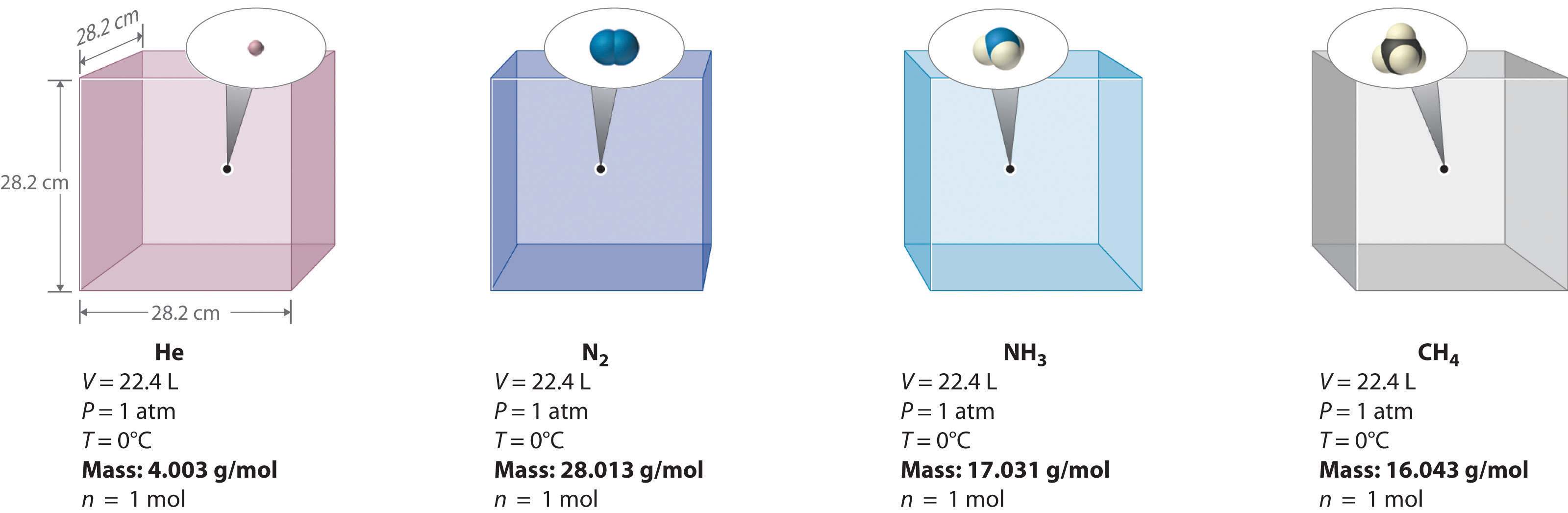
Un corolario lógico de la hipótesis de Avogadro (a veces llamada ley de Avogadro) describe la relación entre el volumen y la cantidad de un gas: A temperatura y presión constantes, el volumen de una muestra de gas es directamente proporcional al número de moles de gas en la muestra. Declarado matemáticamente,
\[V ={\rm const.} \; (n) \label{10.3.6} \]
o
\[V \propto.n \text{@ constant T and P} \label{10.3.7} \]
Esta relación es válida para la mayoría de los gases a presiones relativamente bajas, pero se observan desviaciones de linealidad estricta a presiones elevadas.
Para una muestra de gas,
- V aumenta a medida que P disminuye (y viceversa)
- V aumenta a medida que T aumenta (y viceversa)
- V aumenta a medida que n aumenta (y viceversa)
Las relaciones entre el volumen de un gas y su presión, temperatura y cantidad se resumen en la Figura\(\PageIndex{5}\). El volumen aumenta al aumentar la temperatura o cantidad, pero disminuye con el aumento de la presión.
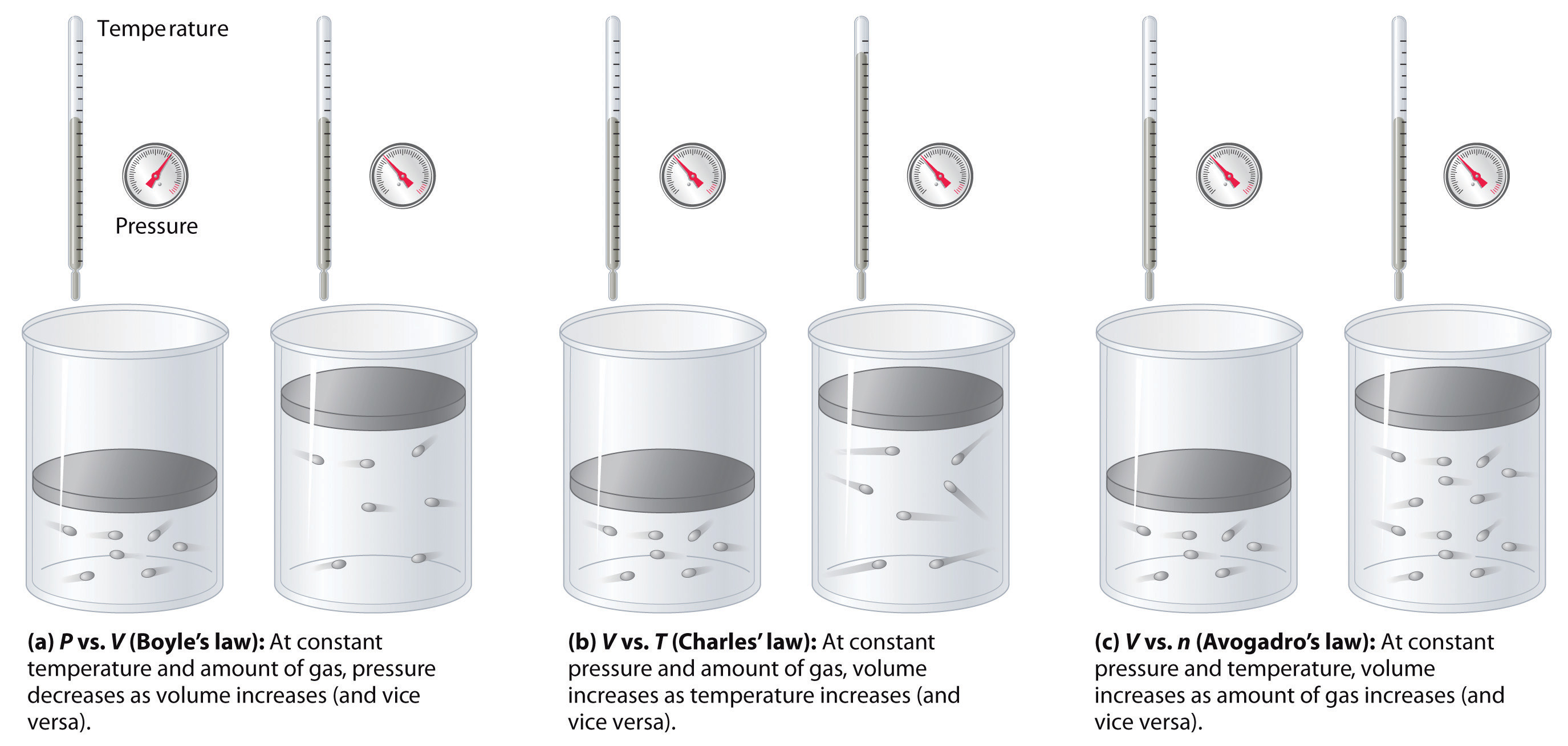
Resumen
El volumen de un gas es inversamente proporcional a su presión y directamente proporcional a su temperatura y a la cantidad de gas. Boyle demostró que el volumen de una muestra de un gas es inversamente proporcional a su presión (ley de Boyle), Charles y Gay-Lussac demostraron que el volumen de un gas es directamente proporcional a su temperatura (en kelvin) a presión constante (ley de Charles), y Avogadro postuló que el volumen de un gas es directamente proporcional al número de moles de gas presentes (ley de Avogadro). Las gráficas del volumen de gases versus temperatura se extrapolan a volumen cero a −273.15°C, que es cero absoluto (0 K), la temperatura más baja posible. La ley de Carlos implica que el volumen de un gas es directamente proporcional a su temperatura absoluta.

