8.1: Características de muchos átomos de electrones
- Page ID
- 78848
- Escribir la configuración electrónica de cualquier elemento y relacionar su configuración electrónica con su posición en la tabla periódica.
El modelo mecánico cuántico nos permitió determinar las energías de los orbitales atómicos de hidrógeno; ahora nos gustaría extender esto para describir la estructura electrónica de cada elemento de la Tabla Periódica. El proceso de describir la estructura electrónica de cada átomo consiste, esencialmente, en comenzar con hidrógeno y agregar un protón y un electrón a la vez para crear el siguiente elemento más pesado en la tabla; sin embargo, las interacciones entre electrones hacen que este proceso sea un poco más complicado de lo que parece. Todos los núcleos estables que no sean hidrógeno también contienen uno o más neutrones. Debido a que los neutrones no tienen carga eléctrica, sin embargo, pueden ser ignorados en la siguiente discusión. Antes de demostrar cómo hacer esto, sin embargo, debemos introducir el concepto de espín electrónico y el principio Pauli.
Orbitales y sus Energías
A diferencia de los átomos similares al hidrógeno con un solo electrón, en los átomos multielectrones los valores de los números cuánticos n y l determinan las energías de un orbital. Las energías de los diferentes orbitales para un átomo multielectrónico típico se muestran en la Figura\(\PageIndex{1}\). Dentro de una capa principal dada de un átomo multielectrón, las energías orbitales aumentan al aumentar l. Un orbital ns siempre se encuentra por debajo del orbital np correspondiente, que a su vez se encuentra por debajo del nd orbital.
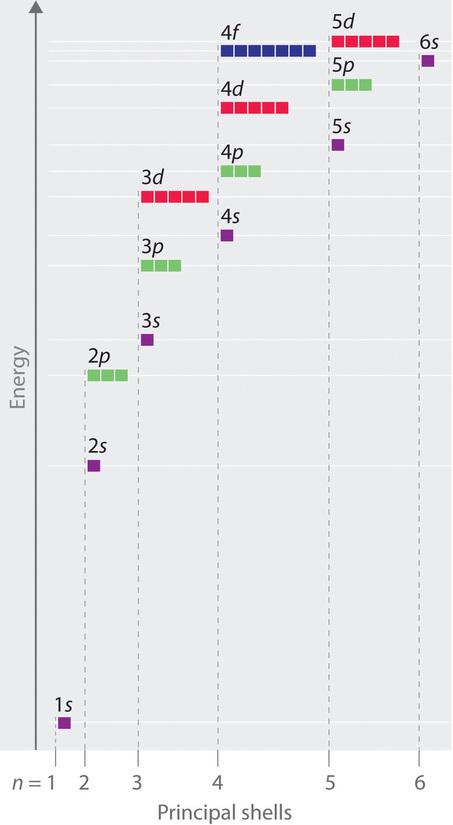
Estas diferencias de energía son causadas por los efectos del blindaje y la penetración, la medida en que una órbita dada se encuentra dentro de otros orbitales llenos. Por ejemplo, un electrón en el orbital de 2 s penetra dentro de un orbital lleno de 1 s más que un electrón en un orbital de 2 p. Dado que los electrones, todos ellos cargados negativamente, se repelen entre sí, un electrón más cercano al núcleo protege parcialmente a un electrón más alejado del núcleo del efecto atractivo del núcleo cargado positivamente. De ahí que en un átomo con un orbital lleno de 1 s, la carga nuclear efectiva (Z eff) experimentada por un electrón de 2 s es mayor que la Z eff experimentada por un electrón de 2 p. En consecuencia, el electrón de 2 s está más estrechamente unido al núcleo y tiene una energía menor, consistente con el orden de energías mostrado en la Figura\(\PageIndex{1}\).
Debido al blindaje de electrones,\(Z_{eff}\) aumenta más rápidamente pasando por una fila de la tabla periódica que bajando por una columna.
Observe en la Figura\(\PageIndex{1}\) que la diferencia de energías entre subconchas puede ser tan grande que las energías de orbitales de diferentes conchas principales pueden llegar a ser aproximadamente iguales. Por ejemplo, la energía de los orbitales de 3 d en la mayoría de los átomos está en realidad entre las energías de los orbitales de 4 s y 4 p.
Espín de electrones: El cuarto número cuántico
Cuando los científicos analizaron más de cerca los espectros de emisión y absorción de los elementos, vieron que para los elementos que tenían más de un electrón, casi todas las líneas en los espectros eran en realidad pares de líneas muy próximas. Debido a que cada línea representa un nivel de energía disponible para los electrones en el átomo, hay el doble de niveles de energía disponibles que se predecirían basándose únicamente en los números cuánticos\(n\),\(l\), y\(m_l\). Los científicos también descubrieron que aplicar un campo magnético provocaba que las líneas de los pares se dividieran más. En 1925, dos estudiantes de posgrado en física en los Países Bajos, George Uhlenbeck (1900—1988) y Samuel Goudsmit (1902—1978), propusieron que las divisiones eran causadas por un electrón que giraba alrededor de su eje, tanto como la Tierra gira alrededor de su eje. Cuando un objeto cargado eléctricamente gira, produce un momento magnético paralelo al eje de rotación, haciendo que se comporte como un imán. Si bien el electrón no puede ser visto únicamente como una partícula, girando o de otra manera, es indiscutible que sí tiene un momento magnético. Este momento magnético se llama espín de electrones.

En un campo magnético externo, el electrón tiene dos posibles orientaciones (Figura Figura\(\PageIndex{2}\)). Estos son descritos por un cuarto número cuántico (m s), que para cualquier electrón solo puede tener dos valores posibles, designados +½ (arriba) y −½ (abajo) para indicar que las dos orientaciones son opuestas; el subíndice s es para spin. Un electrón se comporta como un imán que tiene una de dos orientaciones posibles, alineadas ya sea con el campo magnético o contra él.
El principio de exclusión de Pauli
Las implicaciones del espín electrónico para la química fueron reconocidas casi de inmediato por un físico austriaco, Wolfgang Pauli (1900—1958; Premio Nobel de Física, 1945), quien determinó que cada orbital puede contener no más de dos electrones. Desarrolló el principio de exclusión Pauli: No hay dos electrones en un átomo que puedan tener los mismos valores de los cuatro números cuánticos (n, l, m l, m s).
Al dar los valores de n, l y m l, también especificamos un orbital particular (por ejemplo, 1 s con n = 1, l = 0, m l = 0). Debido a que m s solo tiene dos valores posibles (+½ o −½), dos electrones, y solo dos electrones, pueden ocupar cualquier orbital dado, uno con spin up y otro con spin down. Con esta información, podemos proceder a construir toda la tabla periódica, que originalmente se basó en las propiedades físicas y químicas de los elementos conocidos.
Enumere todas las combinaciones permitidas de los cuatro números cuánticos (n, l, m l, m s) para electrones en un orbital de 2 p y prediga el número máximo de electrones que la subcapa 2 p puede acomodar.
Dado: orbital
Preguntado por: números cuánticos permitidos y número máximo de electrones en orbital
Estrategia:
- Enumere los números cuánticos (n, l , m l) que corresponden a un orbital n = 2 p. Enumere todas las combinaciones permitidas de (n, l, m l).
- Construye sobre estas combinaciones para enumerar todas las combinaciones permitidas de (n, l, m l, m s).
- Sumar el número de combinaciones para predecir el número máximo de electrones que la subcapa 2 p puede acomodar.
Solución:
A Para un orbital de 2 p, sabemos que n = 2, l = n − 1 = 1, y m l = − l, (− l +1),..., (l − 1), l. Solo hay tres combinaciones posibles de (n, l, m l): (2, 1, 1), (2, 1, 0) y (2, 1, −1).
B Debido a que m s es independiente de los otros números cuánticos y puede tener valores de solo +½ y −½, hay seis combinaciones posibles de (n, l, m l, m s ): (2, 1, 1, +½), (2, 1, 1, −½), (2, 1, 0, +½), (2, 1, 0, −½), (2, 1, −1, +½), y (2, 1, −1, −½).
C De ahí que la subcapa 2 p, que consta de tres orbitales de 2 p (2 p x, 2 p y y 2 p z), puede contener un total de seis electrones, dos en cada orbital.
Enumere todas las combinaciones permitidas de los cuatro números cuánticos (n, l, m l, m s) para un orbital de 6 s, y prediga el número total de electrones que puede contener.
- Contestar
-
(6, 0, 0, +½), (6, 0, 0, −½); dos electrones
Número cuántico magnético (ml) y número cuántico de giro (ms): Número cuántico magnético (ml) y número cuántico de giro (ms), YouTube (se abre en una ventana nueva) [youtu.be] (se abre en una ventana nueva)
Resumen
La disposición de los átomos en la tabla periódica surge de la disposición de energía más baja de los electrones en la capa de valencia. Además de los tres números cuánticos (n, l, m l) dictados por la mecánica cuántica, se requiere un cuarto número cuántico para explicar ciertas propiedades de los átomos. Se trata del número cuántico de espín electrónico (m s), que puede tener valores de +½ o −½ para cualquier electrón, correspondientes a las dos posibles orientaciones de un electrón en un campo magnético. El concepto de espín electrónico tiene importantes consecuencias para la química porque el principio de exclusión Pauli implica que ningún orbital puede contener más de dos electrones (con espín opuesto).

