1.5: Una breve historia de la química
- Page ID
- 78222
- Comprender el desarrollo del modelo atómico.
No fue hasta la época de los antiguos griegos que tenemos algún registro de cómo la gente trató de explicar los cambios químicos que observaban y utilizaban. En ese momento, se pensaba que los objetos naturales consistían únicamente en cuatro elementos básicos: tierra, aire, fuego y agua. Entonces, en el siglo IV a.C., dos filósofos griegos, Demócrito y Leucipo, sugirieron que la materia no era infinitamente divisible en partículas más pequeñas sino que consistía en partículas fundamentales e indivisibles llamadas átomos. Desafortunadamente, estos primeros filósofos no contaban con la tecnología para poner a prueba su hipótesis. Hubiera sido poco probable que lo hicieran en cualquier caso porque los antiguos griegos no realizaban experimentos ni utilizaban el método científico. Creían que la naturaleza del universo podía ser descubierta solo por el pensamiento racional.
Durante los dos milenios siguientes, los alquimistas, que se dedicaron a una forma de química y filosofía especulativa durante la Edad Media y el Renacimiento, lograron muchos avances en la química. Su principal objetivo era convertir ciertos elementos en otros mediante un proceso que llamaron transmutación (Figura\(\PageIndex{1}\)). En particular, los alquimistas querían encontrar la manera de transformar metales más baratos en oro. Aunque la mayoría de los alquimistas no abordaron la química sistemáticamente y muchos parecen haber sido plagados, los alquimistas de China, los reinos árabes y la Europa medieval hicieron importantes contribuciones, incluido el descubrimiento de elementos como la plata viva (mercurio) y la preparación de varios ácidos fuertes.
Figura\(\PageIndex{1}\) Un alquimista en el trabajo

La alquimia fue una forma de química que floreció durante la Edad Media y el Renacimiento. Si bien algunos alquimistas eran fraudes, otros hicieron contribuciones importantes, entre ellas el descubrimiento de varios elementos y la preparación de ácidos fuertes.
Química Moderna
Los siglos XVI y XVII vieron los inicios de lo que hoy reconocemos como química moderna. Durante este periodo se lograron grandes avances en metalurgia, extracción de metales a partir de minerales y se realizaron los primeros experimentos cuantitativos sistemáticos. En 1661, el inglés Robert Boyle (1627—1691) publicó The Sceptical Chymist, que describía la relación entre la presión y el volumen de aire. Más importante aún, Boyle definió un elemento como una sustancia que no se puede descomponer en dos o más sustancias más simples por medios químicos. Esto llevó a la identificación de una gran cantidad de elementos, muchos de los cuales eran metales. Irónicamente, el propio Boyle nunca pensó que los metales fueran elementos.
En el siglo XVIII, el clérigo inglés Joseph Priestley (1733-1804) descubrió el gas oxígeno y descubrió que muchos materiales que contienen carbono se queman vigorosamente en una atmósfera de oxígeno, un proceso llamado combustión. Priestley también descubrió que el gas producido por la fermentación de la cerveza, que ahora sabemos que es dióxido de carbono, es el mismo que uno de los productos gaseosos de la combustión. Sin embargo, los estudios de Priestley sobre este gas no continuaron como le hubiera gustado. Después de caer en una cuba de cerveza fermentada, los cerveceros le prohibieron trabajar en sus fábricas. Si bien Priestley no entendió su identidad, encontró que el dióxido de carbono se disolvió en el agua para producir agua seltzer. En esencia, puede ser considerado el fundador de la industria multimillonaria de refrescos carbonatados.
José Priestley (1733—1804)
Priestley era un teórico político y un destacado ministro unitario. Fue nombrado para la Academia Warrington en Lancashire, Inglaterra, donde desarrolló nuevos cursos sobre historia, ciencia y artes. Durante visitas a Londres, Priestley conoció a los principales hombres de la ciencia, entre ellos Benjamin Franklin, quien alentó el interés de Priestley por la electricidad. El trabajo de Priestley sobre los gases comenzó mientras vivía junto a una cervecería en Leeds, donde notó “aire fijo” burbujeando en las cubas de cerveza fermentada y ale. Sus descubrimientos científicos incluyeron la relación entre la electricidad y el cambio químico, 10 nuevos “aires” y observaciones que llevaron al descubrimiento de la fotosíntesis. Debido a su apoyo a los principios de la Revolución Francesa, la casa, la biblioteca y el laboratorio de Priestley fueron destruidos por una turba en 1791. Él y su esposa emigraron a Estados Unidos en 1794 para unirse a sus tres hijos, quienes previamente habían emigrado a Pensilvania. Priestley nunca regresó a Inglaterra y murió en su nuevo hogar en Pensilvania.
A pesar de los estudios pioneros de Priestley y otros, una comprensión clara de la combustión siguió siendo difícil de alcanzar. A finales del siglo XVIII, sin embargo, el científico francés Antoine Lavoisier (1743—1794) demostró que la combustión es la reacción de una sustancia que contiene carbono con el oxígeno para formar dióxido de carbono y agua y que la vida depende de una reacción similar, que hoy llamamos respiración. Lavoisier también escribió el primer texto de química moderna y es ampliamente considerado como el padre de la química moderna. Su contribución más importante fue la ley de conservación de la masa, que establece que en cualquier reacción química, la masa de las sustancias que reaccionan es igual a la masa de los productos que se forman. Es decir, en una reacción química, la masa no se pierde ni se destruye. Desafortunadamente, Lavoisier invirtió en una corporación privada que recaudaba impuestos para la Corona, y los recaudadores reales de impuestos no fueron populares durante la Revolución Francesa. Fue ejecutado en la guillotina a los 51 años, terminando prematuramente sus contribuciones a la química.
La teoría atómica de la materia
En 1803, el profesor de inglés John Dalton (1766—1844) amplió el desarrollo de Proust de la ley de proporciones definidas (Sección 1.2) y los hallazgos de Lavoisier sobre la conservación de la masa en reacciones químicas para proponer que los elementos consisten en partículas indivisibles que él llamó átomos (tomando el término de Demócrito y Leucipo). La teoría atómica de la materia de Dalton contiene cuatro hipótesis fundamentales:
- Toda la materia está compuesta por diminutas partículas indivisibles llamadas átomos.
- Todos los átomos de un elemento son idénticos en masa y propiedades químicas, mientras que los átomos de diferentes elementos difieren en masa y propiedades químicas fundamentales.
- Un compuesto químico es una sustancia que siempre contiene los mismos átomos en la misma proporción.
- En las reacciones químicas, los átomos de uno o más compuestos o elementos se redistribuyen o reordenan en relación con otros átomos para formar uno o más compuestos nuevos. Los átomos mismos no experimentan un cambio de identidad en las reacciones químicas.
Esta última hipótesis sugería que el objetivo de los alquimistas de transmutar otros elementos al oro era imposible, al menos a través de reacciones químicas. Ahora sabemos que la teoría atómica de Dalton es esencialmente correcta, con cuatro modificaciones menores:
- No todos los átomos de un elemento deben tener precisamente la misma masa.
- Los átomos de un elemento pueden transformarse en otro a través de reacciones nucleares.
- Las composiciones de muchos compuestos sólidos son algo variables.
- Bajo ciertas circunstancias, algunos átomos pueden dividirse (dividirse en partículas más pequeñas).
Estas modificaciones ilustran la efectividad del método científico; posteriormente se utilizaron experimentos y observaciones para refinar la teoría original de Dalton.
La Ley de las Múltiples Proporciones
A pesar de la claridad de su pensamiento, Dalton no pudo usar su teoría para determinar las composiciones elementales de los compuestos químicos porque no tenía una escala confiable de masas atómicas; es decir, desconocía las masas relativas de elementos como el carbono y el oxígeno. Por ejemplo, sabía que el gas que ahora llamamos monóxido de carbono contenía carbono y oxígeno en la proporción 1:1 .33 en masa, y un segundo compuesto, el gas que llamamos dióxido de carbono, contenía carbono y oxígeno en la proporción 1:2 .66 en masa. Debido a que 2.66/1.33 = 2.00, el segundo compuesto contenía el doble de átomos de oxígeno por átomo de carbono que el primero. Pero, ¿cuál era la fórmula correcta para cada compuesto? Si el primer compuesto consistió en partículas que contienen un átomo de carbono y un átomo de oxígeno, el segundo debe consistir en partículas que contienen un átomo de carbono y dos átomos de oxígeno. Si el primer compuesto tenía dos átomos de carbono y un átomo de oxígeno, el segundo debe tener dos átomos de carbono y dos átomos de oxígeno. Si el primero tuviera un átomo de carbono y dos átomos de oxígeno, el segundo tendría un átomo de carbono y cuatro átomos de oxígeno, y así sucesivamente. Dalton no tenía forma de distinguir entre estas o alternativas más complicadas. Sin embargo, estos datos llevaron a una afirmación general que ahora se conoce como la ley de proporciones múltiples: cuando dos elementos forman una serie de compuestos, las proporciones de las masas del segundo elemento que están presentes por gramo del primer elemento casi siempre se pueden expresar como las proporciones de números enteros. (La misma ley se aplica para las relaciones másicas de compuestos que forman una serie que contiene más de dos elementos). El Ejemplo 4 muestra cómo se puede aplicar la ley de proporciones múltiples para determinar la identidad de un compuesto.
Un químico está estudiando una serie de compuestos simples de carbono e hidrógeno. En la siguiente tabla se enumeran las masas de hidrógeno que se combinan con 1 g de carbono para formar cada compuesto.
| Compuesto | Masa de hidrógeno (g) |
|---|---|
| A | 0.0839 |
| B | 0.1678 |
| C | 0.2520 |
| D |
- Determinar si estos datos siguen la ley de múltiples proporciones.
- Calcular la masa de hidrógeno que combinaría con 1 g de carbono para formar D, el cuarto compuesto de la serie.
Dado: masa de hidrógeno por gramo de carbono para tres compuestos
Preguntado por:
- relaciones de masas de hidrógeno a carbono
- masa de hidrógeno por gramo de carbono para el cuarto compuesto en serie
Estrategia:
A Seleccione la masa más baja para usar como denominador y luego calcule la relación de cada una de las otras masas con respecto a esa masa. Incluir otras proporciones si procede.
B Si las proporciones son enteros pequeños, los datos siguen la ley de proporciones múltiples.
C Decidir si las proporciones forman una serie numérica. Si es así, entonces determine el siguiente miembro de esa serie y prediga la relación correspondiente al siguiente compuesto de la serie.
D Utilizar proporciones para calcular la masa de hidrógeno por gramo de carbono en ese compuesto.
Solución
Un Compuesto A tiene la masa más baja de hidrógeno, por lo que lo usamos como denominador. Las relaciones de las masas restantes de hidrógeno, B y C, que se combinan con 1 g de carbono son las siguientes:
CA=0.2520 g0.0839 g=3.00=31ba=0.1678 g0.0839 g=2.00=21cb=0.2520 g0.1678 g=1.502≈32
B Las proporciones de las masas de hidrógeno que se combinan con 1 g de carbono, en efecto, están compuestas por pequeños enteros enteros (3/1, 2/1, 3/2), según lo predicho por la ley de proporciones múltiples.
C Las relaciones B/A y C/A forman la serie 2/1, 3/1, por lo que el siguiente miembro de la serie debe ser D/A = 4/1.
D Así, si el compuesto D existe, se formaría combinando 4 × 0.0839 g = 0.336 g de hidrógeno con 1 g de carbono. Tal compuesto sí existe; es el metano, el principal constituyente del gas natural.
Se conocen cuatro compuestos que solo contienen azufre y flúor. En la siguiente tabla se enumeran las masas de flúor que se combinan con 1 g de azufre para formar cada compuesto.
| Compuesto | Masa de Flúor (g) |
|---|---|
| A | 3.54 |
| B | 2.96 |
| C | 2.36 |
| D | 0.59 |
- Determinar las proporciones de las masas de flúor que se combinan con 1 g de azufre en estos compuestos. ¿Estos datos son consistentes con la ley de proporciones múltiples?
- Calcular la masa de flúor que combinaría con 1 g de azufre para formar los siguientes dos compuestos de la serie: E y F.
- Contestar
-
- A/D = 6.0 o 6/1; B/D ≈ 5.0, o 5/1; C/D = 4.0, o 4/1; si
- Las relaciones de 3.0 y 2.0 dan 1.8 g y 1.2 g de fluor/gramo de azufre, respectivamente. (Todavía no se conoce ninguno de estos compuestos).
Hipótesis de Avogadro
En otro intento de establecer las fórmulas de compuestos químicos, el químico francés Joseph Gay-Lussac (1778—1850) realizó una serie de experimentos utilizando mediciones de volumen. Bajo condiciones de temperatura y presión constantes, midió cuidadosamente los volúmenes de gases que reaccionaban para elaborar un compuesto químico dado, junto con los volúmenes de los productos si eran gases. Gay-Lussac encontró, por ejemplo, que un volumen de gas cloro siempre reaccionaba con un volumen de gas hidrógeno para producir dos volúmenes de gas cloruro de hidrógeno. De igual manera, un volumen de gas oxígeno siempre reaccionó con dos volúmenes de gas hidrógeno para producir dos volúmenes de vapor de agua (parte (a) en la Figura\(\PageIndex{2}\)).
Figura Experimentos de\(\PageIndex{2}\) Gay-Lussac con gas cloro y gas hidrógeno

a) Un volumen de gas cloro reaccionó con un volumen de gas hidrógeno para producir dos volúmenes de gas cloruro de hidrógeno, y un volumen de gas oxígeno reaccionó con dos volúmenes de gas hidrógeno para producir dos volúmenes de vapor de agua. b) Un resumen de la hipótesis de Avogadro, que interpretó los resultados de Gay-Lussac en términos de átomos. Tenga en cuenta que la forma más sencilla para que se produzcan dos moléculas de cloruro de hidrógeno es si el hidrógeno y el cloro consisten cada uno en moléculas que contienen dos átomos del elemento.
Los resultados de Gay-Lussac no revelaron por sí mismos las fórmulas para el cloruro de hidrógeno y el agua. El químico italiano Amadeo Avogadro (1776—1856) desarrolló la visión clave que condujo a las fórmulas exactas. Propuso que cuando los gases se miden a la misma temperatura y presión, volúmenes iguales de diferentes gases contienen igual número de partículas de gas. La hipótesis de Avogadro, que explicó los resultados de Gay-Lussac, se resume aquí y en la parte (b) en la Figura\(\PageIndex{2}\):
\( one volume(or particle) ofhydrogen+one volume(or particle) ofchlorine→two volumes(or particles) of hydrogen chloride \)
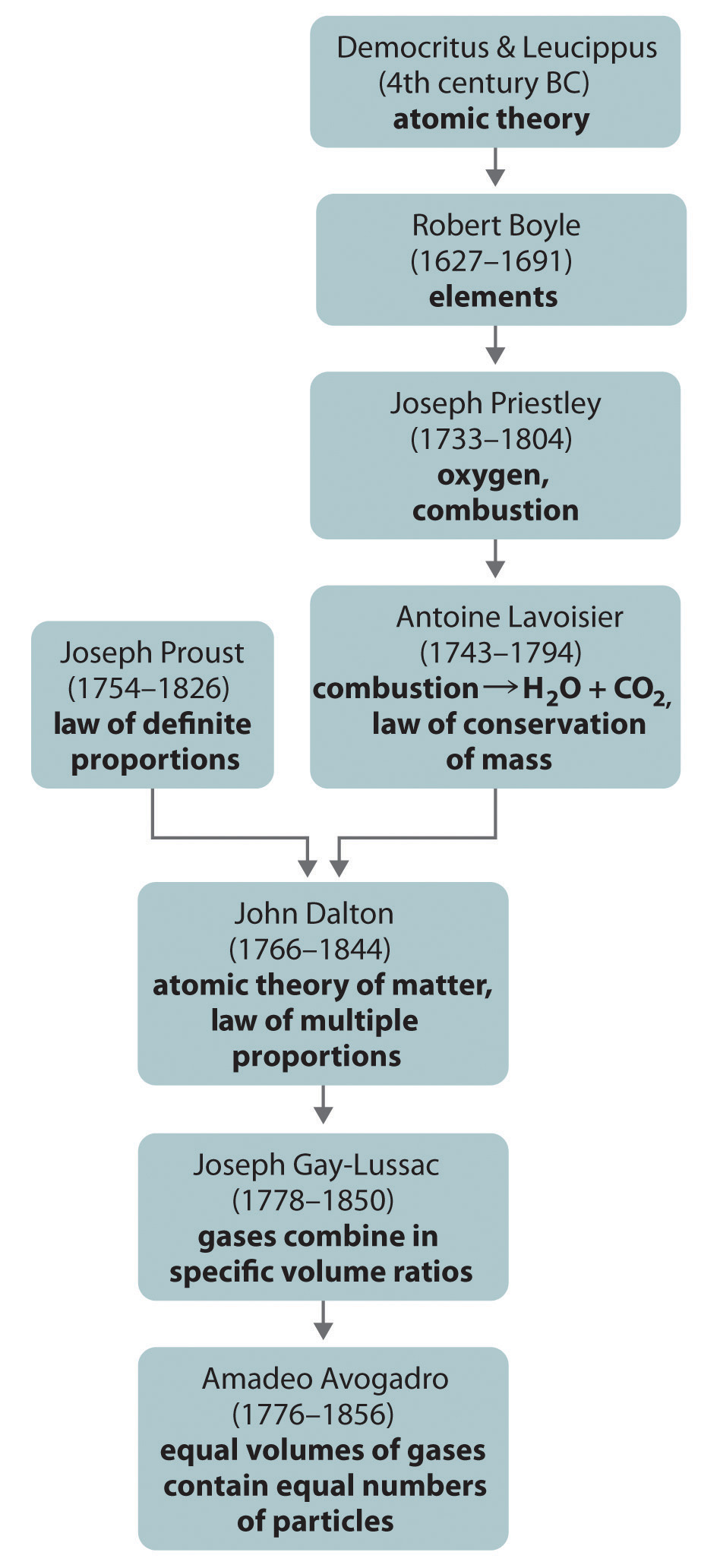
Si la teoría de los átomos de Dalton era correcta, entonces cada partícula de hidrógeno o cloro tenía que contener al menos dos átomos de hidrógeno o cloro porque se produjeron dos partículas de cloruro de hidrógeno. La explicación más simple, pero no la única, fue que el hidrógeno y el cloro contenían dos átomos cada uno (es decir, eran diatómicos) y que el cloruro de hidrógeno contenía un átomo cada uno de hidrógeno y cloro. La aplicación de este razonamiento a los resultados de Gay-Lussac con hidrógeno y oxígeno lleva a la conclusión de que el agua contiene dos átomos de hidrógeno por átomo de oxígeno. Desafortunadamente, debido a que ningún dato respaldaba la hipótesis de Avogadro de que volúmenes iguales de gases contenían igual número de partículas, sus explicaciones y fórmulas para compuestos simples no fueron generalmente aceptadas por más de 50 años. Dalton y muchos otros continuaron creyendo que las partículas de agua contenían un átomo de hidrógeno y un átomo de oxígeno, en lugar de dos átomos de hidrógeno y un átomo de oxígeno. El desarrollo histórico del concepto de átomo se resume en la Figura\(\PageIndex{3}\).
Figura\(\PageIndex{3}\) A Resumen del Desarrollo Histórico del Concepto del Átomo
Resumen
Los antiguos griegos propusieron por primera vez que la materia consistía en partículas fundamentales llamadas átomos. La química tomó su forma científica actual en el siglo XVIII, cuando los cuidadosos experimentos cuantitativos de Lavoisier, Proust y Dalton dieron como resultado la ley de proporciones definidas, la ley de conservación de la masa y la ley de proporciones múltiples, que sentaron las bases para Dalton de la teoría atómica de la materia. En particular, la hipótesis de Avogadro proporcionó el primer vínculo entre las propiedades macroscópicas de una sustancia (en este caso, el volumen de un gas) y el número de átomos o moléculas presentes.
LLAVE PARA LLEVAR
- El desarrollo del modelo atómico se basó en la aplicación del método científico a lo largo de varios siglos.
PROBLEMAS CONCEPTUALES
- Definir la combustión y discutir los aportes realizados por Priestley y Lavoisier para comprender una reacción de combustión.
- Los ingenieros químicos suelen utilizar el concepto de “balance de masas” en sus cálculos, en el que la masa de los reactivos debe ser igual a la masa de los productos. ¿Qué ley sustenta esta práctica?
- ¿Se aplica la ley de proporciones múltiples tanto a las relaciones másicas como a las relaciones atómicas? ¿Por qué o por qué no?
- ¿Cuáles son las cuatro hipótesis de la teoría atómica de la materia?
- Gran parte de la energía en Francia es proporcionada por reacciones nucleares. ¿Tales reacciones son consistentes con las hipótesis de Dalton? ¿Por qué o por qué no?
- ¿1 L de aire contiene el mismo número de partículas que 1 L de gas nitrógeno? Explica tu respuesta.
PROBLEMAS NUMÉRICOS
Por favor, asegúrese de estar familiarizado con los temas tratados en Habilidades Esenciales 1 (Sección 1.9) antes de proceder a los Problemas Numéricos.
- Uno de los minerales que se encuentran en el suelo tiene una relación atómica Al:Si:O de 0. 2:0. 2:0 .5. ¿Esto es congruente con la ley de múltiples proporciones? ¿Por qué o por qué no? ¿La relación de elementos es consistente con la teoría atómica de la materia de Dalton?
- El nitrógeno y el oxígeno reaccionan para formar tres compuestos diferentes que contienen 0.571 g, 1.143 g y 2.285 g de oxígeno/gramo de nitrógeno, respectivamente. ¿Esto es congruente con la ley de múltiples proporciones? Explica tu respuesta.
- Se conocen tres compuestos binarios de vanadio y oxígeno. En la siguiente tabla se dan las masas de oxígeno que se combinan con 10.00 g de vanadio para formar cada compuesto.
Compuesto Masa de Oxígeno (g) A 4.71 B 6.27 C - Determinar la relación de las masas de oxígeno que se combinan con 3.14 g de vanadio en los compuestos A y B.
- Predecir la masa de oxígeno que se combinaría con 3.14 g de vanadio para formar el tercer compuesto de la serie.
- Se conocen tres compuestos que contienen titanio, magnesio y oxígeno. En la siguiente tabla se dan las masas de titanio y magnesio que reaccionan con 5.00 g de oxígeno para formar cada compuesto.
Compuesto Masa de Titanio (g) Masa de Magnesio (g) A 4.99 2.53 B 3.74 3.80 C - Determinar las proporciones de las masas de titanio y magnesio que se combinan con 5.00 g de oxígeno en estos compuestos.
- Predecir las masas de titanio y magnesio que se combinarían con 5.00 g de oxígeno para formar otro posible compuesto en la serie: C.


