1.7: Isótopos y masas atómicas
- Page ID
- 78181
- Conocer el significado de isótopos y masas atómicas.
El modelo nuclear del átomo de Rutherford ayudó a explicar por qué los átomos de diferentes elementos exhiben un comportamiento químico diferente. La identidad de un elemento se define por su número atómico (Z), el número de protones en el núcleo de un átomo del elemento. Por lo tanto, el número atómico es diferente para cada elemento. Los elementos conocidos están dispuestos en orden de incremento Z en la tabla periódica (Figura\(\PageIndex{1}\)), Vamos a explicar la justificación del peculiar formato de la tabla periódica en el Capítulo 7. en el que a cada elemento se le asigna un único-, dos-, o tres- símbolo de letra. Los nombres de los elementos se enumeran en la tabla periódica, junto con sus símbolos, números atómicos y masas atómicas. La química de cada elemento está determinada por su número de protones y electrones. En un átomo neutro, el número de electrones es igual al número de protones.
Figura\(\PageIndex{1}\) La Tabla Periódica que Muestra los Elementos en Orden de Incrementar Z
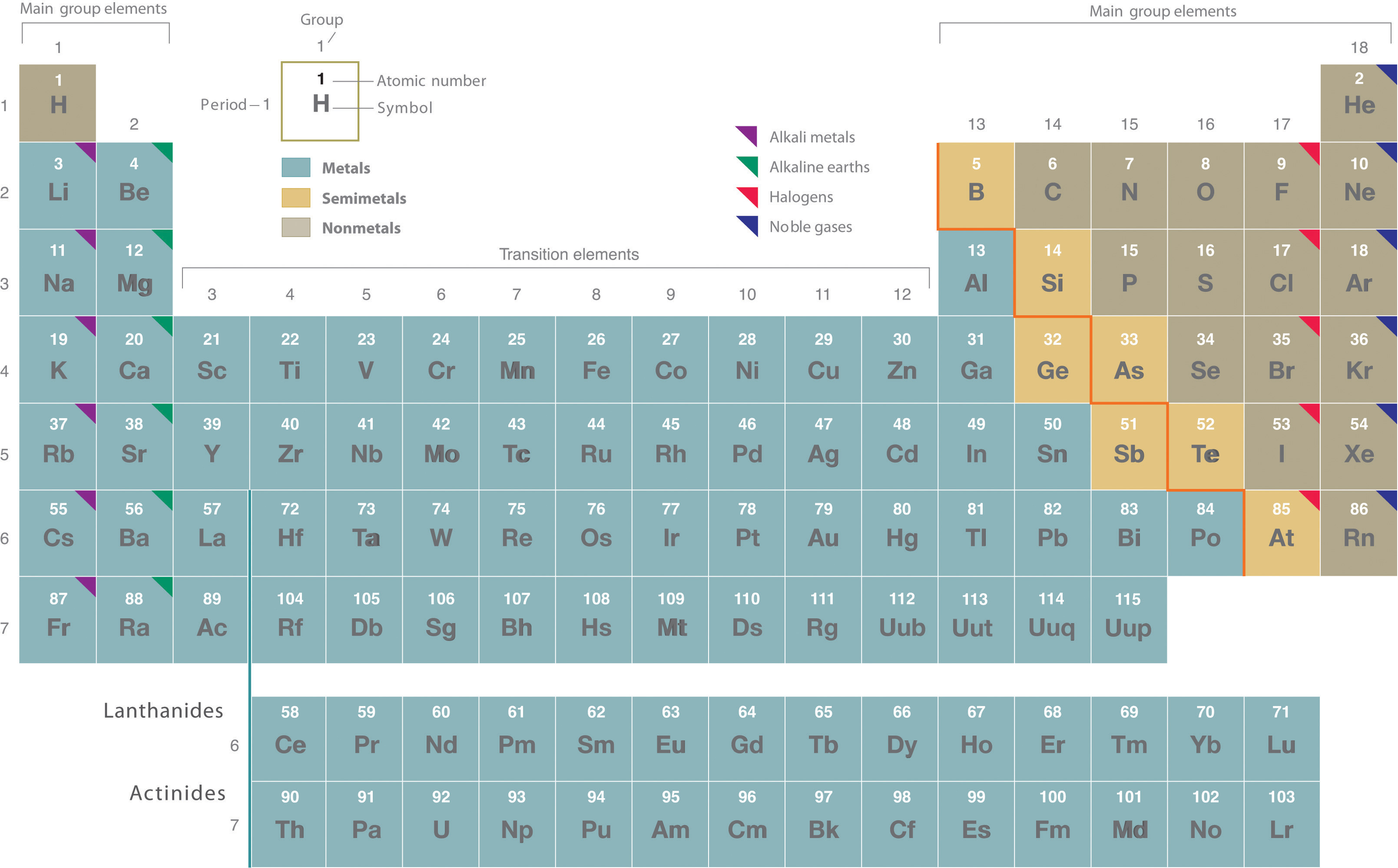
Como se describe en la Sección 1.8, los metales se encuentran en la parte inferior izquierda de la tabla periódica, y los no metales están en la parte superior derecha. Los semimetales se encuentran a lo largo de una línea diagonal que separa los metales y los no metales.
En la mayoría de los casos, los símbolos para los elementos se derivan directamente del nombre de cada elemento, como C para carbono, U para uranio, Ca para calcio y Po para polonio. Los elementos también han sido nombrados por sus propiedades [como el radio (Ra) por su radiactividad], por el país natal del científico o científicos que los descubrieron [polonio (Po) para Polonia], por científicos eminentes [curium (Cm) para los Curies], por dioses y diosas [selenio (Se) para la diosa griega de la luna, Selene], y por otras razones poéticas o históricas. Algunos de los símbolos utilizados para elementos que se conocen desde la antigüedad se derivan de nombres históricos que ya no están en uso; sólo quedan los símbolos para recordarnos su origen. Ejemplos son Fe para hierro, del latín ferrum; Na para sodio, del latín natrium; y W para tungsteno, del wolfram alemán. Los ejemplos están en la Tabla\(\PageIndex{1}\). A medida que trabajas a través de este texto, te encontrarás con los nombres y símbolos de los elementos repetidamente, y por mucho que te familiarices con los personajes de una obra de teatro o una película, sus nombres y símbolos se volverán familiares.
Símbolos de\(\PageIndex{1}\) elementos de tabla basados en nombres que ya no se utilizan
| Element | Símbolo | Derivación | Significado |
|---|---|---|---|
| antimonio | Sb | stibium | Latín para “mark” |
| cobre | Cu | cuprum | de Cyprium, nombre latino para la isla de Chipre, la principal fuente de mineral de cobre en el Imperio Romano |
| oro | Au | aurum | Latín para “gold” |
| hierro | Fe | ferrum | Latín para “iron” |
| plomo | Pb | plumbum | Latín para “heavy” |
| mercurio | Hg | hidrargiro | Latín para “liquid silver” |
| potasio | K | kalium | del árabe al-qili, “álcali” |
| plata | Ag | argentum | Latín para “silver” |
| sodio | Na | sodio | Latín para “sodium” |
| estaño | Sn | stannum | Latín para “tin” |
| tungsteno | W | wolfram | Alemán para “piedra de lobo” porque interfería con la fundición de estaño y se pensó que devoraba la lata |
Recordemos de la Sección 1.6 que los núcleos de la mayoría de los átomos contienen neutrones así como protones. A diferencia de los protones, el número de neutrones no está absolutamente fijo para la mayoría de los elementos. Los átomos que tienen el mismo número de protones, y de ahí el mismo número atómico, pero diferentes números de neutrones se denominan isótopos. Todos los isótopos de un elemento tienen el mismo número de protones y electrones, lo que significa que exhiben la misma química. Los isótopos de un elemento difieren únicamente en su masa atómica, la cual viene dada por el número de masa (A), la suma de los números de protones y neutrones.
El elemento carbono (C) tiene un número atómico de 6, lo que significa que todos los átomos de carbono neutros contienen 6 protones y 6 electrones. En una muestra típica de material que contiene carbono, 98.89% de los átomos de carbono también contienen 6 neutrones, por lo que cada uno tiene un número de masa de 12. Un isótopo de cualquier elemento se puede representar de manera única como XZA, donde X es el símbolo atómico del elemento. El isótopo de carbono que tiene 6 neutrones es por lo tanto C612. El subíndice que indica el número atómico es realmente redundante porque el símbolo atómico ya especifica de forma única Z. En consecuencia, C612 se escribe más a menudo como 12 C, que se lee como “carbono-12". Sin embargo, el valor de Z se incluye comúnmente en la notación para reacciones nucleares porque estas reacciones implican cambios en Z, como se describe en el Capítulo 20.
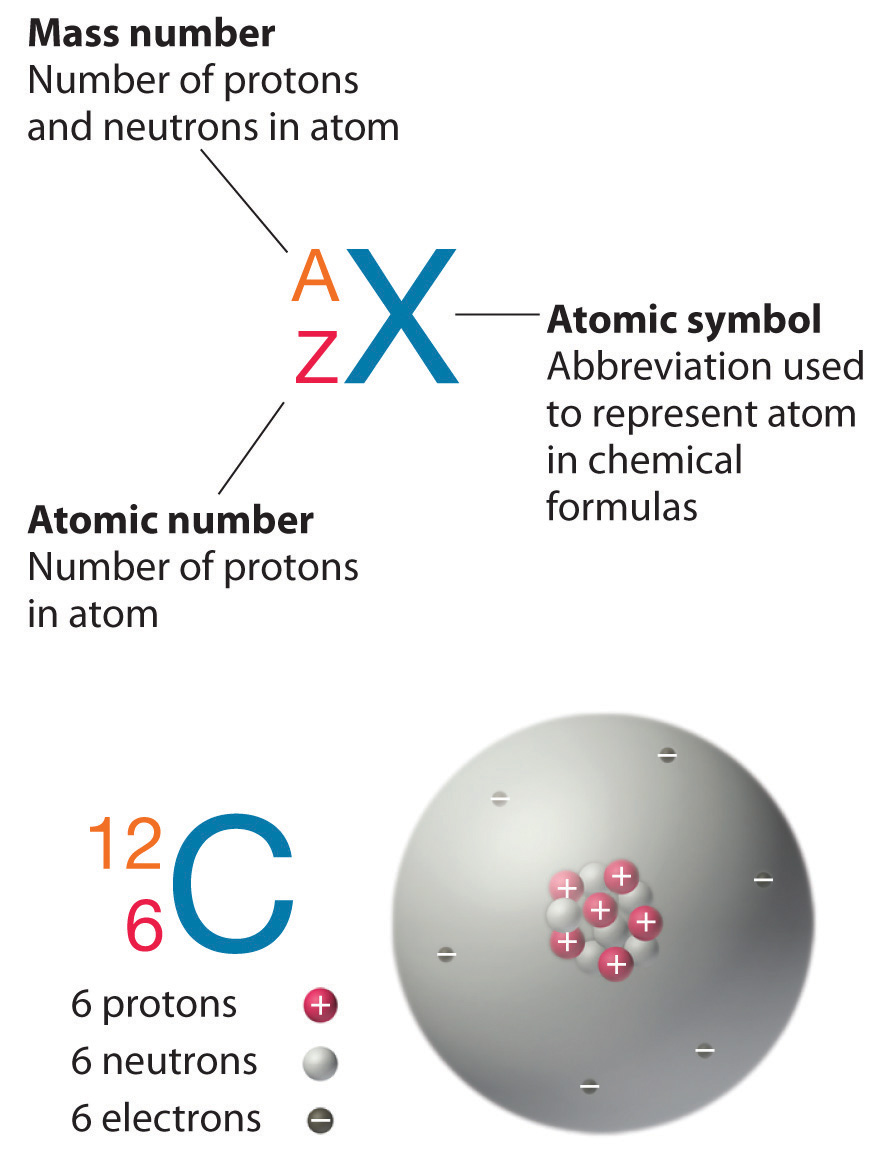
Además de 12 C, una muestra típica de carbono contiene 1.11% de C613 (13 C), con 7 neutrones y 6 protones, y una traza de C614 (14 C), con 8 neutrones y 6 protones. El núcleo de 14 C no es estable, sin embargo, sino que sufre una lenta desintegración radiactiva que es la base de la técnica de datación por carbono-14 utilizada en arqueología (ver Capítulo 14). Muchos elementos distintos al carbono tienen más de un isótopo estable; el estaño, por ejemplo, tiene 10 isótopos. Las propiedades de algunos isótopos comunes se encuentran en la Tabla\(\PageIndex{2}\).
\(\PageIndex{2}\)Propiedades de Tabla de Isótopos Seleccionados
| Element | Símbolo | Masa atómica (amu) | Número de masa de isótopo | Masas isotópicas (amu) | Abundancias porcentuales (%) |
|---|---|---|---|---|---|
| hidrógeno | H | 1.0079 | 1 | 1.007825 | 99.9855 |
| 2 | 2.014102 | 0.0115 | |||
| boro | B | 10.81 | 10 | 10.012937 | 19.91 |
| 11 | 11.009305 | 80.09 | |||
| carbono | C | 12.011 | 12 | 12 (definido) | 99.89 |
| 13 | 13.003355 | 1.11 | |||
| oxígeno | O | 15.9994 | 16 | 15.994915 | 99.757 |
| 17 | 16.999132 | 0.0378 | |||
| 18 | 17.999161 | 0.205 | |||
| hierro | Fe | 55.845 | 54 | 53.939611 | 5.82 |
| 56 | 55.934938 | 91.66 | |||
| 57 | 56.935394 | 2.19 | |||
| 58 | 57.933276 | 0.33 | |||
| uranio | U | 238.03 | 234 | 234.040952 | 0.0054 |
| 235 | 235.043930 | 0.7204 | |||
| 238 | 238.050788 | 99.274 |
Fuentes de datos de isótopos: G. Audi et al., Física Nuclear A 729 (2003): 337—676; J. C. Kotz y K. F. Purcell, Química y reactividad química, 2a ed., 1991.
Dado: número de protones y neutrones
Preguntado por: elemento y símbolo atómico
Estrategia:
A Consulte la tabla periódica (ver Capítulo 32) y utilizar el número de protones para identificar el elemento.
B Calcular el número de masa de cada isótopo sumando los números de protones y neutrones.
C Dar el símbolo de cada isótopo con el número de masa como superíndice y el número de protones como subíndice, ambos escritos a la izquierda del símbolo del elemento.
Solución
A El elemento con 82 protones (número atómico de 82) es plomo: Pb.
B Para el primer isótopo, A = 82 protones + 124 neutrones = 206. De igual manera, A = 82 + 125 = 207 y A = 82 + 126 = 208 para el segundo y tercer isótopos, respectivamente. Los símbolos para estos isótopos son P82206b, P82207b y P82208b, que generalmente se abrevian como 206 Pb, 207 Pb y 208 Pb.
Identificar el elemento con 35 protones y escribir los símbolos para sus isótopos con 44 y 46 neutrones.
- Responder
-
Respuesta: 35 79 B y 3581 B o, más comúnmente, 79 Br y 81 Br.
Aunque las masas del electrón, el protón y el neutrón son conocidas con un alto grado de precisión (Cuadro 1.3), la masa de cualquier átomo dado no es simplemente la suma de las masas de sus electrones, protones y neutrones. Por ejemplo, la relación de las masas de 1 H (hidrógeno) y 2 H (deuterio) es en realidad 0.500384, en lugar de 0.49979 como se predijo a partir de los números de neutrones y protones presentes. Si bien la diferencia de masa es pequeña, es sumamente importante porque es la fuente de las enormes cantidades de energía liberadas en las reacciones nucleares (Capítulo 20).
Debido a que los átomos son demasiado pequeños para medirlos individualmente y no tienen carga, no hay una manera conveniente de medir con precisión las masas atómicas absolutas. Los científicos pueden medir las masas atómicas relativas con mucha precisión, sin embargo, utilizando un instrumento llamado espectrómetro de masas. La técnica es conceptualmente similar a la que utilizó Thomson para determinar la relación masa-carga del electrón. Primero, los electrones se eliminan o se agregan a átomos o moléculas, produciendo así partículas cargadas llamadas iones. Cuando se aplica un campo eléctrico, los iones se aceleran hacia una cámara separada donde son desviados de su trayectoria inicial por un campo magnético, como los electrones en el experimento de Thomson. La extensión de la deflexión depende de la relación masa/carga del ion. Al medir la deflexión relativa de iones que tienen la misma carga, los científicos pueden determinar sus masas relativas (Figura 1.25). Por lo tanto, no es posible calcular las masas atómicas absolutas con precisión simplemente sumando las masas de los electrones, los protones y los neutrones, y las masas atómicas absolutas no se pueden medir, sino que las masas relativas se pueden medir con mucha precisión. En realidad es bastante común en química encontrar una cantidad cuya magnitud puede medirse sólo en relación con alguna otra cantidad, en lugar de absolutamente. Encontraremos muchos otros ejemplos más adelante en este texto. En tales casos, los químicos suelen definir un estándar asignando arbitrariamente un valor numérico a una de las cantidades, lo que les permite calcular valores numéricos para el resto.
Figura 1.25 Determinación de las masas atómicas relativas usando un espectrómetro de masas
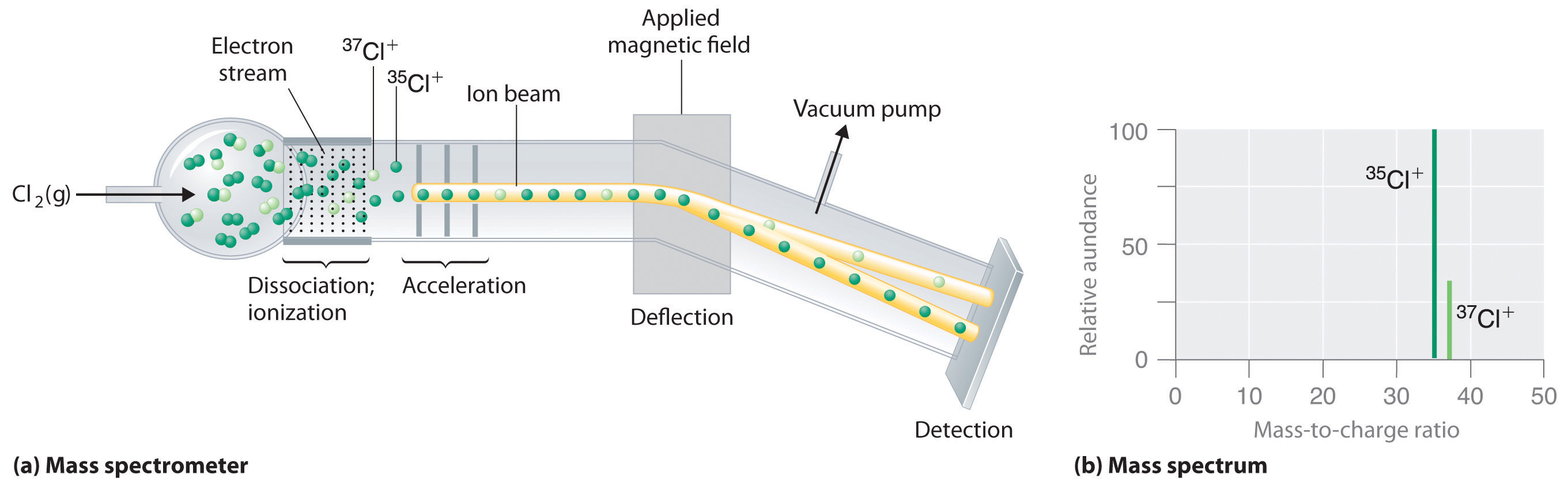
El cloro consiste en dos isótopos, 35 Cl y 37 Cl, en una proporción aproximada de 3:1. (a) Cuando se inyecta una muestra de cloro elemental en el espectrómetro de masas, se utiliza energía eléctrica para disociar las moléculas de Cl 2 en átomos de cloro y convertir los átomos de cloro en iones Cl +. Los iones se aceleran luego a un campo magnético. La medida en que los iones son desviados por el campo magnético depende de sus relaciones de masa a carga relativa. Tenga en cuenta que los iones 35 Cl + más ligeros son desviados más que los iones 37 Cl + más pesados. Al medir las deflexiones relativas de los iones, los químicos pueden determinar sus relaciones masa/carga y, por lo tanto, sus masas. (b) Cada pico en el espectro de masas corresponde a un ion con una relación masa/carga particular. La abundancia de los dos isótopos se puede determinar a partir de las alturas de los picos.
El estándar arbitrario que se ha establecido para describir la masa atómica es la unidad de masa atómica (amu), definida como una doceava parte de la masa de un átomo de 12 C. Debido a que las masas de todos los demás átomos se calculan en relación con el estándar de 12 C, 12 C es el único átomo listado en la Tabla\(\PageIndex{2}\) "cuya masa atómica exacta es igual al número másico. Los experimentos han demostrado que 1 amu = 1.66 × 10 −24 g.
Los experimentos espectrométricos de masas dan un valor de 0.167842 para la relación de la masa de 2 H a la masa de 12 C, por lo que la masa absoluta de 2 H es
masa de H2Masa de C12×Masa de C12= 0.167842 × 12 amu = 2.104104 amu
Las masas de los demás elementos se determinan de manera similar.
La tabla periódica enumera las masas atómicas de todos los elementos. Si compara estos valores con los dados para algunos de los isótopos en la Tabla\(\PageIndex{2}\), puede ver que las masas atómicas dadas en la tabla periódica nunca corresponden exactamente a las de ninguno de los isótopos. Debido a que la mayoría de los elementos existen como mezclas de varios isótopos estables, la masa atómica de un elemento se define como el promedio ponderado de las masas de los isótopos. Por ejemplo, el carbono natural es en gran parte una mezcla de dos isótopos: 98.89% 12 C (masa = 12 amu por definición) y 1.11% 13 C (masa = 13.003355 amu). El porcentaje de abundancia de 14 C es tan bajo que puede ignorarse en este cálculo. La masa atómica promedio de carbono se calcula entonces como
\( (0.9889 × 12 amu) + (0.0111 × 13.003355 amu) = 12.01 amu \)
El carbono es predominantemente de 12 C, por lo que su masa atómica promedio debe ser cercana a los 12 amu, lo que está de acuerdo con nuestro cálculo.
El valor de 12.01 se muestra bajo el símbolo para C en la tabla periódica, aunque sin la abreviatura amu, que habitualmente se omite. Así, la masa atómica tabulada de carbono o cualquier otro elemento es el promedio ponderado de las masas de los isótopos naturales.
El bromo natural consiste en los dos isótopos enumerados en la siguiente tabla:
| Isótopo | Masa Exacta (amu) | Porcentaje de Abundancia (%) |
|---|---|---|
| 79 Br | 78.9183 | 50.69 |
| 81 Br | 80.9163 | 49.31 |
Calcular la masa atómica del bromo.
Dado: masa exacta y porcentaje de abundancia
Preguntado por: masa atómica
Estrategia:
A Convertir las abundancias porcentuales a forma decimal para obtener la fracción de masa de cada isótopo.
B Multiplicar la masa exacta de cada isótopo por su fracción de masa correspondiente (porcentaje de abundancia ÷ 100) para obtener su masa ponderada.
C Sumar las masas ponderadas para obtener la masa atómica del elemento.
D Verifique para asegurarse de que su respuesta tenga sentido.
Solución
A La masa atómica es el promedio ponderado de las masas de los isótopos. En general, podemos escribir
masa atómica del elemento = [(masa del isótopo 1 en amu) (fracción másica del isótopo 1)] + [(masa del isótopo 2) (fracción másica del isótopo 2)] +...
El bromo tiene sólo dos isótopos. Convertir las abundancias porcentuales en fracciones de masa da
B79r: 50.69100=0.5069 B81r: 49.31100=0.4931
B Multiplicar la masa exacta de cada isótopo por la fracción de masa correspondiente da la masa ponderada del isótopo:
79 Br: 79.9183 amu × 0.5069 = 40.00 amu 81 Br: 80.9163 amu × 0.4931 = 39.90 amu
C La suma de las masas ponderadas es la masa atómica de bromo es
40.00 amu + 39.90 amu = 79.90 amu
D Este valor está aproximadamente a medio camino entre las masas de los dos isótopos, lo que se espera porque el porcentaje de abundancia de cada uno es aproximadamente del 50%.
El magnesio tiene los tres isótopos enumerados en la siguiente tabla:
| Isótopo | Masa Exacta (amu) | Porcentaje de Abundancia (%) |
|---|---|---|
| 24 Mg | 23.98504 | 78.70 |
| 25 Mg | 24.98584 | 10.13 |
| 26 Mg | 25.98259 | 11.17 |
Utilice estos datos para calcular la masa atómica del magnesio.
- Responder
-
24.31 amu
Resumen
Cada átomo de un elemento contiene el mismo número de protones, que es el número atómico (Z). Los átomos neutros tienen el mismo número de electrones y protones. Los átomos de un elemento que contienen diferentes números de neutrones se denominan isótopos. Cada isótopo de un elemento dado tiene el mismo número atómico pero un número másico diferente (A), que es la suma de los números de protones y neutrones. Las masas relativas de los átomos se reportan usando la unidad de masa atómica (amu), la cual se define como una doceava parte de la masa de un átomo de carbono-12, con 6 protones, 6 neutrones y 6 electrones. La masa atómica de un elemento es el promedio ponderado de las masas de los isótopos naturales. Cuando se añaden o eliminan uno o más electrones de un átomo o molécula, se produce una partícula cargada llamada ion, cuya carga se indica mediante un superíndice después del símbolo.
LLAVE PARA LLEVAR
- La masa de un átomo es un promedio ponderado que está determinado en gran medida por el número de sus protones y neutrones, mientras que el número de protones y electrones determina su carga.
PROBLEMAS CONCEPTUALES
- Complete la siguiente tabla para los elementos faltantes, símbolos y números de electrones.
Element Símbolo Número de electrones molibdeno 19 titanio B 53 Sm helio 14 - Complete la siguiente tabla para los elementos faltantes, símbolos y números de electrones.
Element Símbolo Número de electrones lantano Ir aluminio 80 sodio Si 9 Be - ¿La masa de un ion es la misma que la masa de su átomo padre? Explica tu respuesta.
- ¿Qué estándar isotópico se utiliza para determinar la masa de un átomo?
- Dar el símbolo XZA para estos elementos, todos los cuales existen como un solo isótopo.
- berilio
- rutenio
- fósforo
- aluminio
- cesio
- praseodimio
- cobalto
- itrio
- arsénico
- Dar el símbolo XZA para estos elementos, todos los cuales existen como un solo isótopo.
- flúor
- helio
- terbio
- yodo
- oro
- Escandio
- sodio
- niobio
- manganeso
- Identificar cada elemento, representado por X, que tenga los símbolos dados.
- X2655
- X3374
- X1224
- X53127
- X1840
- X63152
PROBLEMAS NUMÉRICOS
Por favor, asegúrese de estar familiarizado con los temas tratados en Habilidades Esenciales 1 (Sección 1.9) antes de proceder a los Problemas Numéricos.
- Los isótopos 131 I y 60 Co son de uso común en medicina. Determinar el número de neutrones, protones y electrones en un átomo neutro de cada uno.
- Determinar el número de protones, neutrones y electrones en un átomo neutro de cada isótopo:
- 97 Tc
- 113 In
- 63 Ni
- 55 Fe
- Tanto el tecnecio-97 como el americio-240 se producen en reactores nucleares. Determinar el número de protones, neutrones y electrones en los átomos neutros de cada uno.
- Los siguientes isótopos son importantes en la investigación arqueológica. ¿Cuántos protones, neutrones y electrones contiene un átomo neutro de cada uno?
- 207 Pb
- 16 O
- 40 K
- 137 Cs
- 40 Ar
- El cobre, un excelente conductor de calor, tiene dos isótopos: 63 Cu y 65 Cu. Utilice la siguiente información para calcular la masa atómica promedio del cobre:
Isótopo Porcentaje de Abundancia (%) Masa atómica (amu) 63 Cu 69.09 62.9298 65 Cu 30.92 64.9278 - El silicio consta de tres isótopos con las siguientes abundancias porcentuales:
Isótopo Porcentaje de Abundancia (%) Masa atómica (amu) 28 Si 92.18 27.976926 29 Si 4.71 28.976495 30 Si 3.12 29.973770 Calcular la masa atómica promedio del silicio.
- Completa la siguiente tabla para neón. La masa atómica promedio del neón es de 20.1797 amu.
Isótopo Porcentaje de Abundancia (%) Masa atómica (amu) 20 Ne 90.92 19.99244 21 Ne 0.257 20.99395 22 Ne - ¿Los isótopos X2863 y X2962 son del mismo elemento? Explica tu respuesta.
- Complete la siguiente tabla:
Isótopo Número de protones Número de Neutrones Número de electrones 238 X 95 238 U 75 112 - Complete la siguiente tabla:
Isótopo Número de protones Número de Neutrones Número de electrones 57 Fe 40 X 20 36 S - Usando un espectrómetro de masas, un científico determinó que el porcentaje de abundancias de los isótopos de azufre era 95.27% para 32 S, 0.51% para 33 S y 4.22% para 34 S. Utilice la masa atómica de azufre de la tabla periódica y las siguientes masas atómicas para determinar si estas los datos son precisos, asumiendo que estos son los únicos isótopos de azufre: 31.972071 amu para 32 S, 32.971459 amu para 33 S y 33.967867 amu para 34 S.
- Las abundancias porcentuales de dos de los tres isótopos de oxígeno son 99.76% para 16 O, y 0.204% para 18 O. Utilizar la masa atómica de oxígeno dada en la tabla periódica y los siguientes datos para determinar la masa de 17 O: 15.994915 amu para 16 O y 17.999160 amu para 18 O.
- ¿Qué elemento tiene la mayor proporción por masa en NaI?
- ¿Qué elemento tiene la mayor proporción por masa en KBr?


