1.8: Introducción a la Tabla Periódica
- Page ID
- 78212
- Familiarizarse con la organización de la tabla periódica.
Los elementos están dispuestos en una tabla periódica, que es probablemente la ayuda de aprendizaje más importante en química. Resume enormes cantidades de información sobre los elementos de una manera que le permite predecir muchas de sus propiedades y reacciones químicas. Los elementos están dispuestos en siete filas horizontales, en orden de aumentar el número atómico de izquierda a derecha y de arriba a abajo. Las filas se llaman periodos, y se numeran del 1 al 7. Los elementos se apilan de tal manera que elementos con propiedades químicas similares forman columnas verticales, llamadas grupos, numeradas del 1 al 18 (las tablas periódicas más antiguas utilizan un sistema basado en números romanos). Los grupos 1, 2 y 13—18 son los elementos principales del grupo, listados como A en tablas antiguas. Los grupos 3—12 están en el centro de la tabla periódica y son los elementos de transición, listados como B en tablas más antiguas. Las dos filas de 14 elementos en la parte inferior de la tabla periódica son los lantánidos y los actínidos, cuyas posiciones en la tabla periódica se indican en el grupo 3. Una descripción más completa de la tabla periódica se encuentra en el Capítulo 7.
Figura\(\PageIndex{1}\) La Tabla Periódica Mostrando los Elementos en Orden de Incrementar Z
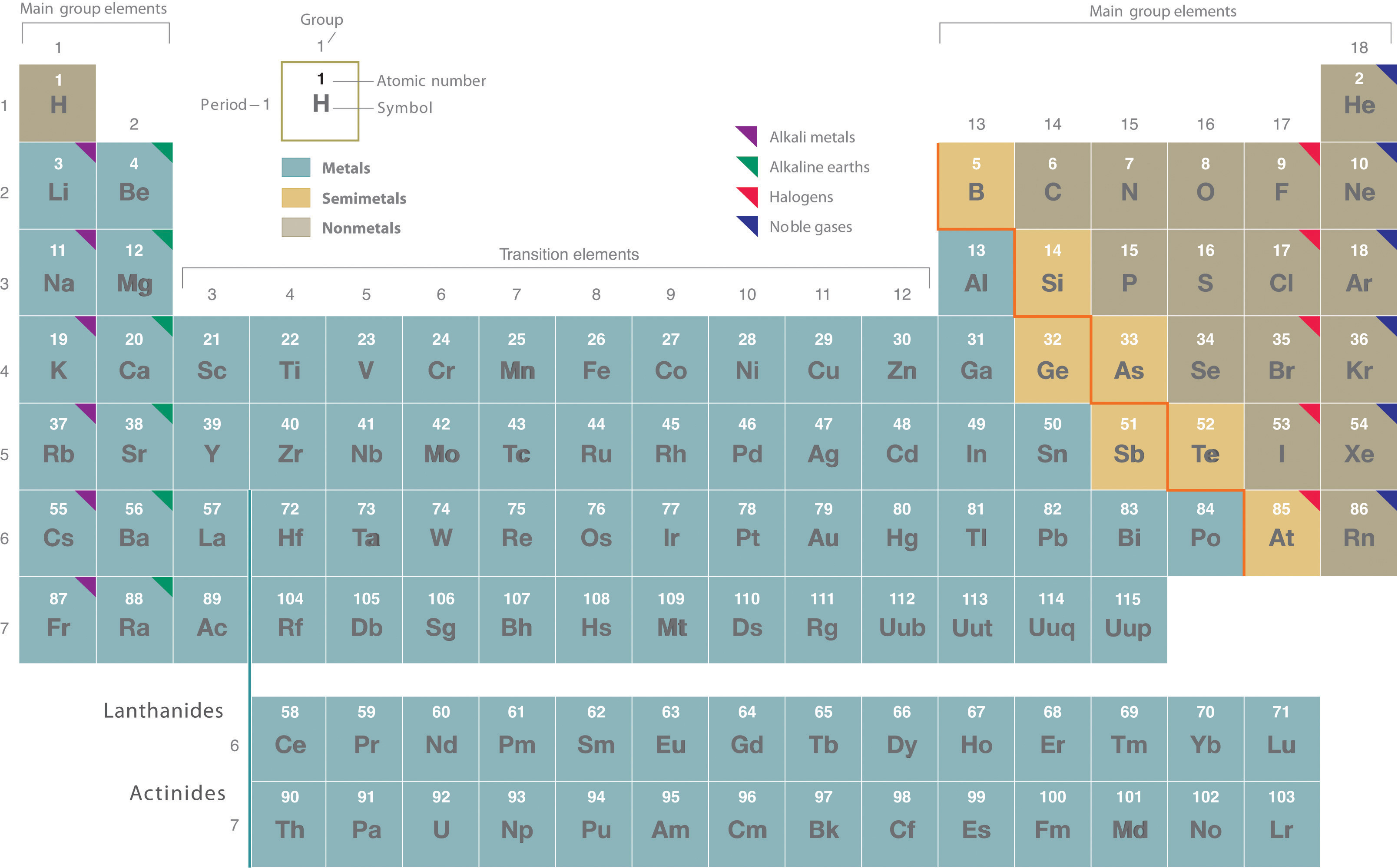
Los metales están en la parte inferior izquierda en la tabla periódica, y los no metales están en la parte superior derecha. Los semimetales se encuentran a lo largo de una línea diagonal que separa los metales y los no metales.
Metales, no metales y semimetales
La pesada línea en zigzag naranja que discurre diagonalmente de la parte superior izquierda a la inferior derecha a través de los grupos 13—16 in divide los elementos en metales (en azul, abajo y a la izquierda de la línea) y no metales (en bronce, arriba y a la derecha de la línea). Como cabría esperar, los elementos coloreados en oro que se encuentran a lo largo de la línea diagonal exhiben propiedades intermedias entre metales y no metales; se llaman semimetales.
La distinción entre metales y no metales es una de las más fundamentales en química. Los metales, como el cobre o el oro, son buenos conductores de electricidad y calor; se pueden meter en cables porque son dúctiles; se pueden martillar o prensar en láminas delgadas o láminas porque son maleables; y la mayoría tienen un aspecto brillante, por lo que son lustrosos. La gran mayoría de los elementos conocidos son metales. De los metales, solo el mercurio es un líquido a temperatura y presión ambiente; todo el resto son sólidos.
Los no metales, por el contrario, son generalmente conductores pobres de calor y electricidad y no son lustrosos. Los no metales pueden ser gases (como el cloro), líquidos (como el bromo) o sólidos (como el yodo) a temperatura y presión ambiente. La mayoría de los no metales sólidos son quebradizos, por lo que se rompen en trozos pequeños cuando se golpean con un martillo o se meten en un alambre. Como era de esperar, los semimetales exhiben propiedades intermedias entre metales y no metales.
Dado: elemento
Preguntado por: clasificación
Estrategia:
Encuentra selenio en la tabla periódica y luego clasifica el elemento según su ubicación.
Solución
El número atómico de selenio es 34, lo que lo ubica en el periodo 4 y el grupo 16. En selenio se encuentra arriba y a la derecha de la línea diagonal marcando el límite entre metales y no metales, por lo que debe ser un no metal. Obsérvese, sin embargo, que debido a que el selenio está cerca de la línea divisoria metal-no metálica, no sería sorprendente que el selenio fuera similar a un semimetal en algunas de sus propiedades.
Con base en su ubicación en la tabla periódica, ¿espera que el indio sea un no metal, un metal o un semimetal?
- Contestar
-
metal
Nombres Descriptivos
Como señalamos, la tabla periódica está dispuesta de manera que elementos con comportamientos químicos similares estén en el mismo grupo. Los químicos suelen hacer declaraciones generales sobre las propiedades de los elementos en un grupo utilizando nombres descriptivos con orígenes históricos. Por ejemplo, los elementos del grupo 1 se conocen como los metales alcalinos, el grupo 2 son los metales alcalinotérreos, el grupo 17 son los halógenos y el grupo 18 son los gases nobles.
Los Metales Alcalinos
Los metales alcalinos son litio, sodio, potasio, rubidio, cesio y francio. El hidrógeno es único ya que generalmente se coloca en el grupo 1, pero no es un metal.
Los compuestos de los metales alcalinos son comunes en la naturaleza y en la vida cotidiana. Un ejemplo es la sal de mesa (cloruro de sodio); los compuestos de litio se utilizan en grasas, en baterías y como medicamentos para tratar a pacientes que presentan comportamiento maníaco-depresivo o bipolar. Aunque el litio, el rubidio y el cesio son relativamente raros en la naturaleza, y el francio es tan inestable y altamente radiactivo que solo existe en pequeñas cantidades, el sodio y el potasio son los séptimo y octavo elementos más abundantes en la corteza terrestre, respectivamente.
Los metales alcalinotérreos
Los metales alcalinotérreos son berilio, magnesio, calcio, estroncio, bario y radio. El berilio, el estroncio y el bario son bastante raros, y el radio es inestable y altamente radiactivo. En contraste, el calcio y el magnesio son el quinto y sexto elementos más abundantes en la Tierra, respectivamente; se encuentran en enormes yacimientos de piedra caliza y otros minerales.
Los halógenos
Los halógenos son flúor, cloro, bromo, yodo y astatina. El nombre halógeno se deriva del griego para “formación de sal”, lo que refleja que todos los halógenos reaccionan fácilmente con los metales para formar compuestos, como el cloruro de sodio y el cloruro de calcio (utilizados en algunas áreas como sal de carretera).
Los compuestos que contienen el ion fluoruro se agregan a la pasta de dientes y al suministro de agua para prevenir las caries dentales. El flúor también se encuentra en los recubrimientos de teflón en utensilios de cocina. Si bien se cree que los propulsores y refrigerantes clorofluorocarbonados conducen al agotamiento de la capa de ozono de la Tierra y contienen tanto flúor como cloro, este último es responsable del efecto adverso sobre la capa de ozono. El bromo y el yodo son menos abundantes que el cloro, y la astatina es tan radiactiva que solo existe en cantidades insignificantes en la naturaleza.
Los Gases Noble
Los gases nobles son helio, neón, argón, kriptón, xenón y radón. Debido a que los gases nobles están compuestos de solo átomos individuales, son monatómicos. A temperatura y presión ambiente, son gases no reactivos. Por su falta de reactividad, durante muchos años se les llamó gases inertes o gases raros. Sin embargo, los primeros compuestos químicos que contenían los gases nobles se prepararon en 1962. Aunque los gases nobles son constituyentes relativamente menores de la atmósfera, el gas natural contiene cantidades sustanciales de helio. Debido a su baja reactividad, el argón se utiliza a menudo como una atmósfera no reactiva (inerte) para soldadura y en bombillas. La luz roja emitida por el neón en un tubo de descarga de gas se utiliza en las luces de neón.
Tenga en cuenta el patrón
Los gases nobles no son reactivos a temperatura y presión ambiente.
Resumen
La tabla periódica es una disposición de los elementos en orden de aumento del número atómico. Los elementos que exhiben química similar aparecen en columnas verticales llamadas grupos (numerados del 1 al 18 de izquierda a derecha); las siete filas horizontales se denominan períodos. Algunos de los grupos tienen nombres comunes ampliamente utilizados, incluyendo los metales alcalinos (grupo 1) y los metales alcalinotérreos (grupo 2) en el extremo izquierdo, y los halógenos (grupo 17) y los gases nobles (grupo 18) en el extremo derecho. Los elementos se pueden dividir ampliamente en metales, no metales y semimetales. Los semimetales presentan propiedades intermedias entre las de metales y no metales. Los metales se encuentran a la izquierda de la tabla periódica, y los no metales se encuentran en la parte superior derecha. Están separados por una banda diagonal de semimetales. Los metales son brillantes, buenos conductores de electricidad y fácilmente conformados (son dúctiles y maleables), mientras que los no metales sólidos son generalmente conductores eléctricos quebradizos y pobres. Otras agrupaciones importantes de elementos en la tabla periódica son los elementos del grupo principal, los metales de transición, los lantánidos y los actínidos.
LLAVE PARA LLEVAR
- La tabla periódica se utiliza como herramienta predictiva.
PROBLEMAS CONCEPTUALES
- Clasifique cada elemento en el Problema Conceptual 1 (Sección 1.7) como un metal, un no metal o un semimetal. Si es un metal, indique si es un metal alcalino, un metal alcalinotérreo o un metal de transición.
- Clasifique cada elemento en el Problema Conceptual 2 (Sección 1.7) como un metal, un no metal o un semimetal. Si es un metal, indique si es un metal alcalino, un metal alcalinotérreo o un metal de transición.
- Clasifique cada elemento como un metal, un semimetal o un no metal. Si es un metal, indique si es un metal alcalino, un metal alcalinotérreo o un metal de transición.
- hierro
- tantalio
- azufre
- silicio
- cloro
- níquel
- potasio
- radón
- circonio
- ¿Cuáles de estos conjuntos de elementos están todos en el mismo periodo?
- potasio, vanadio y rutenio
- litio, carbono y cloro
- sodio, magnesio y azufre
- cromo, níquel y kriptón
- ¿Cuáles de estos conjuntos de elementos están todos en el mismo periodo?
- bario, tungsteno y argón
- itrio, circonio y selenio
- potasio, calcio y zinc
- Escandio, bromo y manganeso
- ¿Cuáles de estos conjuntos de elementos están todos en el mismo grupo?
- sodio, rubidio y bario
- nitrógeno, fósforo y bismuto
- cobre, plata y oro
- magnesio, estroncio y samario
- ¿Cuáles de estos conjuntos de elementos están todos en el mismo grupo?
- hierro, rutenio y osmio
- níquel, paladio y plomo
- yodo, flúor y oxígeno
- boro, aluminio y galio
- Indique si cada elemento es un metal de transición, un halógeno o un gas noble.
- manganeso
- iridio
- flúor
- xenón
- litio
- carbono
- zinc
- sodio
- tantalio
- hafnio
- antimonio
- cadmio
- ¿Cuál de los elementos indicados en color en la tabla periódica que se muestra a continuación es más probable que exista como gas monoatómico? ¿Como gas diatómico? ¿Cuál es más probable que sea un semimetal? ¿Un metal reactivo?
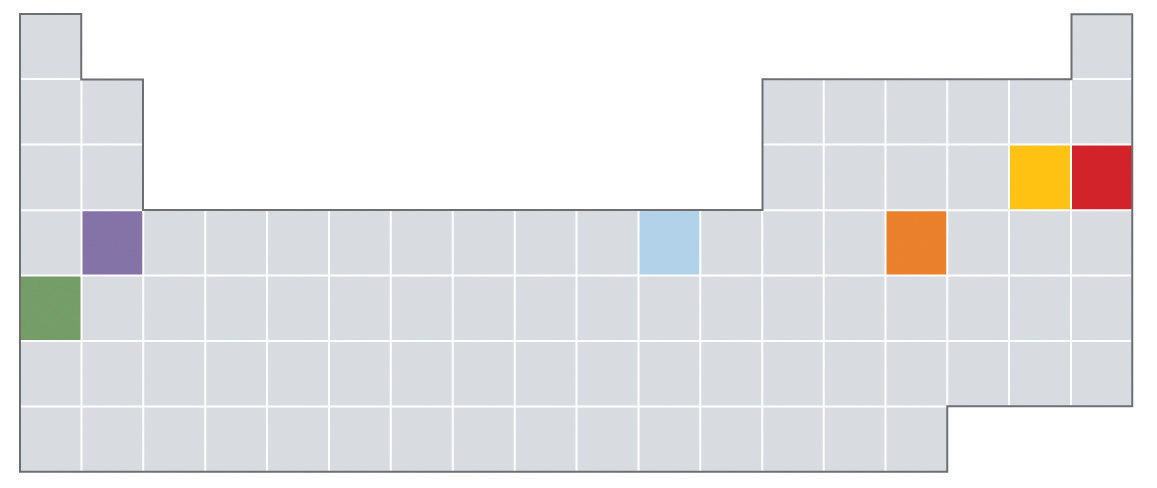
- Con base en sus ubicaciones en la tabla periódica, ¿esperaría que estos elementos fueran maleables? ¿Por qué o por qué no?
- fósforo
- cromo
- rubidio
- cobre
- aluminio
- bismuto
- neodimio
- Con base en sus ubicaciones en la tabla periódica, ¿esperaría que estos elementos fueran lustrosos? ¿Por qué o por qué no?
- azufre
- vanadio
- níquel
- arsénico
- estroncio
- cerio
- sodio
Contestar
-
Símbolo Tipo Fe metal: metal de transición Ta metal: metal de transición S no metálico Si semimetal Cl no metálico (halógeno) Ni metal: metal de transición K metal: metal alcalino Rn no metálico (gas noble) Zr metal: metal de transición


