2.2: Fórmulas Químicas
- Page ID
- 78309
- Describir la composición de un compuesto químico.
Cuando los químicos sintetizan un nuevo compuesto, es posible que aún no conozcan su fórmula molecular o estructural. En tales casos, suelen comenzar por determinar su fórmula empírica, los números relativos de átomos de los elementos en un compuesto, reducidos a los números enteros más pequeños. Debido a que la fórmula empírica se basa en mediciones experimentales de los números de átomos en una muestra del compuesto, solo muestra las proporciones de los números de los elementos presentes. La diferencia entre fórmulas empíricas y moleculares se puede ilustrar con butano, un compuesto covalente utilizado como combustible en encendedores desechables. La fórmula molecular para butano es C 4 H 10. La relación de átomos de carbono a átomos de hidrógeno en butano es 4:10, que puede reducirse a 2:5. La fórmula empírica para butano es, por lo tanto, C 2 H 5. La unidad de fórmula es el agrupamiento absoluto de átomos o iones representados por la fórmula empírica de un compuesto, ya sea iónico o covalente. El butano, por ejemplo, tiene la fórmula empírica C 2 H 5, pero contiene dos unidades de fórmula C 2 H 5, dando una fórmula molecular de C 4 H 10.
Debido a que los compuestos iónicos no contienen moléculas discretas, se utilizan fórmulas empíricas para indicar sus composiciones. Todos los compuestos, sean iónicos o covalentes, deben ser eléctricamente neutros. En consecuencia, los cargos positivos y negativos en una unidad de fórmula deben cancelarse exactamente entre sí. Si el catión y el anión tienen cargas de igual magnitud, como Na + y Cl −, entonces el compuesto debe tener una relación 1:1 de cationes a aniones, y la fórmula empírica debe ser NaCl. Si las cargas no son de la misma magnitud, entonces se necesita una relación catión:anión distinta de 1:1 para producir un compuesto neutro. En el caso de Mg 2+ y Cl −, por ejemplo, se necesitan dos iones Cl − para equilibrar las dos cargas positivas en cada ion Mg 2+, dando una fórmula empírica de MgCl 2. De manera similar, la fórmula para el compuesto iónico que contiene iones Na + y O2- es Na 2 O.
Tenga en cuenta el patrón
Los compuestos iónicos no contienen moléculas discretas, por lo que se utilizan fórmulas empíricas para indicar sus composiciones.
Compuestos iónicos binarios
Un compuesto iónico que contiene solo dos elementos, uno presente como catión y otro como anión, se denomina compuesto iónico binario. Un ejemplo es MgCl 2, un coagulante utilizado en la preparación de tofu a partir de soja. Para los compuestos iónicos binarios, los subíndices en la fórmula empírica también se pueden obtener cruzando cargas: usar el valor absoluto de la carga en un ion como subíndice para el otro ión. Este método se muestra esquemáticamente como sigue:
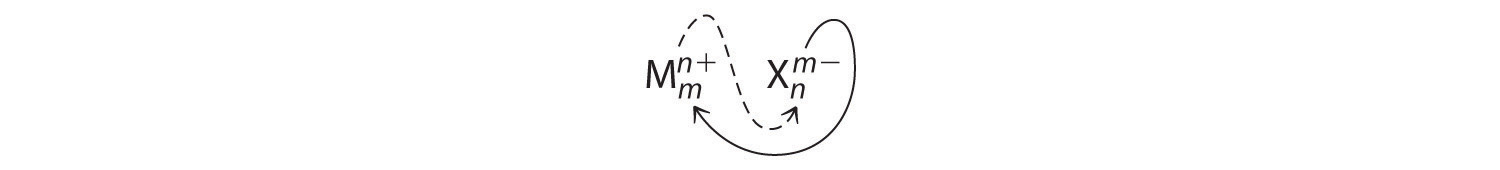
Cargos de cruce. Un método para obtener subíndices en la fórmula empírica es cruzando cargas.
Al cruzar cargas, a veces te resultará necesario reducir los subíndices a su relación más simple para escribir la fórmula empírica. Consideremos, por ejemplo, el compuesto formado por Mg 2+ y O 2−. El uso de los valores absolutos de las cargas en los iones como subíndices da la fórmula Mg 2 O 2:
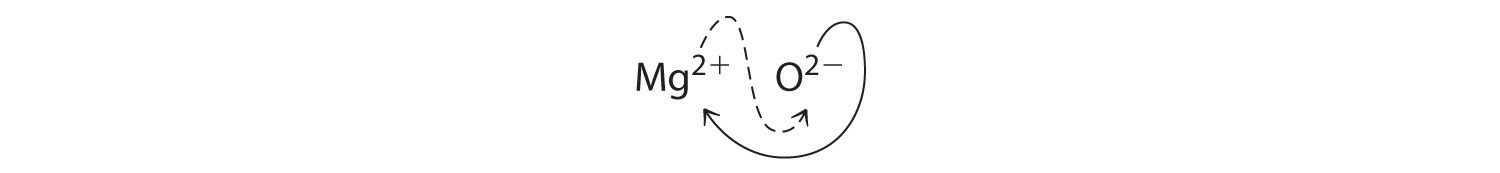
Esto simplifica a su correcta fórmula empírica MgO. La fórmula empírica tiene un ion Mg 2+ y un ion O 2−.
- Ga 3+ y As 3−
- Eu 3+ y O 2−
- calcio y cloro
Dado: iones o elementos
Preguntado por: fórmula empírica para compuesto iónico binario
Estrategia:
A Si no se dan, determinar las cargas iónicas con base en la ubicación de los elementos en la tabla periódica.
B Usar el valor absoluto de la carga en cada ion como subíndice para el otro ion. Reducir los subíndices a los números más bajos para escribir la fórmula empírica. Verifique para asegurarse de que la fórmula empírica es eléctricamente neutra.
Solución
- B El uso de los valores absolutos de las cargas en los iones como subíndices da Ga 3 As 3:
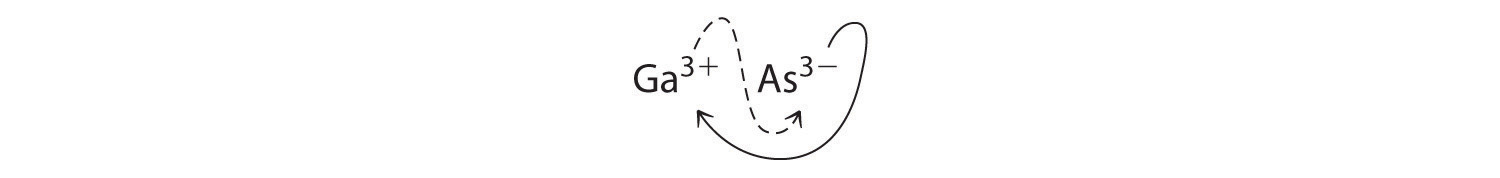
Reducir los subíndices a los números enteros más pequeños da la fórmula empírica GaAs, que es eléctricamente neutra [+3 + (−3) = 0]. Alternativamente, podríamos reconocer que Ga 3+ y As 3− tienen cargas de igual magnitud pero signos opuestos. Un ion Ga 3+ equilibra la carga en un ion As 3−, y un compuesto 1:1 no tendrá carga neta. Debido a que escribimos subíndices solo si el número es mayor que 1, la fórmula empírica es GaAs. GaAs es arseniuro de galio, que es ampliamente utilizado en la industria electrónica en transistores y otros dispositivos.
- B Debido a que Eu 3+ tiene una carga de +3 y O 2− tiene una carga de −2, un compuesto 1:1 tendría una carga neta de +1. Por lo tanto, debemos encontrar múltiplos de los cargos que cancelan. Cruzamos cargas, usando el valor absoluto de la carga en un ion como subíndice para el otro ion:
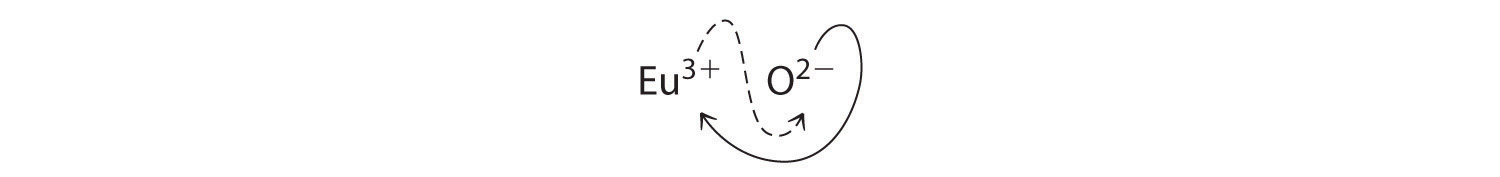
El subíndice para Eu 3+ es 2 (de O 2−), y el subíndice para O 2− es 3 (de Eu 3+), dando Eu 2 O 3; los subíndices no pueden reducirse más. La fórmula empírica contiene una carga positiva de 2 (+3) = +6 y una carga negativa de 3 (−2) = −6, para una carga neta de 0. El compuesto Eu 2 O 3 es neutro. El óxido de europio es responsable del color rojo en las pantallas de televisión y computadoras.
- A Debido a que no se dan las cargas sobre los iones, primero debemos determinar las cargas esperadas para los iones más comunes derivados del calcio y el cloro. El calcio se encuentra en el grupo 2, por lo que debería perder dos electrones para formar Ca 2+. El cloro se encuentra en el grupo 17, por lo que debe ganar un electrón para formar Cl −.
B Dos iones Cl − son necesarios para equilibrar la carga en un ion Ca 2+, lo que conduce a la fórmula empírica CaCl 2. También podríamos cruzar cargas, usando el valor absoluto de la carga en Ca 2+ como subíndice para Cl y el valor absoluto de la carga en Cl − como subíndice para Ca:
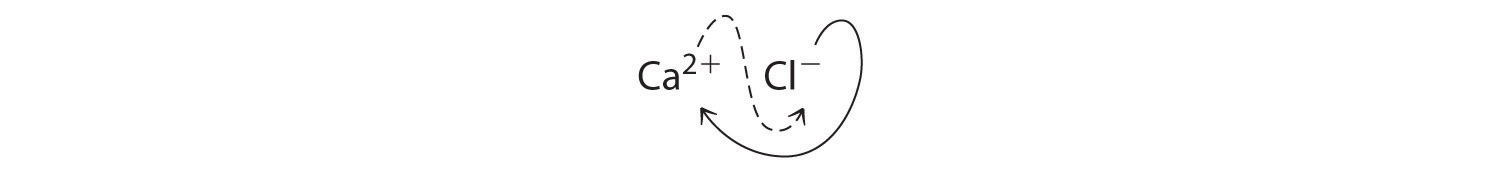
Los subíndices en CaCl 2 no se pueden reducir aún más. La fórmula empírica es eléctricamente neutra [+2 + 2 (−1) = 0]. Este compuesto es el cloruro de calcio, una de las sustancias utilizadas como “sal” para derretir el hielo en carreteras y aceras en invierno.
Escriba la fórmula empírica para el compuesto iónico binario más simple formado a partir de cada ion o par de elementos.
- Li + y N 3−
- Al 3+ y O 2−
- litio y oxígeno
- Contestar
-
- Li 3 N
- Al 2 O 3
- Li 2 O
Iones Poliatómicos
Los iones poliatómicos son grupos de átomos que llevan una carga eléctrica neta, aunque los átomos en un ion poliatómico se mantienen unidos por los mismos enlaces covalentes que mantienen a los átomos unidos en moléculas. Así como hay muchos más tipos de moléculas que elementos simples, hay muchos más tipos de iones poliatómicos que iones monoatómicos. Dos ejemplos de cationes poliatómicos son los iones amonio (NH 4 +) y metilamonio (CH 3 NH 3 +). Los aniones poliatómicos son mucho más numerosos que los cationes poliatómicos; algunos ejemplos comunes están en la Tabla\(\PageIndex{1}\).
Tabla Iones poliatómicos\(\PageIndex{1}\) comunes y sus nombres
| Fórmula | Nombre de Ion |
|---|---|
| NH 4 + | amonio |
| CH 3 NH 3 + | metilamonio |
| OH − | hidróxido |
| O 2 2− | peróxido |
| CN − | cianuro |
| SCN - | tiocianato |
| NO 2 − | nitrito |
| NO 3 − | nitrato |
| CO 3 2− | carbonato |
| HCO 3 − | carbonato de hidrógeno o bicarbonato |
| SO 3 2− | sulfito |
| SO 4 2− | sulfato |
| HSO 4 − | sulfato de hidrógeno o bisulfato |
| PO 4 3− | fosfato |
| HPO 4 2− | fosfato de hidrógeno |
| H 2 PO 4 − | fosfato de dihidrógeno |
| ClO − | hipoclorito |
| ClO 2 − | clorito |
| ClO 3 − | clorato |
| ClO 4 − | perclorato |
| MnO 4 - | permanganato |
| CrO 4 2− | cromato |
| Cr 2 O 7 2− | dicromato |
| C 2 O 4 2− | oxalato |
| HCO 2 − | formiato |
| CH 3 CO 2 − | acetato |
| C 6 H 5 CO 2 − | benzoato |
El método que utilizamos para predecir las fórmulas empíricas para compuestos iónicos que contienen iones monoatómicos también se puede utilizar para compuestos que contienen iones poliatómicos. La carga general sobre los cationes debe equilibrar la carga general sobre los aniones en la unidad de fórmula. Así, los iones K + y NO 3 − se combinan en una proporción 1:1 para formar KNO 3 (nitrato de potasio o salitre), un ingrediente principal de la pólvora negra. De igual manera, Ca 2+ y SO 4 2− forman CaSO 4 (sulfato de calcio), que se combina con cantidades variables de agua para formar yeso y yeso de París. Los iones poliatómicos NH 4 + y NO 3 − forman NH 4 NO 3 (nitrato amónico), que es un fertilizante ampliamente utilizado y, en las manos equivocadas, un explosivo. Un ejemplo de un compuesto en el que los iones tienen cargas de diferentes magnitudes es el fosfato de calcio, el cual está compuesto por iones Ca 2+ y PO 4 3−; es un componente importante de los huesos. El compuesto es eléctricamente neutro porque los iones se combinan en una proporción de tres iones Ca 2+ [3 (+2) = +6] por cada dos iones [2 (−3) = −6], dando una fórmula empírica de Ca 3 (PO 4) 2; los paréntesis alrededor de PO 4 en la fórmula empírica indican que es un ion poliatómico. Escribir la fórmula para el fosfato de calcio como Ca 3 P 2 O 8 da el número correcto de cada átomo en la unidad de fórmula, pero oscurece el hecho de que el compuesto contiene iones PO 4 3− fácilmente identificables.
Escriba la fórmula empírica para el compuesto formado a partir de cada par iónico.
- Na + y HPO 4 2−
- catión potasio y anión cianuro
- catión calcio y anión hipoclorito
Dado: iones
Preguntado por: fórmula empírica para compuesto iónico
Estrategia:
A Si no se da, determinar la carga sobre un ion monatómico desde su ubicación en la tabla periódica. Utilice la Tabla 2.4 para encontrar la carga en un ion poliatómico.
B Usar el valor absoluto de la carga en cada ion como subíndice para el otro ion. Reducir los subíndices a los números enteros más pequeños al escribir la fórmula empírica.
Solución
- B Debido a que HPO 4 2− tiene una carga de −2 y Na + tiene una carga de +1, la fórmula empírica requiere dos iones Na + para equilibrar la carga del ion poliatómico, dando Na 2 HPO 4. Los subíndices se reducen a los números más bajos, por lo que la fórmula empírica es Na 2 HPO 4. Este compuesto es hidrogenofosfato de sodio, que se utiliza para proporcionar textura en quesos procesados, pudines y desayunos instantáneos.
- A El catión potasio es K +, y el anión cianuro es CN −. B Debido a que la magnitud de la carga en cada ion es la misma, la fórmula empírica es KCN. El cianuro de potasio es altamente tóxico, y en un momento se utilizó como veneno para ratas. Este uso ha sido descontinuado, sin embargo, debido a que demasiadas personas estaban siendo envenenadas accidentalmente.
- A El catión calcio es Ca 2+, y el anión hipoclorito es ClO −. B Se necesitan dos iones ClO − para equilibrar la carga en un ion Ca 2+, dando Ca (ClO) 2. Los subíndices no se pueden reducir aún más, por lo que la fórmula empírica es Ca (ClO) 2. Se trata del hipoclorito de calcio, el “cloro” utilizado para purificar el agua en las piscinas.
Escriba la fórmula empírica para el compuesto formado a partir de cada par iónico.
- Ca 2+ y H 2 PO 4 −
- catión de sodio y anión bicarbonato
- catión amónico y anión sulfato
- Ca (H 2 PO 4) 2: el dihidrogenofosfato de calcio es uno de los ingredientes en la levadura en polvo.
- NaHCO 3: el bicarbonato de sodio se encuentra en los antiácidos y el polvo de hornear; en forma pura, se vende como bicarbonato de sodio.
- (NH 4) 2 SO 4: el sulfato amónico es una fuente común de nitrógeno en los fertilizantes.
- Contestar
Hidratos
Muchos compuestos iónicos se presentan como hidratos, compuestos que contienen proporciones específicas de moléculas de agua poco unidas, llamadas aguas de hidratación. Las aguas de hidratación a menudo se pueden eliminar simplemente calentando. Por ejemplo, el dihidrogenofosfato de calcio puede formar un sólido que contiene una molécula de agua por unidad de Ca (H 2 PO 4) 2 y se utiliza como agente leudante en la industria alimentaria para hacer que los productos horneados aumenten. La fórmula empírica para el sólido es Ca (H 2 PO 4) 2 ·H 2 O. En contraste, el sulfato de cobre generalmente forma un sólido azul que contiene cinco aguas de hidratación por unidad de fórmula, con la fórmula empírica CuSO 4 ·5H 2 O. Cuando calentado, las cinco moléculas de agua se pierden, dando un sólido blanco con la fórmula empírica CuSO 4 (Figura 2.9).
Pérdida de Agua de un Hidrato con Calefacción
Cuando se calienta el CuSO azul 4·5H 2 O, se pierden dos moléculas de agua a 30°C, dos más a 110°C y la última a 250°C para dar CuSO 4 blanco.
Los compuestos que difieren sólo en el número de aguas de hidratación pueden tener propiedades muy diferentes. Por ejemplo, CaSO 4 ·½H 2 O es yeso de París, que a menudo se usaba para hacer moldes robustos para brazos o piernas rotos, mientras que CaSO 4 ·2H 2 O es el yeso menos denso y escamoso, un mineral utilizado en paneles de yeso para la construcción de viviendas. Cuando un molde se fraguaría, una mezcla de yeso de París y agua cristalizó para dar CaSO sólido 4 ·2H 2 O. Se utilizan procesos similares en el fraguado de cemento y concreto.
Resumen
Una fórmula empírica da los números relativos de átomos de los elementos en un compuesto, reducidos a los números enteros más bajos. La unidad de fórmula es el agrupamiento absoluto representado por la fórmula empírica de un compuesto, ya sea iónico o covalente. Las fórmulas empíricas son particularmente útiles para describir la composición de compuestos iónicos, que no contienen moléculas fácilmente identificables. Algunos compuestos iónicos se presentan como hidratos, que contienen proporciones específicas de moléculas de agua poco unidas llamadas aguas de hidratación.
LLAVE PARA LLEVAR
- La composición de un compuesto está representada por una fórmula empírica o molecular, cada una de las cuales consiste en al menos una unidad de fórmula.
PROBLEMAS CONCEPTUALES
- ¿Cuáles son las diferencias y similitudes entre un ión poliatómico y una molécula?
- Clasificar cada compuesto como iónico o covalente.
- Zn 3 (PO 4) 2
- C 6 H 5 CO 2 H
- K 2 Cr 2 O 7
- CH 3 CH 2 SH
- NH 4 Br
- CCl 2 F 2
- Clasificar cada compuesto como iónico o covalente. ¿Cuáles son los compuestos orgánicos y cuáles son los compuestos inorgánicos?
- CH 3 CH 2 CO 2 H
- CaCl 2
- Y (NO 3) 3
- H 2 S
- NaC 2 H 3 O 2
- Generalmente, no se puede determinar la fórmula molecular directamente a partir de una fórmula empírica. ¿Qué otra información se necesita?
- Dar dos piezas de información que obtenemos de una fórmula estructural que no podemos obtener de una fórmula empírica.
- Las fórmulas de los alcoholes a menudo se escriben como ROH más que como fórmulas empíricas. Por ejemplo, el metanol generalmente se escribe como CH 3 OH en lugar de CH 4 O. Explique por qué se prefiere la notación ROH.
- El compuesto sulfuro de dimetilo tiene la fórmula empírica C 2 H 6 S y la fórmula estructural CH 3 SCH 3. ¿Qué información obtenemos de la fórmula estructural que no obtenemos de la fórmula empírica? Escriba la fórmula estructural condensada para el compuesto.
- ¿Cuál es la fórmula correcta para el hidróxido de magnesio—MgOH 2 o Mg (OH) 2? ¿Por qué?
- El cianuro de magnesio se escribe como Mg (CN) 2, no MgCN 2. ¿Por qué?
- ¿Un hidrato dado siempre contiene el mismo número de aguas de hidratación?
Responder
- La fórmula estructural nos da la conectividad de los átomos en la molécula o ion, así como una representación esquemática de su disposición en el espacio. Las fórmulas empíricas nos dicen solo las proporciones de los átomos presentes. La fórmula estructural condensada del sulfuro de dimetilo es (CH 3) 2 S.
PROBLEMAS NUMÉRICOS
- Escribe la fórmula para cada compuesto.
- sulfato de magnesio, que tiene 1 átomo de magnesio, 4 átomos de oxígeno y 1 átomo de azufre
- etilenglicol (anticongelante), que tiene 6 átomos de hidrógeno, 2 átomos de carbono y 2 átomos de oxígeno
- ácido acético, que tiene 2 átomos de oxígeno, 2 átomos de carbono y 4 átomos de hidrógeno
- clorato de potasio, que tiene 1 átomo de cloro, 1 átomo de potasio y 3 átomos de oxígeno
- hipoclorito de sodio pentahidratado, que tiene 1 átomo de cloro, 1 átomo de sodio, 6 átomos de oxígeno y 10 átomos de hidrógeno
- Escribe la fórmula para cada compuesto.
- acetato de cadmio, que tiene 1 átomo de cadmio, 4 átomos de oxígeno, 4 átomos de carbono y 6 átomos de hidrógeno
- cianuro de bario, que tiene 1 átomo de bario, 2 átomos de carbono y 2 átomos de nitrógeno
- dihidrato de fosfato de hierro (III), que tiene 1 átomo de hierro, 1 átomo de fósforo, 6 átomos de oxígeno y 4 átomos de hidrógeno
- nitrato de manganeso (II) hexahidratado, que tiene 1 átomo de manganeso, 12 átomos de hidrógeno, 12 átomos de oxígeno y 2 átomos de nitrógeno
- fosfato de plata, que tiene 1 átomo de fósforo, 3 átomos de plata y 4 átomos de oxígeno
- Complete la siguiente tabla rellenando la fórmula para el compuesto iónico formado por cada par catión-anión.
Ion K + Fe 3+ NH 4 + Ba 2+ Cl − KCl SO 4 2− PO 4 3− NO 3 − OH − - Escribir la fórmula empírica para el compuesto binario formado por los iones monatómicos más comunes formados por cada par de elementos.
- zinc y azufre
- bario y yodo
- magnesio y cloro
- silicio y oxígeno
- sodio y azufre
- Escribir la fórmula empírica para el compuesto binario formado por los iones monatómicos más comunes formados por cada par de elementos.
- litio y nitrógeno
- cesio y cloro
- germanio y oxígeno
- rubidio y azufre
- arsénico y sodio
- Escriba la fórmula empírica para cada compuesto.
- Na 2 S 2 O 4
- B 2 H 6
- C 6 H 12 O 6
- P 4 O 10
- KMnO
- Escriba la fórmula empírica para cada compuesto.
- Al 2 Cl 6
- K 2 Cr 2 O 7
- C 2 H 4
- (NH 2) 2 CNH
- CH 3 COOH
RESPUESTAS
-
- MgSO 4
- C 2 H 6 O 2
- C 2 H 4 O 2
- KClO 3
- Naocl·5h 2 O
-
Ion K + Fe 3+ NH 4 + Ba 2+ Cl − KCl FeCl 3 NH 4 Cl BacL SO 4 2− K 2 SO 4 Fe 2 (SO 4) 3 (NH 4) 2 SO 4 BaSO 4 PO 4 3− K 3 PO 4 FePO 4 (NH 4) 3 PO 4 Ba 3 (PO 4) 2 NO 3 − KNO Fe (NO 3) 3 NH 4 NO 3 Ba (NO 3) 2 OH − KOH Fe (OH) 3 NH 4 OH Ba (OH) 2 -
- Li 3 N
- CsCl
- GeO 2
- Rb 2 S
- Na 3 As
-
- AlCl 3
- K 2 Cr 2 O 7
- CH 2
- CH 5 N 3
- CH 2 O


