2.3: Nombrar compuestos iónicos
- Page ID
- 78311
- Para nombrar compuestos iónicos.
Las fórmulas empíricas y moleculares discutidas en el apartado anterior son precisas y altamente informativas, pero presentan algunas desventajas. Primero, son inconvenientes para la comunicación verbal rutinaria. Por ejemplo, decir “C-a-tres-p-o-cuatro-dos” para Ca 3 (PO 4) 2 es mucho más difícil que decir “fosfato de calcio”. Además, verá en la Sección 2.4 que muchos compuestos tienen las mismas fórmulas empíricas y moleculares pero diferentes arreglos de átomos, lo que resulta en propiedades químicas y físicas muy diferentes. En tales casos, es necesario que los compuestos tengan diferentes nombres que distingan entre los posibles arreglos.
Muchos compuestos, particularmente aquellos que se conocen desde hace relativamente largo tiempo, tienen más de un nombre: un nombre común (a veces más de uno) y un nombre sistemático, que es el nombre asignado al adherirse a reglas específicas. Al igual que los nombres de la mayoría de los elementos, los nombres comunes de los compuestos químicos generalmente tienen orígenes históricos, aunque a menudo parecen no estar relacionados con los compuestos de interés. Por ejemplo, el nombre sistemático para KNO 3 es nitrato de potasio, pero su nombre común es salitre.
En este texto, utilizamos una nomenclatura sistemática para asignar nombres significativos a los millones de sustancias conocidas. Desafortunadamente, algunos químicos que son ampliamente utilizados en el comercio y la industria todavía se conocen casi exclusivamente por sus nombres comunes; en tales casos, debe estar familiarizado con el nombre común así como el sistemático. El objetivo de esta y de las dos secciones siguientes es enseñarle a escribir la fórmula para un compuesto inorgánico simple a partir de su nombre, y viceversa, y presentarle algunos de los nombres comunes más frecuentes.
Comenzamos con compuestos iónicos binarios, que contienen sólo dos elementos. El procedimiento para nombrar tales compuestos se describe en la Figura\(\PageIndex{1}\) y utiliza las siguientes etapas:
Figura\(\PageIndex{1}\) Nombrando un Compuesto Iónico
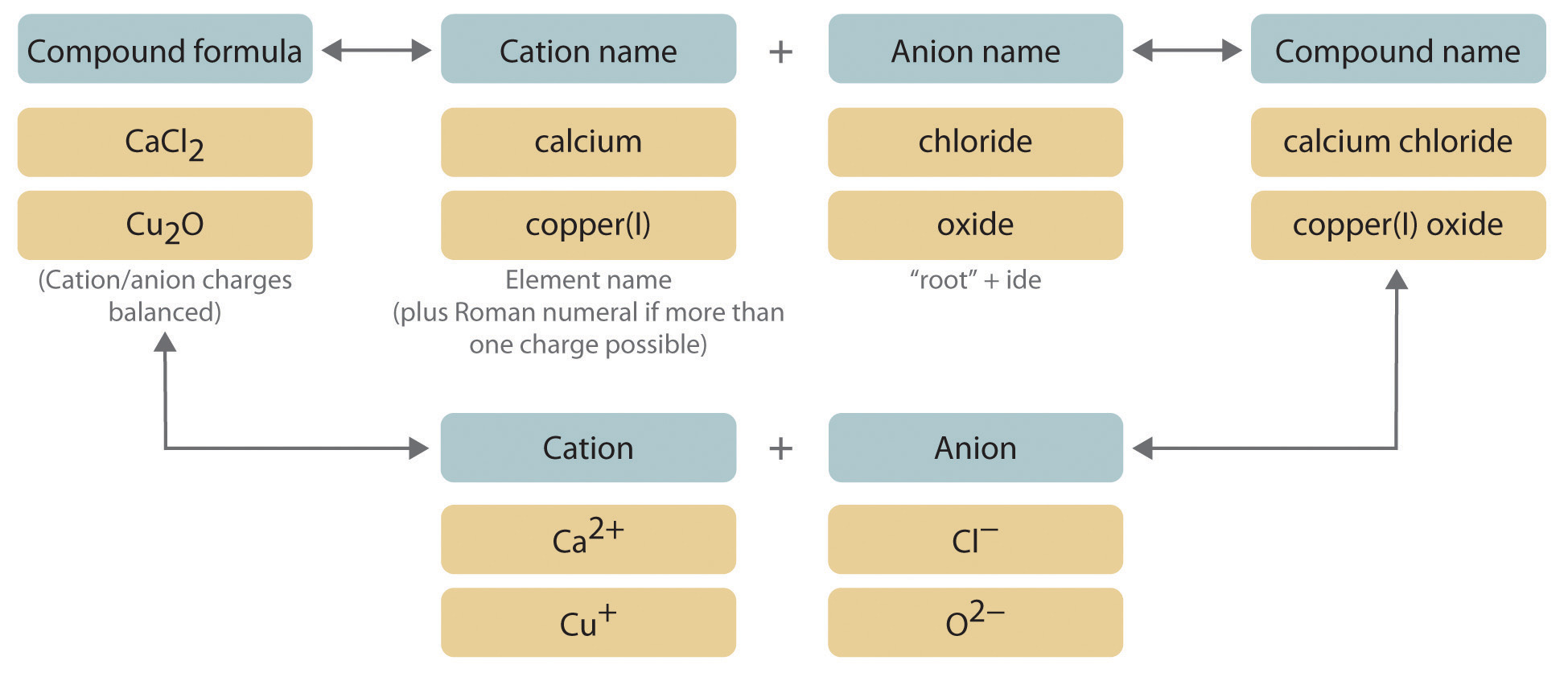
- Colocar los iones en su orden apropiado: catión y luego anión.
- Nombra el catión.
- Metales que forman un solo catión. Como se señala en la Sección 2.1, estos metales suelen estar en los grupos 1—3, 12 y 13. El nombre del catión de un metal que forma solo un catión es el mismo que el nombre del metal (con la palabra ion añadida si el catión es por sí mismo). Por ejemplo, Na + es el ion sodio, Ca 2+ es el ion calcio y Al 3+ es el ion aluminio.
- Metales que forman más de un catión. Como se muestra en la Figura\(\PageIndex{2}\), muchos metales pueden formar más de un catión. Este comportamiento se observa para la mayoría de los metales de transición, muchos actínidos y los elementos más pesados de los grupos 13—15. En tales casos, la carga positiva sobre el metal se indica con un número romano entre paréntesis inmediatamente después del nombre del metal. Así Cu + es cobre (I) (leído como “cobre uno”), Fe 2+ es hierro (II), Fe 3+ es hierro (III), Sn 2+ es estaño (II) y Sn 4+ es estaño (IV).
Sin embargo, todavía se usa ampliamente un sistema antiguo de nomenclatura para tales cationes. El nombre del catión con la carga superior se forma a partir de la raíz del nombre latino del elemento con el sufijo - ic adjunto, y el nombre del catión con la carga inferior tiene la misma raíz con el sufijo - ous. Los nombres de Fe 3+, Fe 2+, Sn 4+ y Sn 2+ son por lo tanto férrico, ferroso, tánico y estañoso, respectivamente. A pesar de que este texto utiliza los nombres sistemáticos con números romanos, deberías ser capaz de reconocer estos nombres comunes porque todavía se usan a menudo. Por ejemplo, en la etiqueta del enjuague con flúor de su dentista, el compuesto químico llamado fluoruro de estaño (II) generalmente aparece como fluoruro estañoso.
Algunos ejemplos de metales que forman más de un catión están en la Tabla\(\PageIndex{1}\) junto con los nombres de los iones. Tenga en cuenta que el simple catión Hg + no ocurre en compuestos químicos. En cambio, todos los compuestos de mercurio (I) contienen un catión dimérico, Hg 2 2+, en el que los dos átomos de Hg están unidos entre sí.
Tabla Cationes\(\PageIndex{1}\) comunes de metales que forman más de un ion
Catión Nombre Sistemático Nombre común Catión Nombre Sistemático Nombre común Cr 2+ cromo (II) cromático Cu 2+ cobre (II) cúprico Cr 3+ cromo (III) crómico Cu + cobre (I) cuproso Mn 2+ manganeso (II) manganoso* Hg 2+ mercurio (II) mercúrico Mn 3+ manganeso (III) manganica* Hg 2 2+ mercurio (I) mercuroso† Fe 2+ hierro (II) ferroso Sn 4+ estaño (IV) estánnico Fe 3+ hierro (III) férrico Sn 2+ estaño (II) estañoso Co 2+ cobalto (II) cobaltos* Pb 4+ plomo (IV) plomería* Co 3+ cobalto (III) cobalto* Pb 2+ plomo (II) plomero* * No ampliamente utilizado. † El ion mercurio (I) aislado existe solo como ión gaseoso. - Cationes poliatómicos. Los nombres de los cationes poliatómicos comunes que son relativamente importantes en los compuestos iónicos (como, el ión amonio) están en la Tabla 2.4.
- Nombra el anión.
- Aniones monatómicos. Los aniones monatómicos se nombran agregando el sufijo - ide a la raíz del nombre del elemento padre; así, Cl − es cloruro, O 2− es óxido, P3− es fosfuro, N 3− es nitruro (también llamado azida) y C 4− es carburo. Debido a que las cargas sobre estos iones pueden predecirse a partir de su posición en la tabla periódica, no es necesario especificar la carga en el nombre. Ejemplos de aniones monatómicos están en
- Aniones poliatómicos. Los aniones poliatómicos suelen tener nombres comunes que debes aprender; algunos ejemplos están en la Tabla 2.4. Los aniones poliatómicos que contienen un solo átomo metálico o no metálico más uno o más átomos de oxígeno se denominan oxoaniones (u oxianiones). En los casos en que solo se conocen dos oxoaniones por un elemento, el nombre del oxoanión con más átomos de oxígeno termina en - comió, y el nombre del oxoanión con menos átomos de oxígeno termina en - ite. Por ejemplo, NO 3− es nitrato y NO 2− es nitrito.
Los halógenos y algunos de los metales de transición forman series más extensas de oxoaniones con hasta cuatro miembros. En los nombres de estos oxoaniones, el prefijo per - se usa para identificar el oxoanión con más oxígeno (de manera que ClO 4 − es perclorato y ClO 3 − es clorato), y el prefijo hipo - se usa para identificar el anión con menor cantidad de oxígeno (ClO 2 − es clorito y ClO − es hipoclorito). La relación entre los nombres de oxoaniones y el número de átomos de oxígeno presentes se esquematiza en la Figura 2.12. Diferenciar los oxoaniones en una serie de este tipo no es trivial. Por ejemplo, el ion hipoclorito es el ingrediente activo en la lejía de lavandería y desinfectante de piscinas, pero los compuestos que contienen el ion perclorato pueden explotar si entran en contacto con sustancias orgánicas.
- Escribe el nombre del compuesto como el nombre del catión seguido del nombre del anión.
No es necesario indicar el número de cationes o aniones presentes por unidad de fórmula en nombre de un compuesto iónico porque esta información está implícita por las cargas sobre los iones. Debe considerar la carga de los iones al escribir la fórmula para un compuesto iónico a partir de su nombre, sin embargo. Debido a que la carga en el ion cloruro es −1 y la carga en el ion calcio es +2, por ejemplo, consistente con sus posiciones en la tabla periódica, la aritmética simple te dice que el cloruro de calcio debe contener el doble de iones cloruro que iones calcio para mantener la neutralidad eléctrica. Así la fórmula es CaCl 2. De igual manera, el fosfato de calcio debe ser Ca 3 (PO 4) 2 porque el catión y el anión tienen cargas de +2 y −3, respectivamente. La mejor manera de aprender a nombrar compuestos iónicos es trabajar a través de algunos ejemplos, haciendo referencia a la Figura 2.10, Tabla 2.2, Tabla 2.4 y Tabla 2.5 según sea necesario.
Figura\(\PageIndex{2}\) Metales que forman más de un catión y sus ubicaciones en la Tabla Periódica
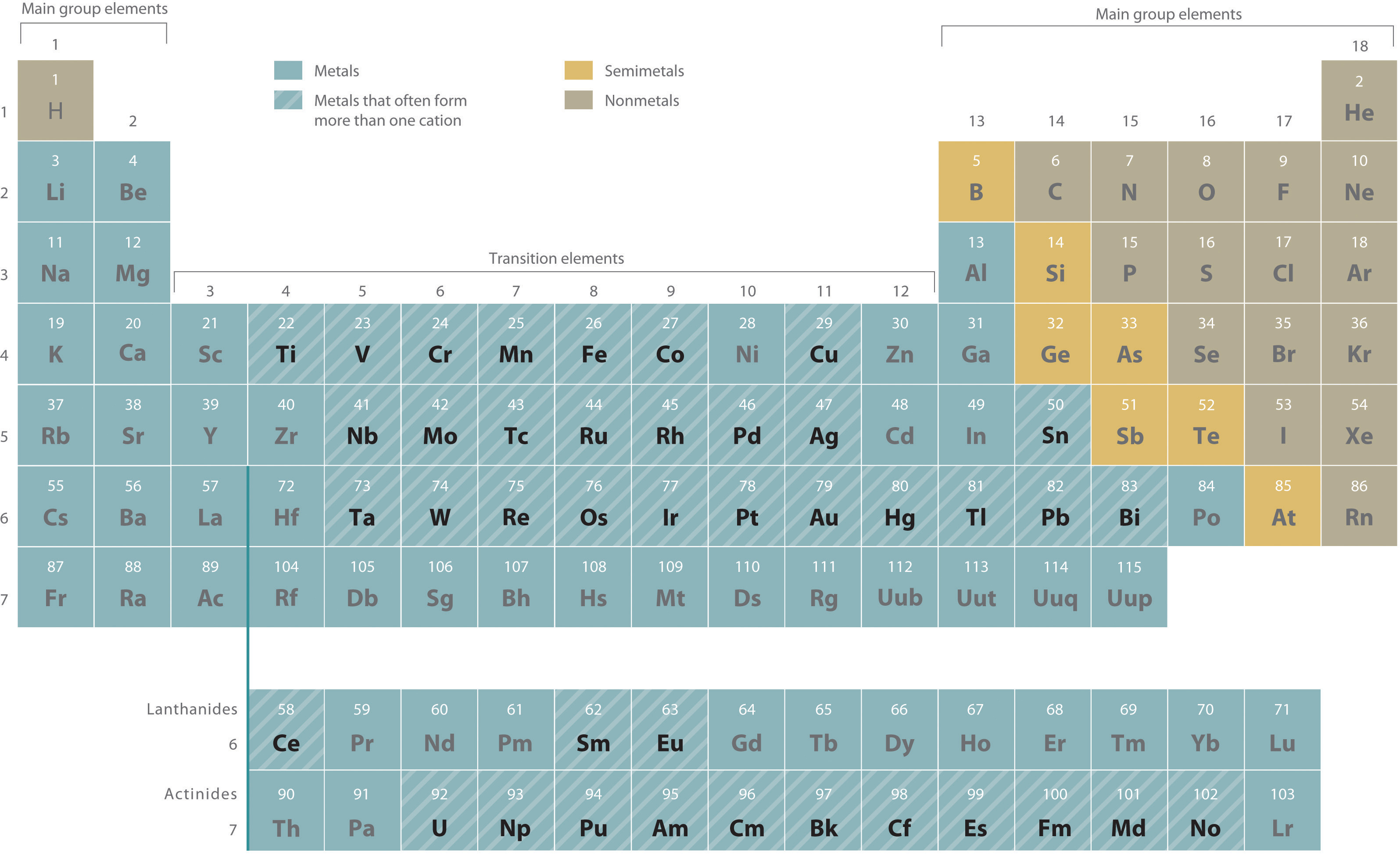
Con pocas excepciones, estos metales suelen ser metales de transición o actínidos.
Figura\(\PageIndex{3}\) La relación entre los nombres de oxoaniones y el número de átomos de oxígeno presentes
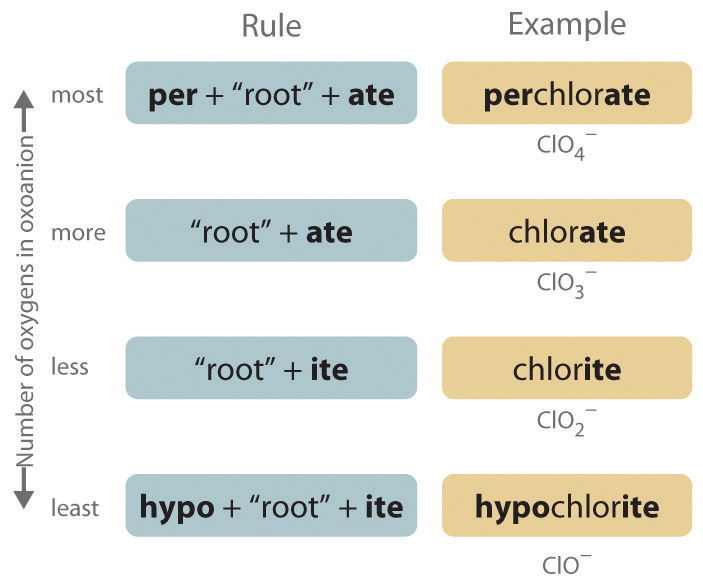
Tenga en cuenta el patrón
Los cationes siempre se nombran antes que los aniones.
La mayoría de los metales de transición, muchos actínidos y los elementos más pesados de los grupos 13-15 pueden formar más de un catión.
Escriba el nombre sistemático (y el nombre común si corresponde) para cada compuesto iónico.
- LiCl
- MgSO 4
- (NH 4) 3 PO 4
- Cu 2 O
Dado: fórmula empírica
Preguntado por: nombre
Estrategia:
A Si solo es posible un cargo para el catión, dar su nombre, consultando el Cuadro 2.2 o el Cuadro 2.4 si es necesario. Si el catión puede tener más de una carga (Tabla\(\PageIndex{1}\)), especifique la carga usando números romanos.
B Si el anión no contiene oxígeno, nómbrelo de acuerdo con el paso 3a, usando la Tabla 2.2 y la Tabla 2.4 si es necesario. Para los aniones poliatómicos que contienen oxígeno, use el Cuadro 2.4 y el prefijo y sufijo apropiados enumerados en el paso 3b.
C Comenzando con el catión, escriba el nombre del compuesto.
Solución
- A B El litio está en el grupo 1, por lo que sabemos que forma solo el catión Li +, que es el ion litio. De igual manera, el cloro está en el grupo 7, por lo que forma el anión Cl −, que es el ion cloruro. C Debido a que comenzamos con el nombre del catión, el nombre de este compuesto es cloruro de litio, que se usa médicamente como fármaco antidepresivo.
- A B El catión es el ion magnesio, y el anión, que contiene oxígeno, es sulfato. C Debido a que enumeramos primero el catión, el nombre de este compuesto es sulfato de magnesio. Una forma hidratada de sulfato de magnesio (MgSO 4 ·7H 2 O) se vende en las farmacias como sales de Epsom, un laxante duro pero efectivo.
- A B El catión es el ión amonio (del Cuadro 2.4), y el anión es fosfato. C El compuesto es, por lo tanto, fosfato amónico, el cual es ampliamente utilizado como fertilizante. No es necesario especificar que la unidad de fórmula contiene tres iones amonio porque se requieren tres para equilibrar la carga negativa sobre fosfato.
- A B El catión es un metal de transición que a menudo forma más de un catión (Cuadro 2.5). Por lo tanto, debemos especificar la carga positiva sobre el catión en el nombre: cobre (I) o, según el sistema más antiguo, cuproso. El anión es óxido. C El nombre de este compuesto es óxido de cobre (I) o, en el sistema más antiguo, óxido cuproso. El óxido de cobre (I) se utiliza como esmalte rojo en cerámicas y en pinturas antiincrustantes para evitar que los organismos crezcan en los fondos de los barcos.
Escriba el nombre sistemático (y el nombre común si corresponde) para cada compuesto iónico. \
- CuCl 2
- MgCo 3
- FePO 4
- Contestar
-
- cloruro de cobre (II) (o cloruro cúprico)
- carbonato de magnesio
- fosfato de hierro (III) (o fosfato férrico)

Cu 2 O. El fondo de una embarcación está protegido con una pintura antiincrustante roja que contiene óxido de cobre (I), Cu 2 O.
Escribe la fórmula para cada compuesto.
- dihidrogenofosfato de calcio
- sulfato de aluminio
- óxido de cromo (III)
Dado: nombre sistemático
Preguntado por: fórmula
Estrategia:
A Identificar el catión y su carga utilizando la ubicación del elemento en la tabla periódica y la Tabla 2.2, la Tabla 2.3, la Tabla 2.4 y la Tabla 2.5. Si el catión se deriva de un metal que puede formar cationes con diferentes cargas, utilice el número romano o sufijo apropiado para indicar su carga.
B Identificar el anión usando el Cuadro 2.2 y el Cuadro 2.4. Comenzando con el catión, escriba la fórmula del compuesto y luego determine el número de cationes y aniones necesarios para lograr la neutralidad eléctrica.
Solución
- A El calcio está en el grupo 2, por lo que forma solo el ion Ca 2+. B El dihidrógeno fosfato es el ion H 2 PO 4 − (Cuadro 2.4). Se necesitan dos iones H 2 PO 4 − para equilibrar la carga positiva en Ca 2+, para dar Ca (H 2 PO 4) 2. Un hidrato de dihidrogenofosfato de calcio, Ca (H 2 PO 4) 2 ·H 2 O, es el ingrediente activo en el polvo de hornear.
- A El aluminio, cerca de la parte superior del grupo 13 en la tabla periódica, forma solo un catión, Al 3+ (Figura 2.11). El sulfato B es SO 4 2− (Cuadro 2.4). Para equilibrar las cargas eléctricas, necesitamos dos cationes Al 3+ y tres aniones SO 4 2−, dando Al 2 (SO 4) 3. El sulfato de aluminio se utiliza para broncear el cuero y purificar el agua potable.
- A Debido a que el cromo es un metal de transición, puede formar cationes con diferentes cargas. El número romano nos dice que la carga positiva en este caso es +3, por lo que el catión es Cr 3+. El óxido B es O 2−. Así, se requieren dos cationes (Cr 3+) y tres aniones (O 2−) para dar un compuesto eléctricamente neutro, Cr 2 O 3. Este compuesto es un pigmento verde común que tiene muchos usos, incluyendo recubrimientos de camuflaje.

Cr 2 O 3. El óxido de cromo (III) (Cr 2 O 3) es un pigmento común en pinturas de color verde oscuro, como la pintura de camuflaje.
Escribe la fórmula para cada compuesto.
- cloruro de bario
- carbonato de sodio
- hidróxido de hierro (III)
- Contestar
-
- BacL
- Na 2 CO 3
- Fe (OH) 3
Resumen
Los compuestos iónicos se nombran de acuerdo con procedimientos sistemáticos, aunque los nombres comunes son ampliamente utilizados. La nomenclatura sistemática nos permite escribir la estructura de cualquier compuesto a partir de su nombre y viceversa. Los compuestos iónicos se nombran escribiendo primero el catión, seguido del anión. Si un metal puede formar cationes con más de una carga, la carga se indica con números romanos entre paréntesis siguiendo el nombre del metal. Los oxoaniones son aniones poliatómicos que contienen un solo átomo metálico o no metálico y uno o más átomos de oxígeno.
LLAVE PARA LLEVAR
- Existe un método sistemático utilizado para nombrar compuestos iónicos.
PROBLEMAS CONCEPTUALES
- Nombra cada catión.
- K +
- Al 3+
- NH 4 +
- Mg 2+
- Li +
- Nombra cada anión.
- Br −
- CO 3 2−
- S 2−
- NO 3 −
- HCO 2 −
- F −
- ClO −
- C 2 O 4 2−
- Nombra cada anión.
- PO 4 3−
- Cl −
- SO 3 2−
- CH 3 CO 2 −
- HSO 4 −
- ClO 4 −
- NO 2 −
- O 2−
- Nombra cada anión.
- SO 4 2−
- CN −
- Cr 2 O 7 2−
- N 3−
- OH −
- I -
- O 2 2−
- Nombrar cada compuesto.
- MgBr 2
- NH 4 CN
- CaO
- KClO 3
- K 3 PO 4
- NH 4 NO 2
- NaN 3
- Nombrar cada compuesto.
- Nano 3
- Cu 3 (PO 4) 2
- NaOH
- Li 4 C
- CaF 2
- NH 4 Br
- MgCo 3
- Nombrar cada compuesto.
- RbBr
- Mn 2 (SO 4) 3
- NaClO
- (NH 4) 2 SO 4
- NaBr
- KIO 3
- Na 2 CrO 4
- Nombrar cada compuesto.
- NH 4 ClO 4
- SNCl 4
- Fe (OH) 2
- Na 2 O
- MgCl 2
- K 2 SO 4
- RACL 2
- Nombrar cada compuesto.
- KCN
- LiOh
- CaCl 2
- NiSO 4
- NH 4 ClO 2
- LiClo 4
- La (CN) 3
Contestar
-
- bromuro de rubidio
- sulfato de manganeso (III)
- hipoclorito de sodio
- sulfato de amonio
- bromuro de sodio
- yodato de potasio
- cromato de sodio
PROBLEMAS NUMÉRICOS
- Para cada compuesto iónico, nombra el catión y el anión y da la carga en cada ion.
- BeO
- Pb (OH) 2
- BA
- Na 2 Cr 2 O 7
- ZnSO 4
- KCLo
- NaH 2 PO 4
- Para cada compuesto iónico, nombra el catión y el anión y da la carga en cada ion.
- Zn (NO 3) 2
- CoS
- BeCo 3
- Na 2 SO 4
- K 2 C 2 O 4
- NaCN
- FeCl 2
- Escribe la fórmula para cada compuesto.
- carbonato de magnesio
- sulfato de aluminio
- fosfato de potasio
- óxido de plomo (IV)
- nitruro de silicio
- hipoclorito de sodio
- cloruro de titanio (IV)
- fosfato de amonio disódico
- Escribe la fórmula para cada compuesto.
- nitrato de plomo (II)
- fosfato de amonio
- sulfuro de plata
- sulfato de bario
- yoduro de cesio
- bicarbonato de sodio
- dicromato de potasio
- hipoclorito de sodio
- Escribe la fórmula para cada compuesto.
- cianuro de zinc
- cromato plateado
- yoduro de plomo (II)
- benceno
- perclorato de cobre (II)
- Escribe la fórmula para cada compuesto.
- fluoruro de calcio
- nitrato de sodio
- óxido de hierro (III)
- acetato de cobre (II)
- nitrito de sodio
- Escribe la fórmula para cada compuesto.
- hidróxido de sodio
- cianuro de calcio
- fosfato de magnesio
- sulfato de sodio
- bromuro de níquel (II)
- clorito de calcio
- bromuro de titanio (IV)
- Escribe la fórmula para cada compuesto.
- clorito de sodio
- nitrito de potasio
- nitruro de sodio (también llamado azida de sodio)
- fosfuro de calcio
- cloruro de estaño (II)
- hidrogenofosfato de calcio
- cloruro de hierro (II) dihidrato
- Escribe la fórmula para cada compuesto.
- carbonato de potasio
- sulfito de cromo (III)
- fosfato de cobalto (II)
- hipoclorito de magnesio
- nitrato de níquel (II) hexahidratado


