2.6: Sustancias Químicas Industrialmente Importantes
- Page ID
- 78302
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Apreciar el alcance de la industria química y sus aportes a la sociedad moderna.
No es fácil comprender la escala en la que debe operar la industria química para abastecer las enormes cantidades de productos químicos que se requieren en las sociedades industriales modernas. La figura\(\PageIndex{1}\) enumera los nombres y fórmulas de los “25 mejores” de la industria química para 2002 —los 25 químicos producidos en la mayor cantidad en Estados Unidos ese año— junto con las cantidades producidas, en miles de millones de libras. Para poner estos números en perspectiva, considere que los 88.80 mil millones de libras de ácido sulfúrico producido en Estados Unidos en 2002 tiene un volumen de 21.90 millones de metros cúbicos (2.19 × 10 7 m 3), suficiente para llenar el Pentágono, probablemente el edificio de oficinas más grande del mundo, alrededor de 22 veces.
Figura 25\(\PageIndex{1}\) principales productos químicos producidos en Estados Unidos en 2002*
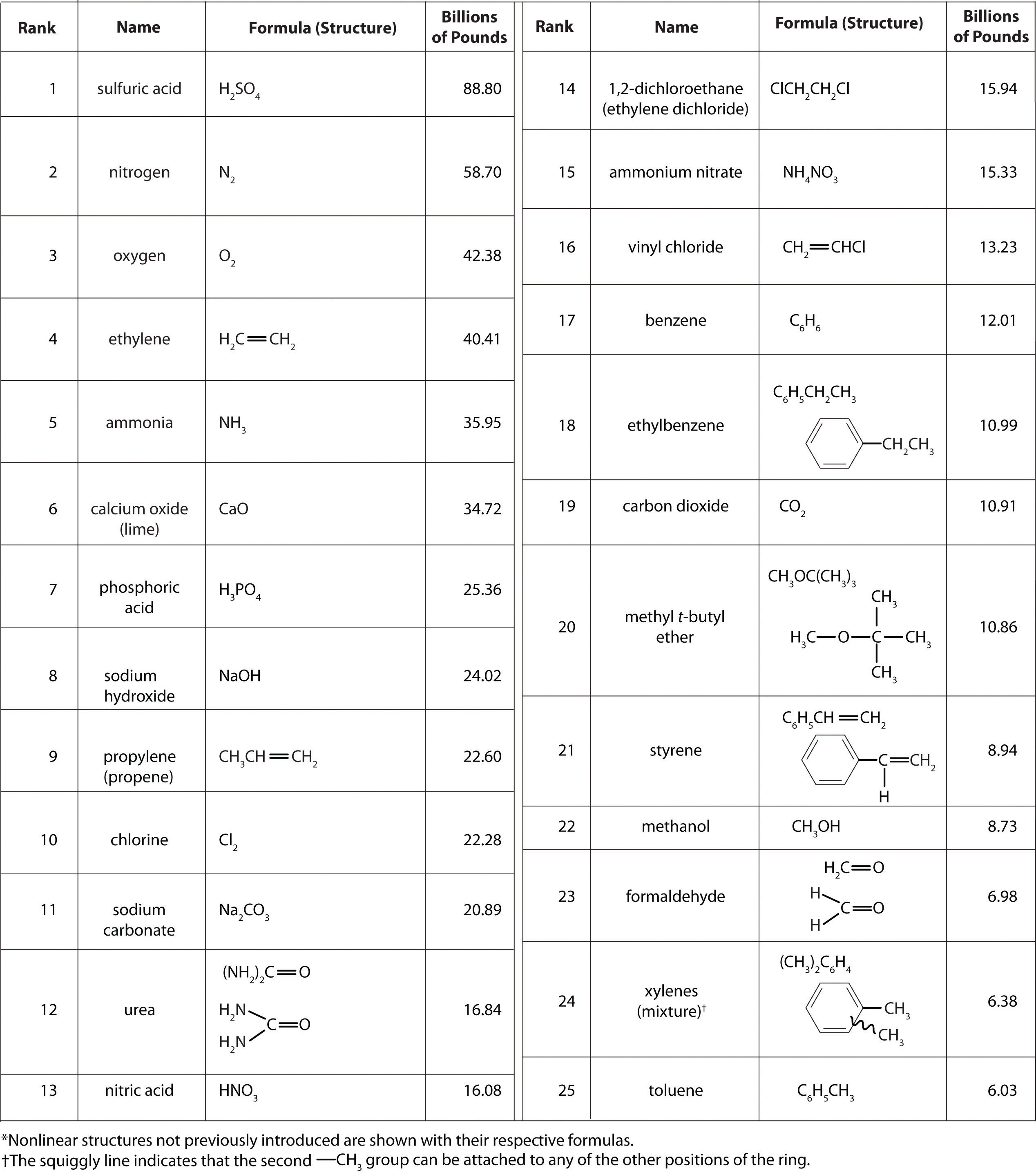
Según la Figura\(\PageIndex{1}\), 11 de los 15 compuestos principales producidos en Estados Unidos son inorgánicos, y la masa total de productos químicos inorgánicos producidos es casi el doble de la masa de los químicos orgánicos. Sin embargo, la diversidad de compuestos orgánicos utilizados en la industria es tal que más de la mitad de los 25 compuestos principales (13 de 25) son orgánicos.
¿Por qué se producen anualmente cantidades tan grandes de compuestos químicos? Se utilizan tanto directamente como componentes de compuestos y materiales que encontramos casi a diario e indirectamente en la producción de esos compuestos y materiales. El mayor uso de químicos industriales está en la producción de alimentos: 7 de los 15 principales productos químicos son fertilizantes (amoníaco, urea y nitrato de amonio) o utilizados principalmente en la producción de fertilizantes (ácido sulfúrico, ácido nítrico, nitrógeno y ácido fosfórico). Muchos de los químicos orgánicos en la lista se utilizan principalmente como ingredientes en los plásticos y materiales relacionados que son tan frecuentes en la sociedad contemporánea. El etileno y el propileno, por ejemplo, se utilizan para producir polietileno y polipropileno, los cuales se convierten en botellas de plástico para leche, bolsas para sándwich, alfombras para interiores y exteriores y otros artículos comunes. El cloruro de vinilo, en forma de cloruro de polivinilo, se utiliza en todo, desde tuberías hasta baldosas para pisos y bolsas de basura. Aunque no figuran en la Figura\(\PageIndex{1}\), el butadieno y el negro de carbón se utilizan en la fabricación de caucho sintético para llantas, y el fenol y el formaldehído son ingredientes en madera contrachapada, fibra de vidrio y muchos artículos de plástico duro.
No tenemos el espacio en este texto para considerar las aplicaciones de todos estos compuestos con todo detalle, pero volveremos a muchos de ellos después de haber desarrollado los conceptos necesarios para entender su química subyacente. En cambio, concluimos este capítulo con una breve discusión sobre la refinación del petróleo en lo que respecta a las calificaciones de gasolina y octano y una mirada a la producción y uso del producto químico industrial superior, el ácido sulfúrico.
Petróleo
El petróleo que se bombea del suelo en lugares alrededor del mundo es una mezcla compleja de varios miles de compuestos orgánicos, incluyendo alcanos de cadena lineal, cicloalcanos, alquenos e hidrocarburos aromáticos con cuatro a varios cientos de átomos de carbono. Las identidades y abundancias relativas de los componentes varían dependiendo de la fuente. Por lo que el crudo de Texas es algo diferente del crudo de Arabia Saudita. De hecho, el análisis de petróleo de diferentes depósitos puede producir una “huella” de cada uno, lo cual es útil para rastrear las fuentes de petróleo crudo derramado. Por ejemplo, el petróleo crudo de Texas es “dulce”, lo que significa que contiene una pequeña cantidad de moléculas que contienen azufre, mientras que el petróleo crudo de Arabia Saudita es “agrio”, lo que significa que contiene una cantidad relativamente grande de moléculas que contienen azufre.
Gasolina
El petróleo se convierte en productos útiles como la gasolina en tres etapas: destilación, craqueo y reformado. Recordemos del Capítulo 1 que la destilación separa los compuestos en base a su volatilidad relativa, la cual suele ser inversamente proporcional a sus puntos de ebullición. La parte (a) de la Figura\(\PageIndex{2}\) muestra un dibujo recortado de una columna utilizada en la industria petrolera para separar los componentes del petróleo crudo. El petróleo se calienta a aproximadamente 400°C (750°F), temperatura a la cual se ha convertido en una mezcla de líquido y vapor. Esta mezcla, llamada materia prima, se introduce en la torre de refinación. Los componentes más volátiles (aquellos con los puntos de ebullición más bajos) se condensan en la parte superior de la columna donde está más fría, mientras que los componentes menos volátiles se condensan más cerca del fondo. Algunos materiales son tan no volátiles que se acumulan en el fondo sin evaporarse en absoluto. Así, la composición del líquido que se condensa en cada nivel es diferente. Estas diferentes fracciones, cada una de las cuales generalmente consiste en una mezcla de compuestos con números similares de átomos de carbono, se extraen por separado. La parte (b) en\ Figura\(\PageIndex{2}\)) muestra las fracciones típicas recolectadas en las refinerías, el número de átomos de carbono que contienen, sus puntos de ebullición y sus usos finales. Estos productos van desde gases utilizados en gas natural y embotellado hasta líquidos utilizados en combustibles y lubricantes hasta sólidos gomosos utilizados como alquitrán en carreteras y techos.
Figura\(\PageIndex{2}\) La Destilación del Petróleo
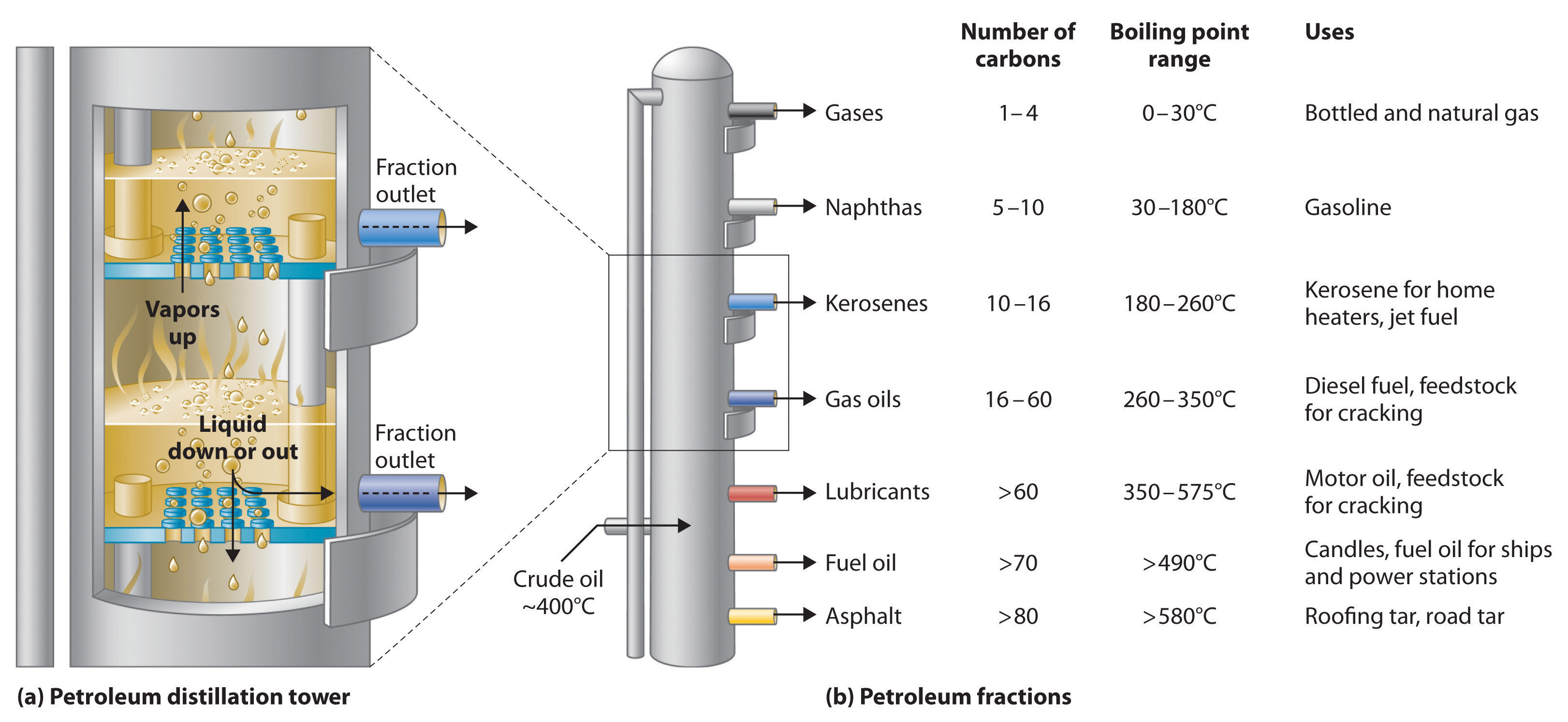
a) Este es un diagrama de una columna de destilación utilizada para separar fracciones de petróleo. b) Las fracciones de petróleo se condensan a diferentes temperaturas, dependiendo del número de átomos de carbono en las moléculas, y se extraen de la columna. Los componentes más volátiles (aquellos con los puntos de ebullición más bajos) se condensan en la parte superior de la columna, y los menos volátiles (aquellos con los puntos de ebullición más altos) se condensan en la parte inferior.
La economía de la refinación de petróleo es compleja. Por ejemplo, la demanda del mercado de queroseno y lubricantes es mucho menor que la demanda de gasolina, sin embargo, las tres fracciones se obtienen de la columna de destilación en cantidades comparables. Además, la mayoría de las gasolinas y combustibles para aviones son mezclas con composiciones muy cuidadosamente controladas que no pueden variar como lo hicieron sus materias primas originales. Para que la refinación del petróleo sea más rentable, las fracciones menos volátiles y de menor valor deben convertirse en mezclas más volátiles y de mayor valor que tengan fórmulas cuidadosamente controladas. El primer proceso utilizado para lograr esta transformación es el craqueo, en el que los hidrocarburos más grandes y pesados en el queroseno y las fracciones de punto de ebullición más alto se calientan a temperaturas de hasta 900°C. Las reacciones de alta temperatura hacen que los enlaces carbono-carbono se rompan, lo que convierte el compuestos a moléculas más ligeras similares a las de la fracción de gasolina. Así, en el craqueo, un alcano de cadena lineal con un número de átomos de carbono correspondientes a la fracción de queroseno se convierte en una mezcla de hidrocarburos con un número de átomos de carbono correspondientes a la fracción de gasolina más ligera. El segundo proceso utilizado para aumentar la cantidad de productos valiosos se llama reformado; es la conversión química de alcanos de cadena lineal en alcanos de cadena ramificada o mezclas de hidrocarburos aromáticos. El uso de metales como el platino produce las reacciones químicas necesarias. Las mezclas de productos obtenidos del craqueo y reformado se separan por destilación fraccionada.
Clasificaciones de Octane
La calidad de un combustible está indicada por su índice de octanaje, que es una medida de su capacidad para quemar en un motor de combustión sin tocar ni hacer pinging. Los golpes y los pinging señalan la combustión prematura (Figura\(\PageIndex{3}\)), que puede ser causada ya sea por un mal funcionamiento del motor o por un combustible que se quema demasiado rápido. En cualquier caso, la mezcla gasolina-aire detona en el punto equivocado del ciclo del motor, lo que reduce la potencia de salida y puede dañar válvulas, pistones, cojinetes y otros componentes del motor. Las diversas formulaciones de gasolina están diseñadas para proporcionar la mezcla de hidrocarburos con menos probabilidades de causar detonaciones o ping en un tipo dado de motor que funciona a un nivel particular.
Figura\(\PageIndex{3}\) La quema de gasolina en un motor de combustión interna
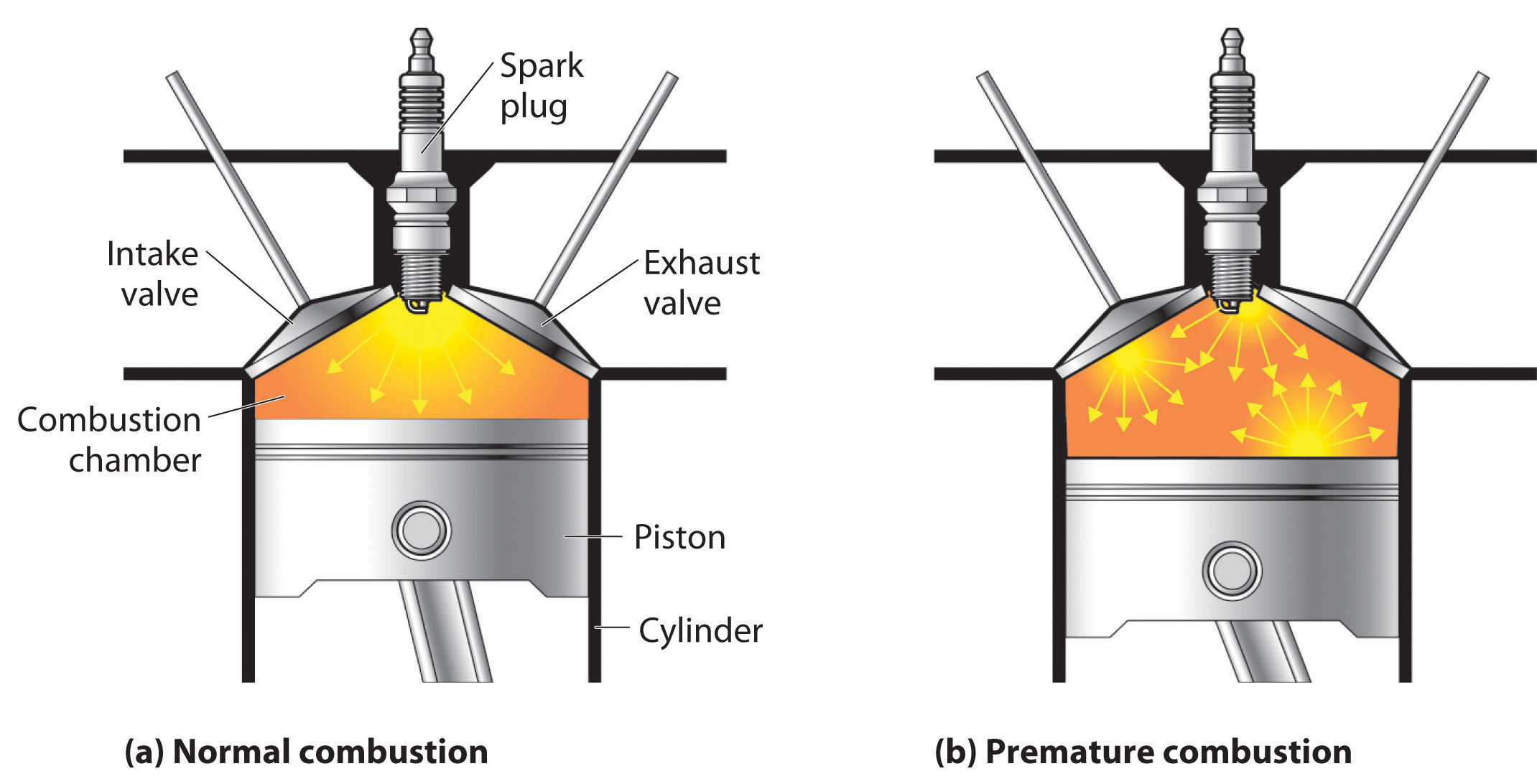
(a) Normalmente, el combustible es encendido por la bujía, y la combustión se extiende uniformemente hacia afuera. (b) La gasolina con un índice de octanaje demasiado bajo para el motor puede encenderse prematuramente, dando como resultado una combustión desigual que provoca golpes y pinging.
La escala de octanos se estableció en 1927 utilizando un motor de prueba estándar y dos compuestos puros: n-heptano e isooctano (2,2,4-trimetilpentano). Al n-heptano, que causa una gran cantidad de detonación en la combustión, se le asignó una clasificación de octano de 0, mientras que al isooctano, un combustible de combustión muy suave, se le asignó una clasificación de octano de 100. Los químicos asignan índices de octano a diferentes mezclas de gasolina quemando una muestra de cada una en un motor de prueba y comparando el golpeteo observado con la cantidad de golpeteo causado por mezclas específicas de n-heptano e isooctano. Por ejemplo, el índice de octano de una mezcla de 89% de isooctano y 11% de n-heptano es simplemente el promedio de las calificaciones de octano de los componentes ponderados por las cantidades relativas de cada uno en la mezcla. Convirtiendo porcentajes a decimales, obtenemos el índice de octano de la mezcla:
0.89 (100) + 0.11 (0) = 89
A una gasolina que se desempeña al mismo nivel que una mezcla de 89% de isooctano y 11% de n-heptano se le asigna una clasificación de octano de 89; esto representa un grado intermedio de gasolina. La gasolina regular generalmente tiene una clasificación de octanaje de 87; la prima tiene una calificación de 93 o superior.
Como se muestra en la Figura\(\PageIndex{4}\) muchos compuestos que ahora están disponibles tienen índices de octano mayores a 100, lo que significa que son mejores combustibles que el isooctano puro. Además, se han desarrollado agentes antidetonantes, también llamados potenciadores del octano. Uno de los más utilizados durante muchos años fue el tetraetilplomo [(C 2 H 5) 4 Pb], que a aproximadamente 3 g/gal da un aumento de 10-15 puntos en el índice de octano. Desde 1975, sin embargo, los compuestos de plomo se han ido eliminando gradualmente como aditivos de gasolina porque son altamente tóxicos. Otros potenciadores, como el metil t-butil éter (MTBE), han sido desarrollados para tomar su lugar. Combinan un alto índice de octanaje con una corrosión mínima en las partes del motor y del sistema de combustible. Desafortunadamente, cuando la gasolina que contiene MTBE se escapa de tanques de almacenamiento subterráneos, el resultado ha sido la contaminación del agua subterránea en algunos lugares, lo que ha resultado en limitaciones o prohibiciones directas sobre el uso de MTBE en ciertas áreas. Como resultado, el uso de potenciadores de octano alternativos como el etanol, que se puede obtener de recursos renovables como maíz, caña de azúcar y, eventualmente, tallos y pastos de maíz, está aumentando.
Figura\(\PageIndex{4}\) Las clasificaciones de octano de algunos hidrocarburos y aditivos comunes
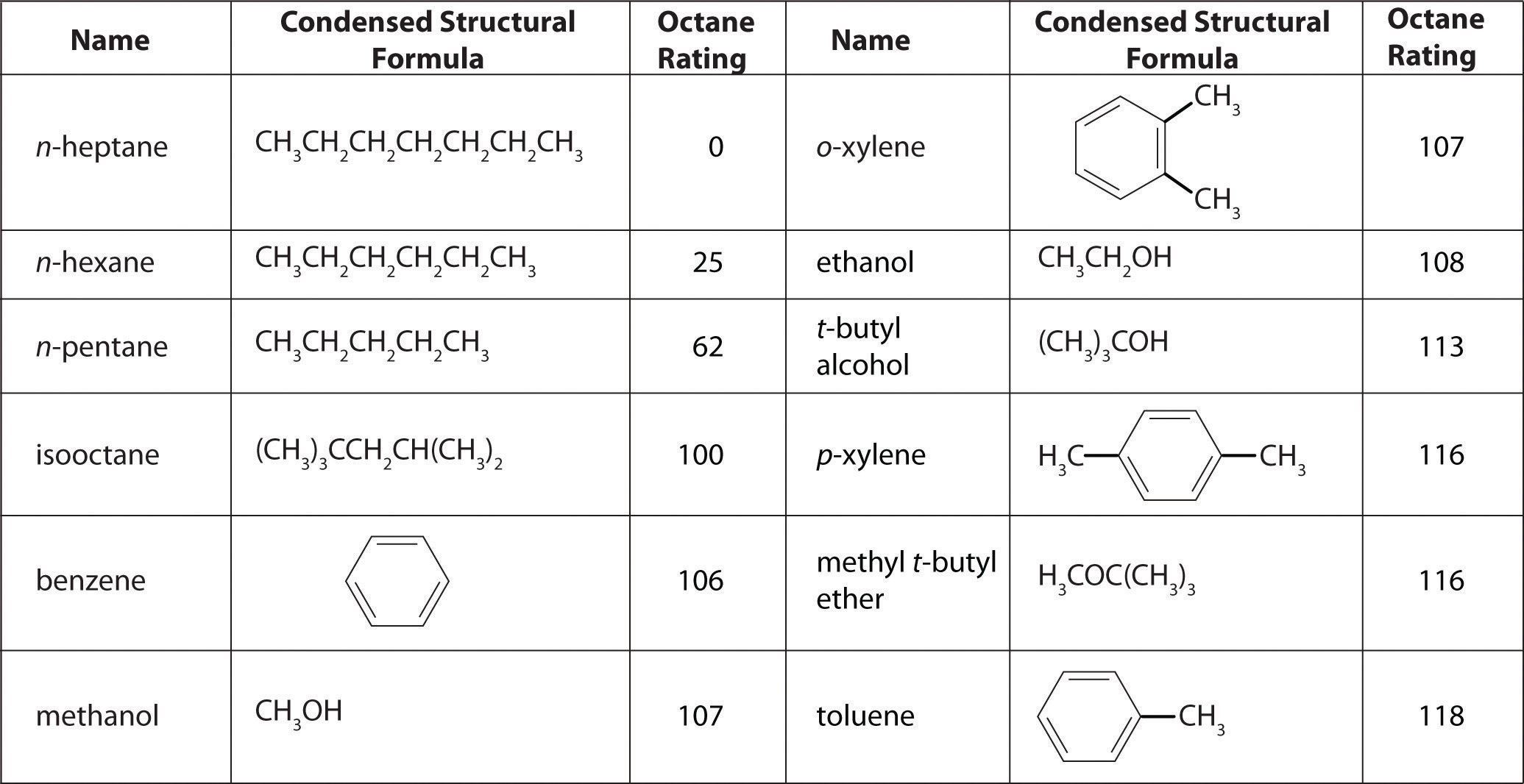
Tiene un destilado de petróleo crudo (es decir, sin procesar o de ejecución directa) que consiste en 10% n -heptano, 10% n -hexano y 80% n-pentano en masa, con una clasificación de octano de 52. ¿Qué porcentaje de MTBE en masa necesitaría para aumentar el índice de octano del destilado al de la gasolina de grado regular (una calificación de 87), asumiendo que el índice de octano es directamente proporcional a las cantidades de los compuestos presentes? Utilice la información presentada en la Figura\(\PageIndex{4}\).
Dado: composición del destilado de petróleo, índice de octano inicial y índice de octano final
Preguntado por: porcentaje de MTBE por masa en mezcla final
Estrategia:
A Definir lo desconocido como el porcentaje de MTBE en la mezcla final. Después restar este desconocido del 100% para obtener el porcentaje de destilado de petróleo.
B Multiplicar el porcentaje de MTBE y el porcentaje de destilado de petróleo por sus respectivas calificaciones de octano; sumar estos valores para obtener el índice de octano global de la nueva mezcla.
C Resolver para lo desconocido para obtener el porcentaje de MTBE necesario.
Solución
A La pregunta pregunta qué porcentaje de MTBE dará una calificación de octanaje general de 87 cuando se mezcla con la fracción de ejecución recta. De la Figura\(\PageIndex{4}\), el índice de octanaje de MTBE es 116. Sea x el porcentaje de MTBE, y deje que 100 − x sea el porcentaje de destilado de petróleo.
B Multiplicar el porcentaje de cada componente por su índice de octano respectivo y establecer la suma igual al índice de octano deseado de la mezcla (87) por 100 da
índice de octano final de la mezcla =87 (100) =52 (100−x) +116x=5200−52x+116x=5200+64x
C Resolver la ecuación da x = 55%. Así, la mezcla final debe contener 55% de MTBE en masa.
Para obtener una composición de 55% de MTBE en masa, se tendría que agregar más de una masa igual de MTBE (en realidad 0.55/0.45, o 1.2 veces) a la fracción recta. Se trata de 1.2 toneladas de MTBE por tonelada de gasolina de serie recta, lo que sería prohibitivamente caro. Por lo tanto, existen razones económicas sólidas para reformar las fracciones de queroseno para producir tolueno y otros compuestos aromáticos, los cuales tienen altos índices de octano y son mucho más baratos que el MTBE.
Como se muestra en la Figura\(\PageIndex{4}\), el tolueno es uno de los combustibles adecuados para su uso en motores de automóviles. ¿Cuánto tolueno tendría que agregarse a una mezcla de la fracción de petróleo en este ejemplo que contiene 15% de MTBE en masa para aumentar el índice de octano a la de la gasolina premium (93)?
- Contestar
-
La mezcla final es 56% de tolueno en masa, lo que requiere una relación de 56/44, o 1.3 toneladas de tolueno por tonelada de mezcla.
Ácido Sulfúrico
El ácido sulfúrico es uno de los compuestos químicos más antiguos conocidos. Probablemente fue preparado por primera vez por alquimistas que quemaron sales de sulfato como el FeSO 4 ·7H 2 O, llamado vitriolo verde por su color y apariencia vítrea (del latín vitrum, que significa “vidrio”). Debido a que se encontró que el ácido sulfúrico puro era útil para teñir textiles, individuos emprendedores buscaron formas de mejorar su producción. A mediados del siglo XVIII, el ácido sulfúrico se estaba produciendo en cantidades multiton por el proceso de cámara de plomo, que fue inventado por John Roebuck en 1746. En este proceso, el azufre se quemó en una habitación grande forrada con plomo, y los humos resultantes fueron absorbidos en agua.
Producción
Es probable que la producción de ácido sulfúrico hoy en día comience con azufre elemental obtenido a través de una ingeniosa técnica llamada proceso Frasch, que aprovecha el bajo punto de fusión del azufre elemental (115.2°C). Grandes depósitos de azufre elemental se encuentran en rocas calizas porosas en las mismas formaciones geológicas que a menudo contienen petróleo. En el proceso de Frasch, el agua a alta temperatura (160°C) y alta presión se bombea bajo tierra para fundir el azufre, y se utiliza aire comprimido para forzar la mezcla de azufre-agua líquida a la superficie (Figura\(\PageIndex{5}\). El material que emerge del suelo es más de 99% de azufre puro. Después de solidificarse, se pulveriza y se envía en vagones de ferrocarril a las plantas que producen ácido sulfúrico, como se muestra aquí.

Transportando azufre. Un tren transporta azufre elemental a través del Cañón Blanco del río Thompson en Columbia Británica, Canadá.
Figura\(\PageIndex{5}\) Extracción de azufre elemental de depósitos subterráneos
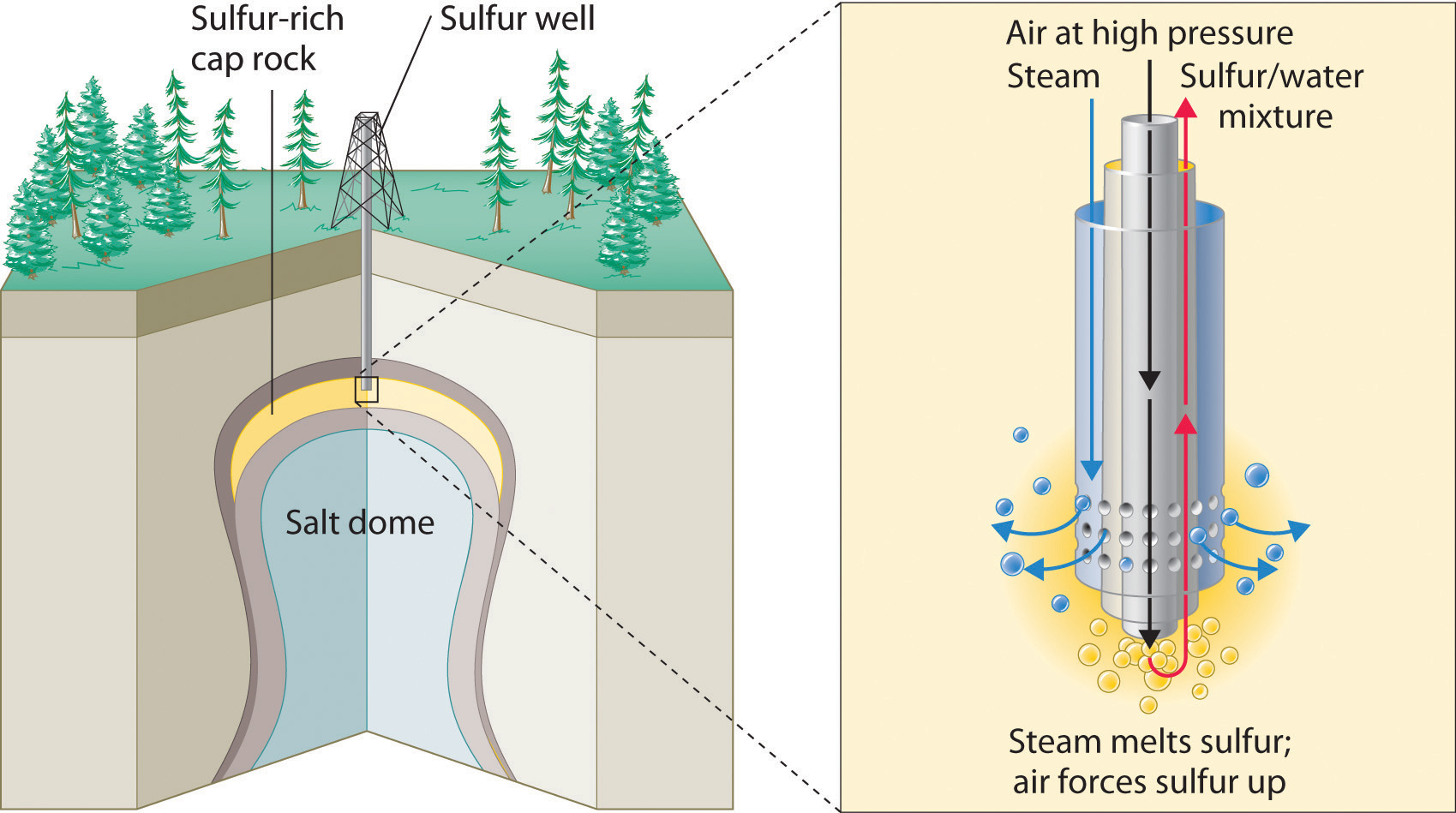
En el proceso de Frasch para extraer azufre, se inyecta agua muy caliente a alta presión en la capa de roca que contiene azufre para fundir el azufre. La mezcla resultante de azufre líquido y agua caliente es forzada a subir a la superficie por aire comprimido.
Un número creciente de fabricantes de ácido sulfúrico han comenzado a usar dióxido de azufre (SO 2) como material de partida en lugar de azufre elemental. El dióxido de azufre se recupera de la quema de petróleo y gas, que contienen pequeñas cantidades de compuestos de azufre. Cuando no se recupera, el SO 2 se libera a la atmósfera, donde se convierte en una forma ambientalmente peligrosa que conduce a la lluvia ácida (Capítulo 4).
Si el azufre es el material de partida, el primer paso en la producción de ácido sulfúrico es la combustión de azufre con oxígeno para producir SO 2. A continuación, SO 2 se convierte en SO 3 por el proceso de contacto, en el que SO 2 y O 2 reaccionan en presencia de V 2 O 5 para lograr aproximadamente 97% de conversión a SO 3. El SO 3 puede entonces tratarse con una pequeña cantidad de agua para producir ácido sulfúrico. Por lo general, sin embargo, el SO 3 es absorbido en ácido sulfúrico concentrado para producir óleum, una forma más potente llamada ácido sulfúrico fuming. Debido a su alto contenido de SO 3 (aproximadamente 99% en masa), el óleum es más barato de enviar que el ácido sulfúrico concentrado. En el punto de uso, el óleum se diluye con agua para dar ácido sulfúrico concentrado (con mucho cuidado porque la dilución genera enormes cantidades de calor). Debido a que el SO 2 es un contaminante, las pequeñas cantidades de SO 2 sin convertir se recuperan y reciclan para minimizar la cantidad liberada al aire.
Usos
Dos tercios del ácido sulfúrico producido en Estados Unidos se utilizan para elaborar fertilizantes, la mayoría de los cuales contienen nitrógeno, fósforo y potasio (en una forma llamada potasa). En días anteriores, las rocas que contenían fosfato simplemente se trituraban y se extendían en los campos como fertilizante, pero la extrema insolubilidad de muchas sales que contienen el ion fosfato (PO 4 3−) limita la disponibilidad de fósforo de estas fuentes. El ácido sulfúrico sirve como fuente de protones (iones H +) que reaccionan con minerales de fosfato para producir sales más solubles que contienen HPO 4 2− o H 2 PO 4 − como anión, las cuales son mucho más fácilmente absorbidas por las plantas. En este contexto, el ácido sulfúrico se utiliza de dos maneras principales: (1) las rocas de fosfato se tratan con ácido sulfúrico concentrado para producir “superfosfato”, una mezcla de 32% CaHPO 4 y Ca (H 2 PO 4) 2·H 2 O, 50% CaHPO 4 ·2H 2 O, aproximadamente 3% absorbió ácido fosfórico y otros nutrientes; y (2) el ácido sulfúrico se usa para producir ácido fosfórico (H 3 PO 4), que luego se puede usar para convertir rocas de fosfato en “superfosfato triple”, que es en gran parte Ca (H 2 PO 4) 2·H 2 O.
El ácido sulfúrico también se utiliza para producir potasa, uno de los otros ingredientes principales en los fertilizantes. El nombre potasa originalmente se refería al carbonato de potasio (obtenido por ebullición de cenizas de madera con agua en macetas de hierro), pero hoy también se refiere a compuestos como el hidróxido de potasio (KOH) y el óxido de potasio (K 2 O). La fuente habitual de potasio en los fertilizantes es en realidad el sulfato de potasio (K 2 SO 4), el cual se produce por varias vías, entre ellas la reacción de ácido sulfúrico concentrado con cloruro de potasio sólido (KCl), el cual se obtiene como la sal pura a partir de depósitos minerales.
Resumen
Muchos compuestos químicos se preparan industrialmente en grandes cantidades y se utilizan para producir alimentos, combustibles, plásticos y otros materiales similares. La refinación de petróleo toma una mezcla compleja de hidrocarburos naturales como materia prima y, a través de una serie de etapas que implican destilación, craqueo y reformado, los convierte en mezclas de compuestos orgánicos más simples con propiedades deseables. Un uso importante del petróleo es en la producción de combustibles para motores como la gasolina. El desempeño de dichos combustibles en motores se describe por su índice de octano, que depende de la identidad de los compuestos presentes y su abundancia relativa en la mezcla.
El ácido sulfúrico es el compuesto que se produce en mayor cantidad en el mundo industrial. Gran parte del azufre utilizado en la producción de ácido sulfúrico se obtiene a través del proceso Frasch, en el que el agua muy caliente fuerza el azufre líquido fuera del suelo en forma casi pura. El ácido sulfúrico se produce por la reacción del dióxido de azufre con oxígeno en presencia de óxido de vanadio (V) (el proceso de contacto), seguido de la absorción del trióxido de azufre en ácido sulfúrico concentrado para producir óleum. La mayor parte del ácido sulfúrico se utiliza para preparar fertilizantes.
LLAVE PARA LLEVAR
- Muchos compuestos químicos se preparan industrialmente en grandes cantidades para preparar los materiales que necesitamos y utilizamos en nuestra vida diaria.
PROBLEMAS CONCEPTUALES
- Describir los procesos utilizados para convertir petróleo crudo en combustibles de transporte.
- Si el motor de su automóvil está golpeando, ¿el índice de octanaje de su gasolina es demasiado bajo o demasiado alto? Explica tu respuesta.
- El tetraetilplomo ya no se usa como aditivo de combustible para evitar golpes. En cambio, el combustible ahora se comercializa como “sin plomo”. ¿Por qué ya no se usa tetraetilplomo?
- Si trataras de extraer azufre de una fuente subterránea, ¿qué proceso utilizarías? Describir brevemente las características esenciales de este proceso.
- ¿Por qué se utilizan minerales que contienen fosfato en fertilizantes tratados con ácido sulfúrico?
Contestar
- Las sales de fosfato contienen el ion PO 4 3− altamente cargado, cuyas sales suelen ser insolubles. La protonación del ion PO 4 3− por ácidos fuertes como H 2 SO 4 conduce a la formación de los iones HPO 4 2− y H 2 PO 4 −. Debido a su disminución de la carga negativa, las sales que contienen estos aniones suelen ser mucho más solubles, permitiendo que los aniones sean fácilmente absorbidos por las plantas cuando se aplican como fertilizante.
PROBLEMA NUMÉRICO
- En Ejemplo\(\PageIndex{1}\), el petróleo crudo tuvo un índice de octano global de 52. ¿Cuál es la composición de una solución de MTBE y n-heptano que tiene esta clasificación de octano?


