2.5: Ácidos y Bases
- Page ID
- 78301
- Identificar y nombrar algunos ácidos y bases comunes.
Para nuestros propósitos en este punto del texto, podemos definir un ácido como una sustancia con al menos un átomo de hidrógeno que puede disociarse para formar un anión y un ion H + (un protón) en solución acuosa, formando así una solución ácida. Podemos definir bases como compuestos que producen iones hidróxido (OH −) y un catión For cuando se disuelven en agua, formando así una solución básica. Las soluciones que no son ni básicas ni ácidas son neutras. Discutiremos la química de los ácidos y bases con más detalle en el Capítulo 4, Capítulo 8 y Capítulo 16, pero en esta sección describimos la nomenclatura de los ácidos comunes e identificaremos algunas bases importantes para que pueda reconocerlos en futuras discusiones. Los ácidos y bases puros y sus soluciones acuosas concentradas se encuentran comúnmente en el laboratorio. Suelen ser altamente corrosivos, por lo que deben manejarse con cuidado.
Ácidos
Los nombres de los ácidos diferencian entre (1) ácidos en los que el ion H + está unido a un átomo de oxígeno de un anión poliatómico (estos se llaman oxoácidos, u ocasionalmente oxiácidos) y (2) ácidos en los que el ion H + está unido a algún otro elemento. En este último caso, el nombre del ácido comienza con hidro - y termina en - ic, con la raíz del nombre del otro elemento o ion en el medio. Recordemos que el nombre del anión derivado de este tipo de ácido siempre termina en - ide. Así, el gas cloruro de hidrógeno (HCl) se disuelve en agua para formar ácido clorhídrico (que contiene iones H + y Cl −), el gas cianuro de hidrógeno (HCN) forma ácido cianhídrico (que contiene iones H + y CN −), y así sucesivamente (Tabla\(\PageIndex{1}\)). Ejemplos de este tipo de ácido se encuentran comúnmente y son muy importantes. Por ejemplo, tu estómago contiene una solución diluida de ácido clorhídrico para ayudar a digerir los alimentos. Cuando los mecanismos que impiden que el estómago se digiera mal, el ácido destruye el revestimiento del estómago y se forma una úlcera.
Tenga en cuenta el patrón
Los ácidos se distinguen por si el ion H + está unido a un átomo de oxígeno de un anión poliatómico o algún otro elemento.
Tabla\(\PageIndex{1}\) Algunos Ácidos Comunes Que No Contienen Oxígeno
| Fórmula | Nombre en Solución Acuosa | Nombre de las especies gaseosas |
|---|---|---|
| HF | ácido fluorhídrico | fluoruro de hidrógeno |
| HCl | ácido clorhídrico | cloruro de hidrógeno |
| HBr | ácido bromhídrico | bromuro de hidrógeno |
| HOLA | ácido yodhídrico | yoduro de hidrógeno |
| HCN | ácido cianhídrico | cianuro de hidrógeno |
| H 2 S | ácido hidrosulfúrico | sulfuro de hidrógeno |
Si un ácido contiene uno o más iones H + unidos al oxígeno, es un derivado de uno de los oxoaniones comunes, como el sulfato (SO 4 2−) o el nitrato (NO 3 −). Estos ácidos contienen tantos iones H + como sean necesarios para equilibrar la carga negativa sobre el anión, dando como resultado una especie neutra como H 2 SO 4 y HNO 3.
Los nombres de los ácidos se derivan de los nombres de aniones de acuerdo con las siguientes reglas:
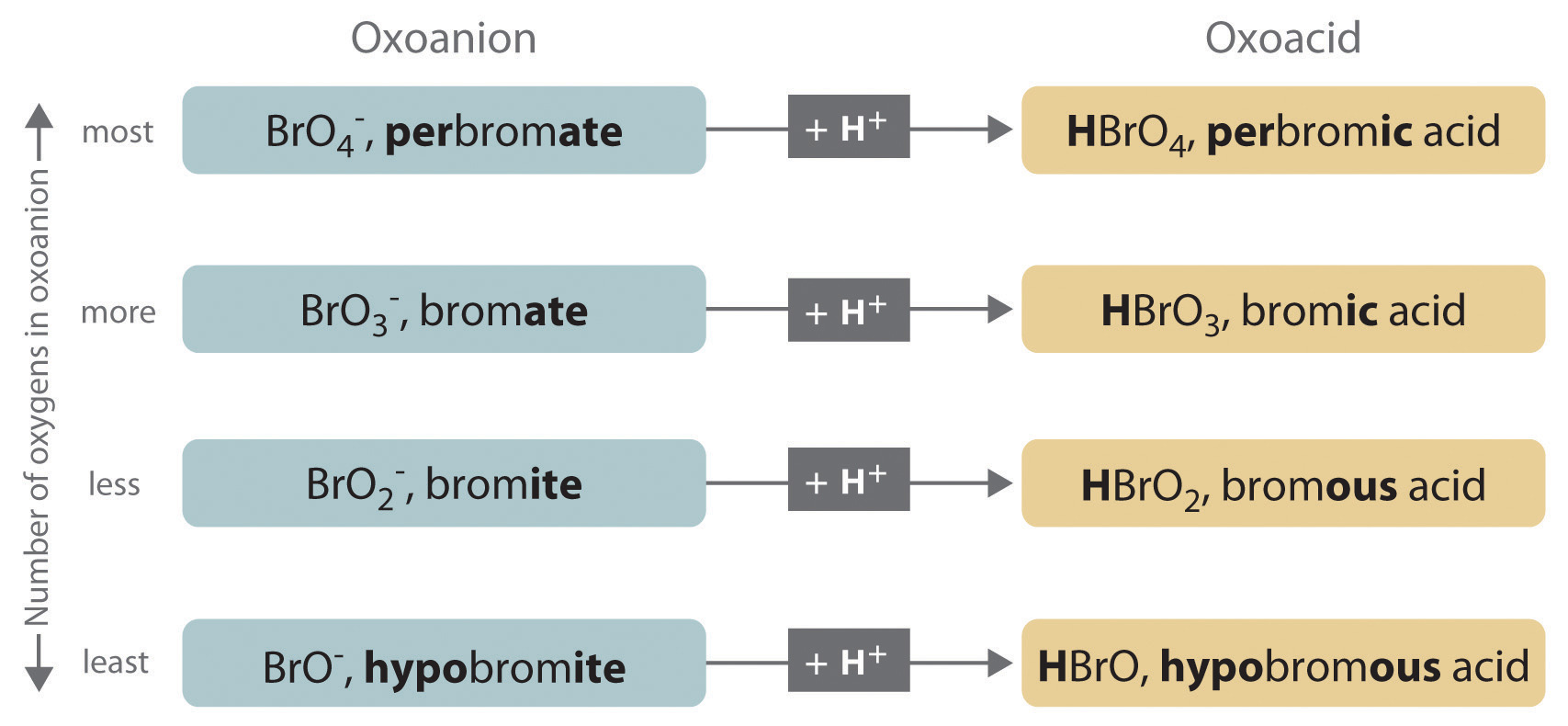
- Si el nombre del anión termina en - comió, entonces el nombre del ácido termina en - ic. Por ejemplo, debido a que NO 3 − es el ion nitrato, el HNO 3 es ácido nítrico. De manera similar, ClO 4 − es el ion perclorato, por lo que HClO 4 es ácido perclórico. Dos ácidos importantes son el ácido sulfúrico (H 2 SO 4) del ion sulfato (SO 4 2−) y el ácido fosfórico (H 3 PO 4) del ion fosfato (PO 4 3−). Estos dos nombres utilizan una ligera variante de la raíz del nombre del anión: sulf ate se convierte en azufre ic y fosfito se convierte en fósforo ic.
- Si el nombre del anión termina en - ite, entonces el nombre del ácido termina en - ous. Por ejemplo, OCl − es el ion hipoclorito, y HOCl es ácido hipocloroso; NO 2 − es el ion nitrito y HNO 2 es ácido nitroso; y SO 3 2− es el ion sulfito y H 2 SO 3 es ácido sulfuroso. Se utilizan las mismas raíces ya sea que el nombre ácido termine en - ic o - ous; así, el sulfito se vuelve sulfuroso.
La relación entre los nombres de los oxoácidos y los oxoaniones progenitores se ilustra en la Figura\(\PageIndex{1}\), y algunos oxoácidos comunes están en la Tabla\(\PageIndex{2}\).
Figura\(\PageIndex{1}\) La relación entre los nombres de los oxoácidos y los nombres de los oxoaniones progenitores
Tabla\(\PageIndex{2}\) Algunos Oxoácidos Comunes
| Fórmula | Nombre |
|---|---|
| HNO 2 | ácido nitroso |
| HNO 3 | ácido nítrico |
| H 2 SO 3 | ácido sulfuroso |
| H 2 SO 4 | ácido sulfúrico |
| H 3 PO 4 | ácido fosfórico |
| H 2 CO 3 | ácido carbónico |
| HClO | ácido hipocloroso |
| HClO 2 | ácido cloroso |
| HClO 3 | ácido clórico |
| HClO 4 | ácido perclórico |
Nombra y da la fórmula para cada ácido.
- el ácido formado añadiendo un protón al ion hipobromito (OBr −)
- el ácido formado añadiendo dos protones al ion selenato (SeO 4 2−)
Dado: anión
Preguntado por: ácido parental
Estrategia:
Consulte Tabla\(\PageIndex{1}\) y Tabla\(\PageIndex{2}\) para encontrar el nombre del ácido. Si el ácido no aparece en la lista, use las pautas dadas anteriormente.
Solución
Ninguna de las especies está listada en la Tabla\(\PageIndex{1}\) "ni en la Tabla\(\PageIndex{2}\), por lo que debemos usar la información dada previamente para derivar el nombre del ácido del nombre del anión poliatómico.
- El nombre del anión, hipobromito, termina en - ite, por lo que el nombre del ácido parental termina en - ous. El ácido es por lo tanto ácido hipobromoso (HOBr).
- El selenato termina en - comió, por lo que el nombre del ácido parental termina en - ic. El ácido es por lo tanto ácido selénico (H 2 SeO 4).
.
Nombra y da la fórmula para cada ácido.
- el ácido formado añadiendo un protón al ion perbromato (BrO 4 −)
- el ácido formado por la adición de tres protones al ion arsenito (AsO 3 3−)
- Contestar
-
- ácido perbromico; HBro 4
- ácido arsénico; H 3 AsO 3
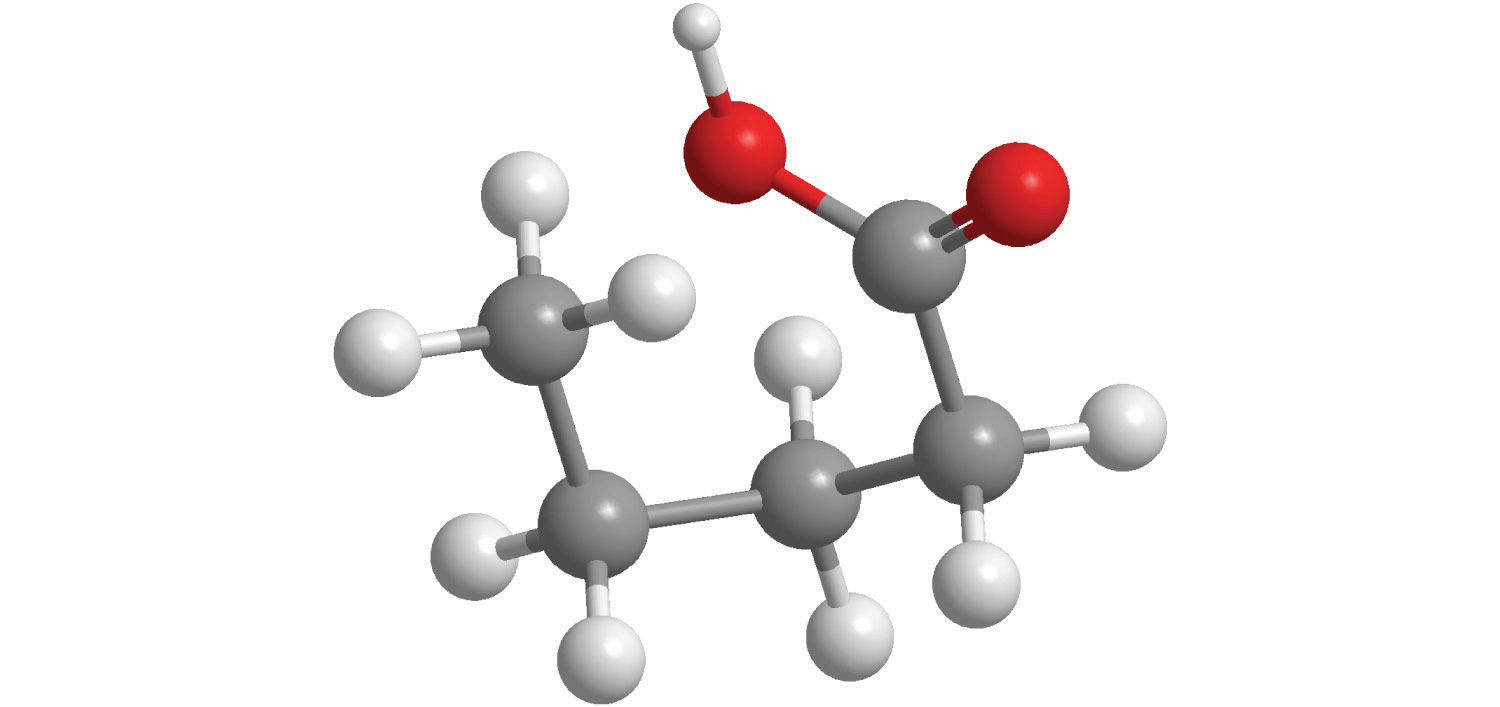
Muchos compuestos orgánicos contienen el grupo carbonilo, en el que existe un doble enlace carbono-oxígeno. En los ácidos carboxílicos, un grupo -OH está unido covalentemente al átomo de carbono del grupo carbonilo. Su fórmula general es RCO 2 H, a veces escrita como RCOOH:
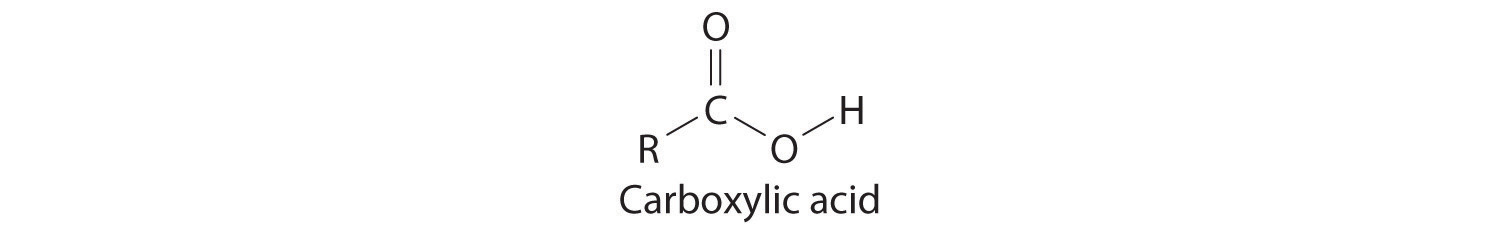
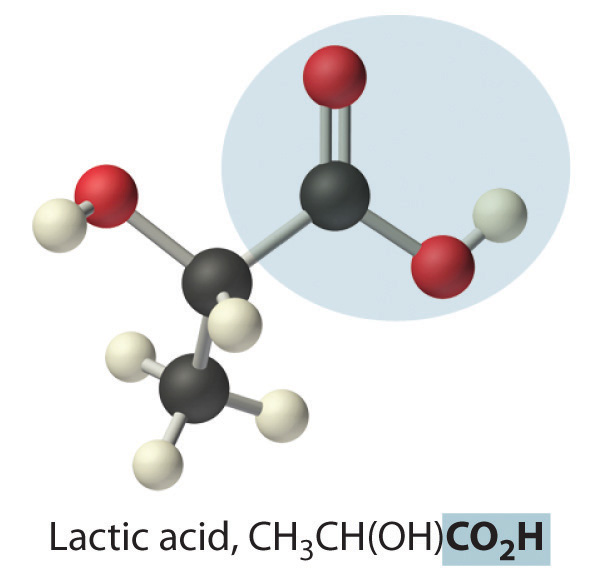
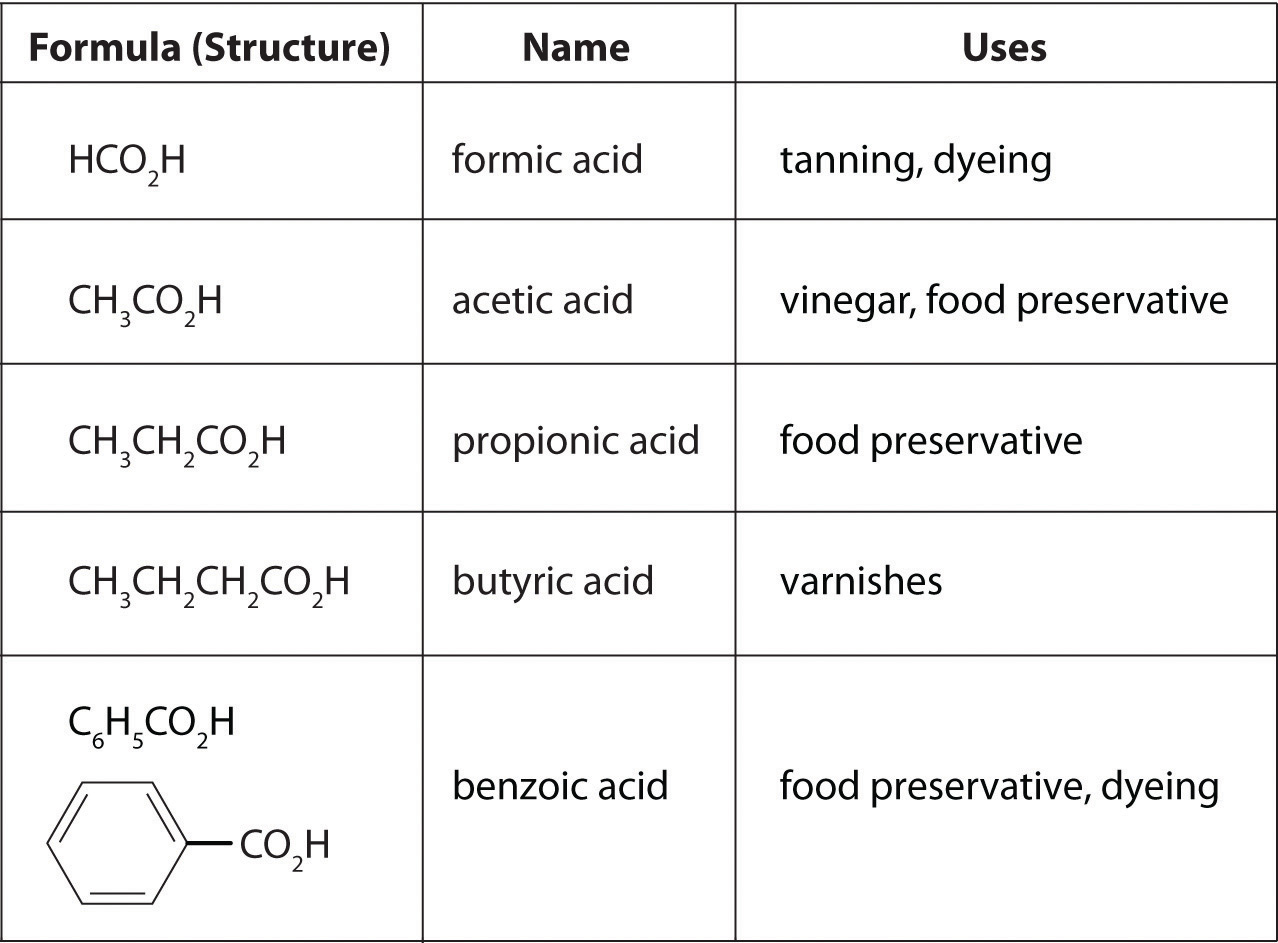
donde R puede ser un grupo alquilo, un grupo arilo o un átomo de hidrógeno. El ejemplo más simple, HCO 2 H, es el ácido fórmico, llamado así porque se encuentra en las secreciones de hormigas picantes (del latín formica, que significa “hormiga”). Otro ejemplo es el ácido acético (CH 3 CO 2 H), el cual se encuentra en el vinagre. Al igual que muchos ácidos, los ácidos carboxílicos tienden a tener olores fuertes. Por ejemplo, el ácido butírico (CH 3 CH 2 CH 2 CH 2 H), es responsable del olor a mantequilla rancia, y el olor característico de la leche agria y el vómito se debe al ácido láctico [CH 3 CH (OH) CO 2 H]. Algunos ácidos carboxílicos comunes se muestran en la Figura\(\PageIndex{2}\).
Figura\(\PageIndex{2}\) Algunos Ácidos Carboxílicos Comunes
Aunque los ácidos carboxílicos son compuestos covalentes, cuando se disuelven en agua, se disocian para producir iones H + (igual que cualquier otro ácido) e iones RCO 2 −. Obsérvese que solo el hidrógeno unido al átomo de oxígeno del grupo CO 2 se disocia para formar un ion H +. En contraste, el átomo de hidrógeno unido al átomo de oxígeno de un alcohol no se disocia para formar un ion H + cuando un alcohol se disuelve en agua. Las razones de la diferencia de comportamiento entre los ácidos carboxílicos y los alcoholes se discutirán en el Capítulo 8.
Tenga en cuenta el patrón
Solo el hidrógeno unido al átomo de oxígeno del grupo CO 2 se disocia para formar un ion H +.
Bases
Presentaremos definiciones más completas de bases en capítulos posteriores, pero prácticamente todas las bases que encuentres mientras tanto serán un compuesto iónico, como el hidróxido de sodio (NaOH) y el hidróxido de bario [Ba (OH) 2], que contienen el ion hidróxido y un catión metálico. Estos tienen la fórmula general M (OH) n. Es importante reconocer que los alcoholes, con la fórmula general ROH, son compuestos covalentes, no compuestos iónicos; en consecuencia, no se disocian en agua para formar una solución básica (que contiene iones OH −). Cuando una base reacciona con alguno de los ácidos que hemos comentado, acepta un protón (H +). Por ejemplo, el ion hidróxido (OH −) acepta un protón para formar H 2 O. Así, las bases también se conocen como aceptores de protones.
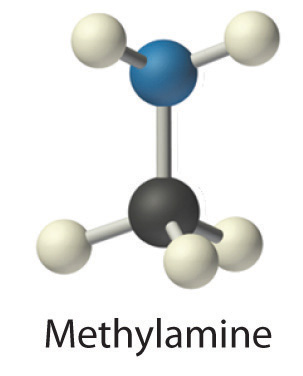
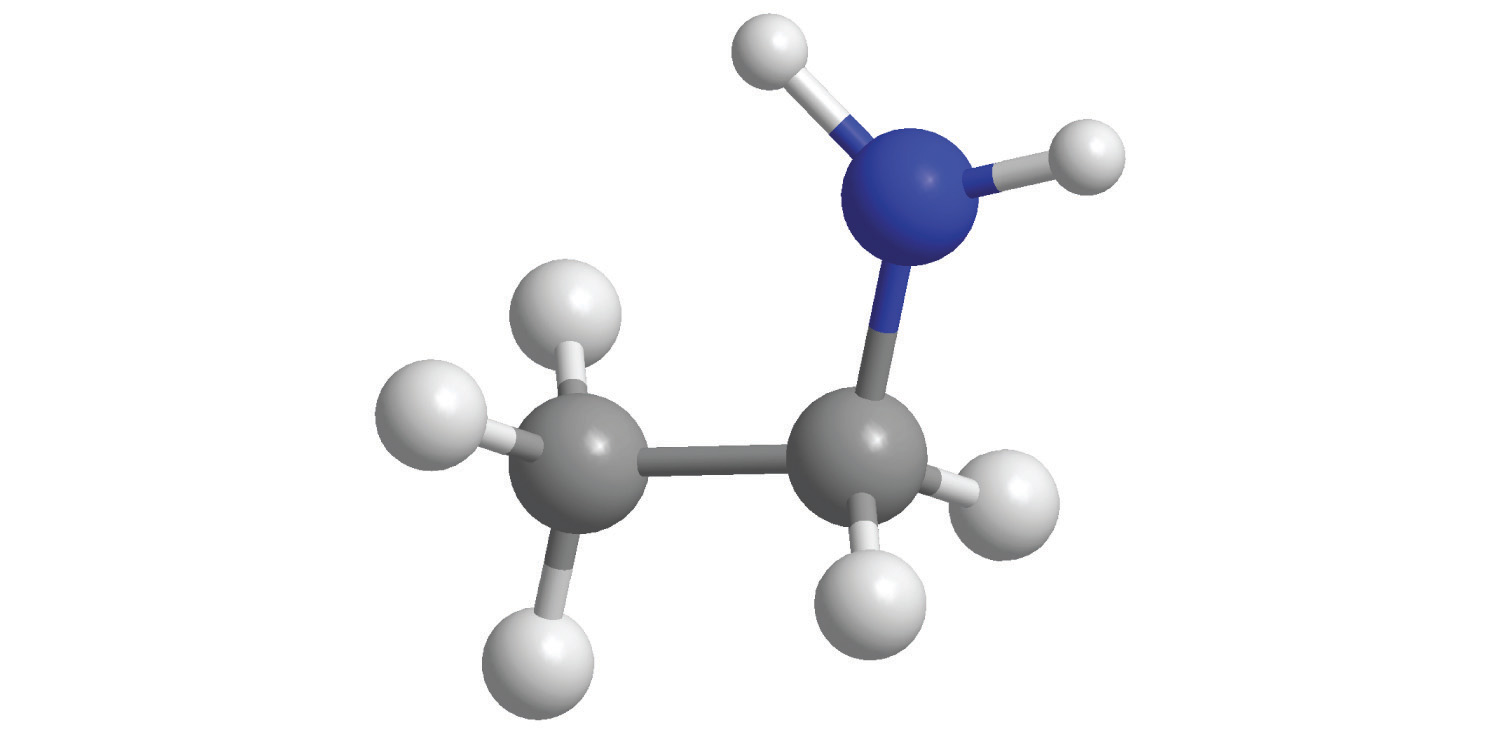
Las soluciones acuosas concentradas de amoníaco (NH 3) contienen cantidades significativas del ión hidróxido, aunque la sustancia disuelta no es principalmente hidróxido de amonio (NH 4 OH) como a menudo se indica en la etiqueta. Por lo tanto, la solución acuosa de amoníaco también es una base común. Reemplazar un átomo de hidrógeno de NH 3 por un grupo alquilo da como resultado una amina (RNH 2), que también es una base. Las aminas tienen olores picantes, por ejemplo, la metilamina (CH 3 NH 2) es uno de los compuestos responsables del mal olor asociado con el pescado en mal estado. La importancia fisiológica de las aminas se sugiere en la palabra vitamina, la cual se deriva de la frase aminas vitales. La palabra fue acuñada para describir sustancias dietéticas que fueron efectivas para prevenir el escorbuto, el raquitismo y otras enfermedades debido a que se suponía que estas sustancias eran aminas. Posteriormente, efectivamente se ha confirmado que algunas vitaminas son aminas.
Tenga en cuenta el patrón
Los hidróxidos metálicos (MOH) producen iones OH − y son bases, los alcoholes (ROH) no producen iones OH − o H + y son neutros, y los ácidos carboxílicos (RCO 2H) producen iones H + y son ácidos.
Resumen
Los ácidos comunes y los aniones poliatómicos derivados de ellos tienen sus propios nombres y reglas de nomenclatura. La nomenclatura de ácidos diferencia entre oxoácidos, en los que el ion H + está unido a un átomo de oxígeno de un ion poliatómico, y ácidos en los que el ion H + está unido a otro elemento. Los ácidos carboxílicos son una clase importante de ácidos orgánicos. El amoníaco es una base importante, al igual que sus derivados orgánicos, las aminas.
LLAVE PARA LLEVAR
- Los ácidos comunes y los aniones poliatómicos derivados de ellos tienen sus propios nombres y reglas de nomenclatura.
PROBLEMAS CONCEPTUALES
- Nombra cada ácido.
- HCl
- HBRo
- HNO 3
- H 2 SO 4
- HIO 3
- Nombra cada ácido.
- HBr
- H 2 SO 3
- HClO 3
- HCN
- H 3 PO 4
- Nombrar el ácido acuoso que corresponde a cada especie gaseosa.
- bromuro de hidrógeno
- cianuro de hidrógeno
- yoduro de hidrógeno
- Para cada fórmula estructural, escriba la fórmula condensada y el nombre del compuesto.
- Para cada fórmula estructural, escriba la fórmula condensada y el nombre del compuesto.
- Cuando cada compuesto se agrega al agua, ¿la solución resultante es ácida, neutra o básica?
- CH 3 CH 2 OH
- Mg (OH) 2
- C 6 H 5 CO 2 H
- LiOh
- C 3 H 7 CO 2 H
- H 2 SO 4
- Dibuja la estructura del ejemplo más simple de cada tipo de compuesto.
- alcano
- alqueno
- alquino
- hidrocarburo aromático
- alcohol
- ácido carboxílico
- amina
- cicloalcano
- Identificar la clase de compuesto orgánico representado por cada compuesto.
- CH 3 CH 2 OH
- HCCH

- C 3 H 7 NH 2
- CH 3 CH=CHCH 2 CH 3

- Identificar la clase de compuesto orgánico representado por cada compuesto.



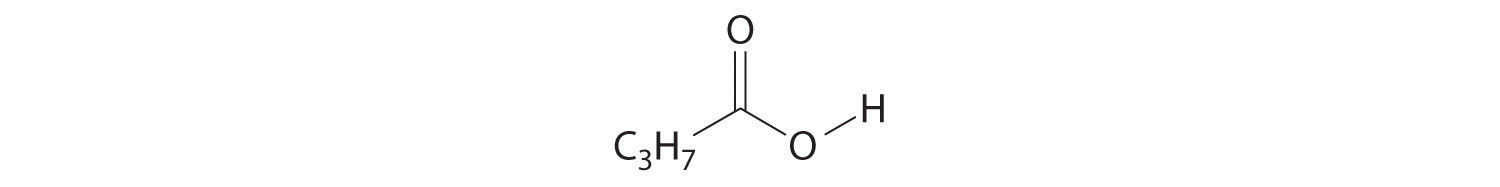
- CH 3 C=CH
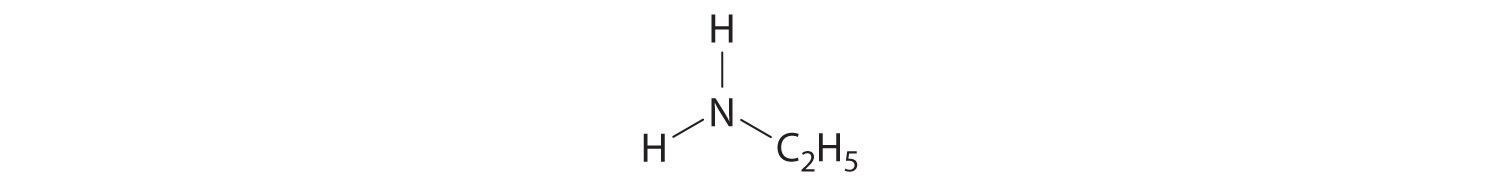
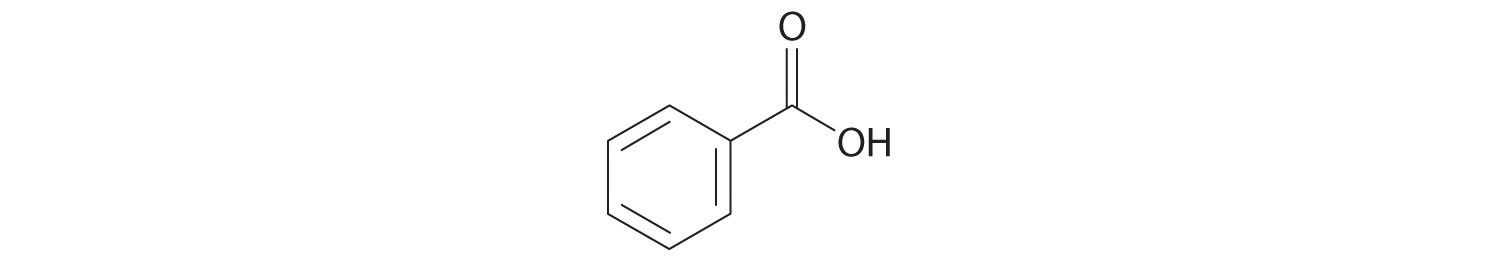
PROBLEMAS NUMÉRICOS
- Escribe la fórmula para cada compuesto.
- ácido hipocloroso
- ácido perbromico
- ácido bromhídrico
- ácido sulfuroso
- perbromato de sodio
- Escribe la fórmula para cada compuesto.
- ácido yodhídrico
- sulfuro de hidrógeno
- ácido fosforoso
- ácido perclórico
- hipobromita de calcio
- Nombrar cada compuesto.
- HBr
- H 2 SO 3
- HCN
- HClO 4
- NaHSO 4
- Nombrar cada compuesto.
- H 2 SO 4
- HNO 2
- K 2 HPO 4
- H 3 PO 3
- Ca (H 2 PO 4) 2·H 2 O