3.1: Las masas molares y molares
- Page ID
- 78356
- Calcular la masa molecular de un compuesto covalente y la masa de fórmula de un compuesto iónico y calcular el número de átomos, moléculas o unidades de fórmula en una muestra de una sustancia.
Como aprendiste en el Capítulo 1, el número de masa es la suma de los números de protones y neutrones presentes en el núcleo de un átomo. El número de masa es un número entero que es aproximadamente igual al valor numérico de la masa atómica. Aunque el número de masa es sin unidades, se le asignan unidades llamadas unidades de masa atómica (amu). Debido a que una molécula o un ion poliatómico es un conjunto de átomos cuyas identidades se dan en su fórmula molecular o iónica, podemos calcular la masa atómica promedio de cualquier molécula o ion poliatómico a partir de su composición sumando las masas de los átomos constituyentes. La masa promedio de un ion monatómico es la misma que la masa promedio de un átomo del elemento porque la masa de electrones es tan pequeña que es insignificante en la mayoría de los cálculos.
Masas moleculares y de fórmula
La masa molecular de una sustancia es la suma de las masas promedio de los átomos en una molécula de una sustancia. Se calcula sumando las masas atómicas de los elementos en la sustancia, cada uno multiplicado por su subíndice (escrito o implícito) en la fórmula molecular. Debido a que las unidades de masa atómica son unidades de masa atómica, las unidades de masa molecular también son unidades de masa atómica. El procedimiento para calcular las masas moleculares se ilustra en el Ejemplo 1.
Calcular la masa molecular del etanol, cuya fórmula estructural condensada es CH 3 CH 2 OH. Entre sus muchos usos, el etanol es un combustible para motores de combustión interna.
Dado: molécula
Preguntado por: masa molecular
Estrategia:
A Determinar el número de átomos de cada elemento en la molécula.
B Obtener las masas atómicas de cada elemento de la tabla periódica y multiplicar la masa atómica de cada elemento por el número de átomos de ese elemento.
C Sumar las masas para dar la masa molecular.
Solución
A La fórmula molecular del etanol puede escribirse de tres maneras diferentes: CH 3 CH 2 OH (que ilustra la presencia de un grupo etilo, CH 3 CH 2 -, y un grupo -OH), C 2H 5 OH y C 2H 6 O; todos muestran que el etanol tiene dos átomos de carbono, seis átomos de hidrógeno y un átomo de oxígeno.
B Tomando las masas atómicas de la tabla periódica, obtenemos
\ [\ comenzar {matriz}
2\ veces\; atómica\; masa\; de\; carbono = 2\;\ cancelar {átomos}\ dfrac {12.011\; amu} {\ cancelar {átomo}} =24.022\; amu\\
6\ veces\; atómica\; masa\; de\; hidrógeno = 6\;\ cancelar {átomos}\ dfrac {1.0079\; amu} {\ cancel {átomo}} =6.0474\; amu\\
1\ veces\; atómica\; masa\; de\; oxígeno = 1\;\ cancelar {átomos}\ dfrac {15.994\; amu} {\ cancelar {átomo}} =15.994\; amu
\ final {matriz}\ notag\]
C Al sumar las masas se obtiene la masa molecular:
24.022 amu + 6.0474 amu + 15.9994 amu = 46.069 amu
Alternativamente, podríamos haber utilizado conversiones de unidades para alcanzar el resultado en un solo paso, como se describe en Habilidades esenciales 2 (Sección 3.7):
\[ \left [ 2\; \cancel{atoms\; C} \left ( \dfrac{12.011\; amu}{1 \cancel{atom\;C}} \right ) \right ]+ \left [ 6\; \cancel{atoms\; H} \left ( \dfrac{1.0079\; amu}{1 \cancel{atom\;H}} \right ) \right ]+ \left [ 1\; \cancel{atoms\; O} \left ( \dfrac{15.994\; amu}{1 \cancel{atom\;C}} \right ) \right ]= 46.069 \notag \]
El mismo cálculo también se puede hacer en formato tabular, lo que es especialmente útil para moléculas más complejas:
| Átomos | Pesos atómicos |
|---|---|
| 2C | (2 átomos) (12.011 amu/átomo) = 24.022 amu |
| 6H | (6 átomos) (1.0079 amu/átomo) = 6.0474 amu |
| 1O | (1 átomos) (15.9994 amu/átomo) = 15.9994 amu |
| C 2 H 6 O | masa molecular de etanol = 46.069 amu |
Calcular la masa molecular del triclorofluorometano, también conocido como Freón-11, cuya fórmula estructural condensada es CCl 3 F. Hasta hace poco, se usaba como refrigerante. La estructura de una molécula de Freón-11 es la siguiente:
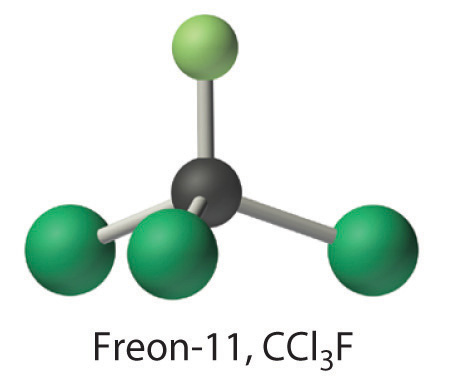
- Responder
-
137.368 amu
A diferencia de las moléculas, que tienen enlaces covalentes, los compuestos iónicos no tienen una unidad molecular fácilmente identificable. Entonces, para los compuestos iónicos usamos la masa de fórmula (también llamada masa de fórmula empírica) del compuesto en lugar de la masa molecular. La masa de fórmula es la suma de las masas atómicas de todos los elementos de la fórmula empírica, cada uno multiplicado por su subíndice (escrito o implícito). Es directamente análogo a la masa molecular de un compuesto covalente. Una vez más, las unidades son unidades de masa atómica.
Tenga en cuenta el patrón
La masa atómica, la masa molecular y la masa de fórmula tienen todas las mismas unidades: unidades de masa atómica.
Calcular la masa de fórmula de Ca 3 (PO 4) 2, comúnmente llamada fosfato de calcio. Este compuesto es la principal fuente de calcio que se encuentra en la leche bovina.
Dado: compuesto iónico
Preguntado por: masa de fórmula
Estrategia:
A Determinar el número de átomos de cada elemento en la fórmula empírica.
B Obtener las masas atómicas de cada elemento de la tabla periódica y multiplicar la masa atómica de cada elemento por el número de átomos de ese elemento.
C Sumar las masas para dar la masa de fórmula.
Solución
A La fórmula empírica —CA 3 (PO 4) 2 — indica que la unidad eléctricamente neutra más simple de fosfato de calcio contiene tres iones Ca 2+ y dos iones PO 4 3−. La masa de fórmula de esta unidad molecular se calcula sumando las masas atómicas de tres átomos de calcio, dos átomos de fósforo y ocho átomos de oxígeno.
B Tomando masas atómicas de la tabla periódica, obtenemos
\( atomic\; mass\; of\; calcium=3\cancel{atoms}\left ( \dfrac{40.078\; amu}{\cancel{atom}} \right )=120.234\; amu \)
\( atomic\; mass\; of\; phosphorus=2\cancel{atoms}\left ( \dfrac{30.973761\; amu}{\cancel{atom}} \right )=61.947522\; amu \)
\( atomic\; mass\; of\; oxygen=8\cancel{atoms}\left ( \dfrac{15.9994\; amu}{\cancel{atom}} \right )=127.9952\; amu \)
C Al sumar las masas se obtiene la masa de fórmula de Ca 3 (PO 4) 2:
\[ 120.234\; amu + 61.947522\; amu + 127.9952\; amu = 310.177\; amu \]
También podríamos encontrar la masa de fórmula de Ca 3 (PO 4) 2 en un solo paso usando conversiones unitarias o un formato tabular:
\( \left [3\; atoms \; Ca\left ( \dfrac{40.078\; amu}{1\; atom\; Ca} \right ) \right ] + \left [2\; atoms\; P\left ( \dfrac{30.973761\; amu}{1\; atom\; P} \right ) \right ]+ \left [8\; atoms \; O\left ( \dfrac{15.9994\; amu}{1\; atom\; O} \right ) \right ]=310.177\; amu \notag \)
| Átomos | Pesos atómicos |
|---|---|
| 3Ca | (3 átomos) (40.078 amu/átomo) = 24.022 amu |
| 2P | (2 átomos) (30.973761 amu/átomo) = 6.0474 amu |
| 8O | (8 átomos) (15.9994 amu/átomo) = 127.9952 amu |
| Ca 3 P 2 O 8 | masa de fórmula de Ca 3 (PO 4) = 310.177 2 amu |
Calcular la masa de fórmula de Si 3 N 4, comúnmente llamada nitruro de silicio. Es un material extremadamente duro e inerte que se utiliza para fabricar herramientas de corte para el mecanizado de aleaciones de metales duros.
- Responder
-
140.29 amu
El Topo
En el Capítulo 1, describimos la teoría de Dalton de que cada compuesto químico tiene una combinación particular de átomos y que las proporciones de los números de átomos de los elementos presentes suelen ser números enteros pequeños. También describimos la ley de proporciones múltiples, que establece que las proporciones de las masas de elementos que forman una serie de compuestos son números enteros pequeños. El problema para Dalton y otros químicos tempranos fue descubrir la relación cuantitativa entre el número de átomos en una sustancia química y su masa. Debido a que las masas de los átomos individuales son tan minúsculas (del orden de 10 −23 g/átomo), los químicos no miden la masa de átomos o moléculas individuales. En el laboratorio, por ejemplo, las masas de compuestos y elementos utilizados por los químicos suelen oscilar entre miligramos y gramos, mientras que en la industria, los químicos se compran y venden en kilogramos y toneladas. Para analizar las transformaciones que ocurren entre átomos o moléculas individuales en una reacción química, es por lo tanto absolutamente esencial que los químicos sepan cuántos átomos o moléculas están contenidos en una cantidad medible en el laboratorio, una masa de muestra dada. La unidad que proporciona este enlace es el mole (mol), del latín moles, que significa “pila” o “montón” (¡no del pequeño animal subterráneo!).
Muchos artículos familiares se venden en cantidades numéricas que tienen nombres inusuales. Por ejemplo, las latas de refresco vienen en un paquete de seis, los huevos se venden por docena (12), y los lápices a menudo vienen en bruto (12 docenas, o 144). Las hojas de papel de impresora se empaquetan en resmas de 500, un número aparentemente grande. Los átomos son tan pequeños, sin embargo, que hasta 500 átomos son demasiado pequeños para ver o medir por las técnicas más comunes. Cualquier masa fácilmente medible de un elemento o compuesto contiene un número extraordinariamente grande de átomos, moléculas o iones, por lo que se necesita una unidad numérica extraordinariamente grande para contarlos. El mole se utiliza para este propósito.
Un mol se define como la cantidad de una sustancia que contiene el número de átomos de carbono en exactamente 12 g de carbono-12 isotópicamente puro. Según las mediciones experimentales más recientes, esta masa de carbono-12 contiene 6.022142 × 10 23 átomos, pero para la mayoría de los propósitos 6.022 × 10 23 proporciona un número adecuado de cifras significativas. Así como 1 mol de átomos contiene 6.022 × 10 23 átomos, 1 mol de huevos contiene 6.022 × 10 23 huevos. El número en un topo se llama número de Avogadro, después del científico italiano del siglo XIX que propuso por primera vez una relación entre los volúmenes de gases y el número de partículas que contienen.
No es obvio por qué los huevos vienen en docenas en lugar de 10s o 14s, o por qué una resma de papel contiene 500 hojas en lugar de 400 o 600. La definición de un topo, es decir, la decisión de basarlo en 12 g de carbono-12, también es arbitraria. El punto importante es que 1 mol de carbono —o de cualquier otra cosa, ya sean átomos, discos compactos o casas— siempre tiene el mismo número de objetos: 6.022 × 10 23.
Tenga en cuenta el patrón
Un lunar siempre tiene el mismo número de objetos: 6.022 × 10 23.
Para apreciar la magnitud del número de Avogadro, considera un topo de centavos. Apilado verticalmente, un mol de centavos tendría 4.5 × 10 17 mi de altura, o casi seis veces el diámetro de la galaxia de la Vía Láctea. Si un mol de centavos se distribuyera equitativamente entre toda la población de la Tierra, cada persona obtendría más de un billón de dólares. Claramente, el lunar es tan grande que solo es útil para medir objetos muy pequeños, como los átomos.
El concepto de mol nos permite contar un número específico de átomos y moléculas individuales pesando cantidades medibles de elementos y compuestos. Para obtener 1 mol de átomos de carbono-12, pesaríamos 12 g de carbono-12 isotópicamente puro. Debido a que cada elemento tiene una masa atómica diferente, sin embargo, un mol de cada elemento tiene una masa diferente, a pesar de que contiene el mismo número de átomos (6.022 × 10 23). Esto es análogo al hecho de que una docena de huevos extra grandes pesan más de una docena de huevos pequeños, o que el peso total de 50 humanos adultos es mayor que el peso total de 50 niños. Por la forma en que se define el mol, para cada elemento el número de gramos en un mol es el mismo que el número de unidades de masa atómica en la masa atómica del elemento. Por ejemplo, la masa de 1 mol de magnesio (masa atómica = 24.305 amu) es de 24.305 g Debido a que la masa atómica del magnesio (24.305 amu) es ligeramente más del doble que la de un átomo de carbono-12 (12 amu), la masa de 1 mol de átomos de magnesio (24.305 g) es ligeramente más del doble que la de 1 mol de carbono-12 (12 g). De igual manera, la masa de 1 mol de helio (masa atómica = 4.002602 amu) es de 4.002602 g, que es aproximadamente un tercio de la de 1 mol de carbono-12. Usando el concepto del mol, ahora podemos reafirmar la teoría de Dalton: 1 mol de un compuesto se forma combinando elementos en cantidades cuyas proporciones molares son números enteros pequeños. Por ejemplo, 1 mol de agua (H 2 O) tiene 2 moles de átomos de hidrógeno y 1 mol de átomos de oxígeno.
Masa molar
La masa molar de una sustancia se define como la masa en gramos de 1 mol de esa sustancia. Un mol de carbono-12 isotópicamente puro tiene una masa de 12 g. Para un elemento, la masa molar es la masa de 1 mol de átomos de ese elemento; para un compuesto molecular covalente, es la masa de 1 mol de moléculas de ese compuesto; para un compuesto iónico, es la masa de 1 mol de unidades de fórmula. Es decir, la masa molar de una sustancia es la masa (en gramos por mol) de 6.022 × 10 23 átomos, moléculas, o unidades de fórmula de esa sustancia. En cada caso, el número de gramos en 1 mol es el mismo que el número de unidades de masa atómica que describen la masa atómica, la masa molecular o la masa de fórmula, respectivamente.
Tenga en cuenta el patrón
La masa molar de cualquier sustancia es su masa atómica, masa molecular o masa de fórmula en gramos por mol.
La tabla periódica enumera la masa atómica de carbono como 12.011 amu; la masa molar promedio de carbono, la masa de 6.022 × 10 23 átomos de carbono, es por lo tanto 12.011 g/mol:
| Sustancia (fórmula) | Masa atómica, molecular o de fórmula (amu) | Masa molar (g/mol) |
|---|---|---|
| carbono (C) | 12.011 (masa atómica) | 12.011 |
| etanol (C 2 H 5 OH) | 46.069 (masa molecular) | 46.069 |
| fosfato de calcio [Ca 3 (PO 4) 2] | 310.177 (masa de fórmula) | 310.177 |
La masa molar del carbono natural es diferente de la del carbono-12 y no es un número entero porque el carbono se presenta como una mezcla de carbono-12, carbono-13 y carbono-14. Un mol de carbono todavía tiene 6.022 × 10 23 átomos de carbono, pero 98.89% de esos átomos son carbono-12, 1.11% son carbono-13 y una traza (aproximadamente 1 átomo en 10 12) son carbono-14. (Para mayor información, ver Sección 1.7.) De igual manera, la masa molar de uranio es de 238.03 g/mol, y la masa molar de yodo es de 126.90 g/mol. Cuando tratamos con elementos como el yodo y el azufre, que ocurren como una molécula diatómica (I 2) y una molécula poliatómica (S 8), respectivamente, la masa molar generalmente se refiere a la masa de 1 mol de átomos del elemento, en este caso I y S, no a la masa de 1 mol de moléculas del elemento (I 2 y S 8).
La masa molar de etanol es la masa de etanol (C 2 H 5 OH) que contiene 6.022 × 10 23 moléculas de etanol. Como calculaste en el Ejemplo 1, la masa molecular del etanol es de 46.069 amu. Debido a que 1 mol de etanol contiene 2 mol de átomos de carbono (2 × 12.011 g), 6 mol de átomos de hidrógeno (6 × 1.0079 g) y 1 mol de átomos de oxígeno (1 × 15.9994 g), su masa molar es 46.069 g/mol. De igual manera, la masa de fórmula de fosfato de calcio [Ca 3 (PO 4) 2] es de 310.177 amu, por lo que su masa molar es de 310.177 g/mol. Esta es la masa de fosfato de calcio que contiene 6.022 × 10 23 unidades de fórmula. La figura\(\PageIndex{1}\) muestra muestras que contienen precisamente una masa molar de varias sustancias comunes.
Figura\(\PageIndex{1}\) Muestras de 1 Mol de Algunas Sustancias Comunes (CC-BY-SA-NC-4.0 Los cambios químicos, Marta Espina Fernández)

El mol es la base de la química cuantitativa. Proporciona a los químicos una manera de convertir fácilmente entre la masa de una sustancia y el número de átomos individuales, moléculas o unidades de fórmula de esa sustancia. Por el contrario, permite a los químicos calcular la masa de una sustancia necesaria para obtener un número deseado de átomos, moléculas o unidades de fórmula. Por ejemplo, para convertir moles de una sustancia en masa, usamos la relación
\[ (moles)(molar \; mass) → mass \tag{7.1.1} \]
o, más concretamente,
\( \cancel{moles}\left ( \dfrac{grams}{\cancel{mole}} \right )=grams \)
Por el contrario, para convertir la masa de una sustancia en moles, utilizamos
\( moles\left ( \dfrac{grams}{mole} \right ) = grams \)
\( \left ( \dfrac{mass}{molar\; mass} \right )\rightarrow moles \tag{7.2.2}\)
\( \left ( \dfrac{grams}{grams/mole} \right )=grams\left ( \dfrac{mole}{grams} \right )=moles \)
Asegúrese de prestar atención a las unidades al convertir entre masa y moles.
La Figura\(\PageIndex{2}\) es un diagrama de flujo para convertir entre masa; el número de moles; y el número de átomos, moléculas o unidades de fórmula. El uso de estas conversiones se ilustra en el Ejemplo 3 y en el Ejemplo 4.
Figura\(\PageIndex{2}\) A Diagrama de flujo para la conversión entre la masa; el número de moles; y el número de átomos, moléculas o unidades de fórmula

Para 35.00 g de etilenglicol (HOCH 2 CH 2 OH), que se utiliza en tintas para bolígrafos, calcule el número de
- lunares.
- moléculas.
Dado: masa y fórmula molecular
Preguntado por: número de moles y número de moléculas
Estrategia:
A Utilizar la fórmula molecular del compuesto para calcular su masa molecular en gramos por mol.
B Convertir de masa a moles dividiendo la masa dada por la masa molar del compuesto.
C Convertir de moles a moléculas multiplicando el número de moles por el número de Avogadro.
Solución
-
A La masa molecular del etilenglicol se puede calcular a partir de su fórmula molecular usando el método ilustrado en el Ejemplo 1:
\ [\ begin {array} {rrr}
2\ mathrm {C} & (2\ text {atoms}) (12.011\ mathrm {amu}/\ text {atom}) & =24.022\ mathrm {amu}\\
6\ mathrm {H} & (6\ texto {átomos}) (1.0079\ mathrm {amu}/\ texto {átomo}) & =6.0474\ mathrm {amu}\\
+2\ mathrm {O} & (2\ texto {átomos}) (15.9994\ mathrm {amu}/\ texto {átomo}) & =31.9988\ mathrm {amu}\\
\ hline\ mathrm {C} _ _ {2}\ mathrm {H} _ {6}\ mathrm {O} _ {2} &\ text {masa molecular de etilenglicol} & =62.068\ mathrm {amu}
\ end {array}
\]
Átomos Pesos atómicos 2C (2 átomos) (12.011 amu/átomo) = 24.022 amu 6H (6 átomos) (1.0079 amu/átomo) = 6.0474 amu 2O (2 átomos) (15.9994 amu/átomo) = 31.9988 amu C 2 H 6 O masa molecular de etanol = 62.068 amu
La masa molar de etilenglicol es de 62.068 g/mol. - B El número de moles de etilenglicol presentes en 35.00 g se puede calcular dividiendo la masa (en gramos) por la masa molar (en gramos por mol):
\ [
\ dfrac {\ text {masa de etilenglicol} (\ mathrm {g})} {\ text {masa molar} (\ mathrm {g}/\ mathrm {mol})} =\ text {moles etilenglicol (mol)}
\]Entonces
\ [
35.00\ texto {g etilenglicol}\ izquierda (\ frac {1\ texto {mol etilenglicol}} {62.068\ texto {g etilenglicol}}\ derecha) =0.5639\ texto {mol etilenglicol}
\]Siempre es una buena idea estimar la respuesta antes de hacer el cálculo real. En este caso, la masa dada (35.00 g) es menor que la masa molar, por lo que la respuesta debe ser menor a 1 mol. La respuesta calculada (0.5639 mol) es de hecho menor a 1 mol, por lo que probablemente no hayamos cometido un error mayor en los cálculos.
- C Para calcular el número de moléculas en la muestra, multiplicamos el número de moles por el número de Avogadro:
\ [
\ begin {aligned}
&\ text {moléculas de etilenglicol} =0.5639\ texto {mol}\ izquierda (\ dfrac {6.022\ times 10^ {23}\ text {moléculas}} {1\ texto {mol}}\ derecha)\\
&=3.396\ times 10^ {23}\ text {moléculas}
\ end {alineado}
\]Debido a que estamos tratando con algo más de 0.5 mol de etilenglicol, esperamos que el número de moléculas presentes sea ligeramente más de la mitad del número de Avogadro, o un poco más de 3 × 10 23 moléculas, lo que efectivamente es el caso.
Para 75.0 g de CCl 3 F (Freón-11), calcule el número de
- lunares.
- moléculas.
- Responder
-
a. 0.546 mol
b. 3.29 × 10 23 moléculas
Calcular la masa de 1.75 mol de cada compuesto.
- S 2 Cl 2 (nombre común: monocloruro de azufre; nombre sistemático: dicloruro de disulfur)
- Ca (ClO) 2 (hipoclorito de calcio)
Dado: número de moles y fórmula molecular o empírica
Preguntado por: misa
Estrategia:
A Calcular la masa molecular del compuesto en gramos a partir de su fórmula molecular (si es covalente) o fórmula empírica (si es iónica).
B Convertir de moles a masa multiplicando los moles del compuesto dados por su masa molar.
Solución
Comenzamos calculando la masa molecular de S 2 Cl 2 y la masa de fórmula de Ca (ClO) 2.
A La masa molar de S 2 Cl 2 se obtiene de su masa molecular de la siguiente manera:
| Átomos | Pesos atómicos |
|---|---|
| 2S | (2 átomos) (32.065 amu/átomo) = 64.130 amu |
| 2Cl | (2 átomos) (35.353 amu/átomo) = 70.906 amu |
| S 2 Cl 2 | masa molecular de S 2 Cl 2 = 135.036 amu |
La masa molar de S 2 Cl 2 es 135.036 g/mol.
B La masa de 1.75 mol de S 2 Cl 2 se calcula de la siguiente manera:
\( moles\; S{_{2}}Cl_{2} \left [molar\; mass \dfrac{g}{mol} \right ]= mass\; S{_{2}}Cl_{2} \)
\( 1.75\; mol\; S{_{2}}Cl_{2}\left ( \dfrac{135.036\; g\; S{_{2}}Cl_{2}}{1\;mol\;S{_{2}}Cl_{2}} \right )=236\;g\; S{_{2}}Cl_{2} \)
A La masa de fórmula de Ca (ClO) 2 se obtiene de la siguiente manera:
| Átomos | Pesos atómicos |
|---|---|
| 1Ca | (1 átomo) (40.078 amu/átomo) = 40.078 amu |
| 2Cl | (2 átomos) (35.453 amu/átomo) = 70.906 amu |
| 2O | (2 átomos) (15.9994 amu/átomo) = 31.9988 amu |
| Ca (ClO) 2 | masa de fórmula de Ca (ClO) 2 = 142.983 amu |
La masa molar de Ca (ClO) 2 142.983 g/mol.
B La masa de 1.75 mol de Ca (ClO) 2 se calcula de la siguiente manera:
\( moles\; Ca\left ( ClO \right )_{2}\left [ \dfrac{molar\; mass\; Ca\left ( ClO \right )_{2}}{1\; mol\; Ca\left ( ClO \right )_{2}} \right ]=mass\; Ca\left ( ClO \right )_{2} \)
\( 1.75\; mol\; Ca\left ( ClO \right )_{2}\left [ \dfrac{142.983\; g Ca\left ( ClO \right )_{2}}{1\; mol\; Ca\left ( ClO \right )_{2}} \right ]=250.\; g\; Ca\left ( ClO \right )_{2} \)
Debido a que 1.75 mol es menor a 2 mol, la cantidad final en gramos en ambos casos debe ser inferior al doble de la masa molar, que es.
Calcular la masa de 0.0122 mol de cada compuesto.
- Si 3 N 4 (nitruro de silicio), utilizado como rodamientos y rodillos
- (CH 3) 3 N (trimetilamina), un inhibidor de la corrosión
- Responder
-
- 1.71 g
- 0.721 g
Resumen
La masa molecular y la masa de fórmula de un compuesto se obtienen sumando las masas atómicas de los átomos presentes en la fórmula molecular o fórmula empírica, respectivamente; las unidades de ambas son unidades de masa atómica (amu). El mol es una unidad utilizada para medir el número de átomos, moléculas o (en el caso de compuestos iónicos) unidades de fórmula en una masa dada de una sustancia. El mol se define como la cantidad de sustancia que contiene el número de átomos de carbono en exactamente 12 g de carbono-12 y consiste en el número de Avogadro (6.022 × 10 23) de átomos de carbono-12. La masa molar de una sustancia se define como la masa de 1 mol de esa sustancia, expresada en gramos por mol, y es igual a la masa de 6.022 × 10 23 átomos, moléculas o unidades de fórmula de esa sustancia.
LLAVE PARA LLEVAR
- Para analizar las transformaciones químicas, es esencial utilizar una unidad de medida estandarizada llamada mole.
PROBLEMAS CONCEPTUALES
Por favor, asegúrese de estar familiarizado con los temas tratados en Habilidades Esenciales 2 (Sección 3.7) antes de proceder a los Problemas Conceptuales.
- Describir la relación entre una unidad de masa atómica y un gramo.
- ¿Es correcto decir que el etanol tiene una masa de fórmula de 46? ¿Por qué o por qué no?
- Si 2 mol de sodio reaccionan completamente con 1 mol de cloro para producir cloruro de sodio, ¿significa esto que 2 g de sodio reaccionan completamente con 1 g de cloro para dar el mismo producto? Explica tu respuesta.
- Construye un diagrama de flujo para mostrar cómo calcularías el número de moles de silicio en una muestra de 37.0 g de ortoclasa (KalSi 3 O 8), un mineral utilizado en la fabricación de porcelana.
- Construye un diagrama de flujo para mostrar cómo calcularías el número de moles de nitrógeno en una muestra de 22.4 g de nitroglicerina que contiene 18.5% de nitrógeno en masa.
Contestar
-
A = %N por masa, expresado como decimal
B = 1masa molar de nitrógeno en g
g Nitroglicerina−→×Agn−→×Bmol N
PROBLEMAS NUMÉRICOS
Por favor, asegúrese de estar familiarizado con los temas tratados en Habilidades Esenciales 2 (Sección 3.7) antes de proceder a los Problemas Numéricos.
- Derivar una expresión que relaciona el número de moléculas en una muestra de una sustancia con su masa y masa molecular.
- Calcular la masa molecular o la masa de fórmula de cada compuesto.
- KCl (cloruro de potasio)
- NaCN (cianuro de sodio)
- H 2 S (sulfuro de hidrógeno)
- NaN 3 (azida sódica)
- H 2 CO 3 (ácido carbónico)
- K 2 O (óxido de potasio)
- Al (NO 3) 3 (nitrato de aluminio)
- Cu (ClO 4) 2 [perclorato de cobre (II)]
- Calcular la masa molecular o la masa de fórmula de cada compuesto.
- V 2 O 4 (óxido de vanadio (IV))
- SiO 3 (silicato de calcio)
- BioCL (oxicloruro de bismuto)
- CH 3 COOH (ácido acético)
- Ag 2 SO 4 (sulfato de plata)
- Na 2 CO 3 (carbonato de sodio)
- (CH 3) 2 CHOH (alcohol isopropílico)
- Calcular la masa molar de cada compuesto.
- Calcular la masa molar de cada compuesto.
- Para cada compuesto, escriba la fórmula condensada, nombre el compuesto y dé su masa molar.
- Para cada compuesto, escriba la fórmula condensada, nombre el compuesto y dé su masa molar.
- Calcular el número de moles en 5.00 × 10 2 g de cada sustancia. ¿Cuántas moléculas o unidades de fórmula están presentes en cada muestra?
- CaO (lima)
- CaCo 3 (tiza)
- C 12 H 22 O 11 [sacarosa (azúcar de caña)]
- NaOCl (lejía)
- CO 2 (hielo seco)
- Calcular la masa en gramos de cada muestra.
- 0.520 mol de N 2 O 4
- 1.63 mol de C 6 H 4 Br 2
- 4.62 mol de (NH 4) 2 SO 3
- Dar el número de moléculas o unidades de fórmula en cada muestra.
- 1.30 × 10 −2 mol de SCl 2
- 1.03 mol de N 2 O 5
- 0.265 mol de Ag 2 Cr 2 O 7
- Dar el número de moles en cada muestra.
- 9.58 × 10 26 moléculas de Cl 2
- 3.62 × 10 27 unidades de fórmula de KCl
- 6.94 × 10 28 unidades de fórmula de Fe (OH) 2
- Las soluciones de yodo se utilizan como antisépticos y desinfectantes. ¿Cuántos átomos de yodo corresponden a 11.0 g de yodo molecular (I 2)?
- ¿Cuál es el número total de átomos en cada muestra?
- 0.431 mol de Li
- 2.783 mol de metanol (CH 3 OH)
- 0.0361 mol de CoCo 3
- 1.002 mol de SeBr 2 O
- ¿Cuál es el número total de átomos en cada muestra?
- 0.980 mol de Na
- 2.35 mol de O 2
- 1.83 mol de Ag 2 S
- 1.23 mol de propano (C 3 H 8)
- ¿Cuál es el número total de átomos en cada muestra?
- 2.48 g de HBr
- 4.77 g de CS 2
- 1.89 g de NaOH
- 1.46 g de Src 2 O 4
- Decide si cada afirmación es verdadera o falsa y explica tu razonamiento.
- Hay más moléculas en 0.5 mol de Cl 2 que en 0.5 mol de H 2.
- Un mol de H 2 tiene 6.022 × 10 23 átomos de hidrógeno.
- La masa molecular de H 2 O es de 18.0 amu.
- La masa de fórmula del benceno es de 78 amu.
- Complete la siguiente tabla.
Sustancia Masa (g) Número de lunares Número de moléculas o unidades de fórmula Número de átomos o iones MgCl 2 37.62 AgnO 3 2.84 BH 4 Cl 8.93 × 10 25 K 2 S 7.69 × 10 26 H 2 SO 4 1.29 C 6 H 14 11.84 HClO 3 2.45 × 10 26 - Dar la masa de fórmula o la masa molecular de cada sustancia.
- PbClF
- Cu 2 P 2 O 7
- Biono 3
- Tl 2 SeO 4
- Dar la masa de fórmula o la masa molecular de cada sustancia.
- MoCl 5
- B 2 O 3
- UO 2 CO 3
- NH 4 UO 2 ASo 4