3.2: Determinación de fórmulas empíricas y moleculares
- Page ID
- 78362
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Determinar la fórmula empírica de un compuesto a partir de su composición en masa.
- Derivar la fórmula molecular de un compuesto a partir de su fórmula empírica.
Cuando un nuevo compuesto químico, como un nuevo farmacéutico potencial, se sintetiza en el laboratorio o se aísla de una fuente natural, los químicos determinan su composición elemental, su fórmula empírica y su estructura para comprender sus propiedades. En esta sección, nos enfocamos en cómo determinar la fórmula empírica de un compuesto y luego usarla para determinar la fórmula molecular si se conoce la masa molar del compuesto.
Cálculo de porcentajes de masa
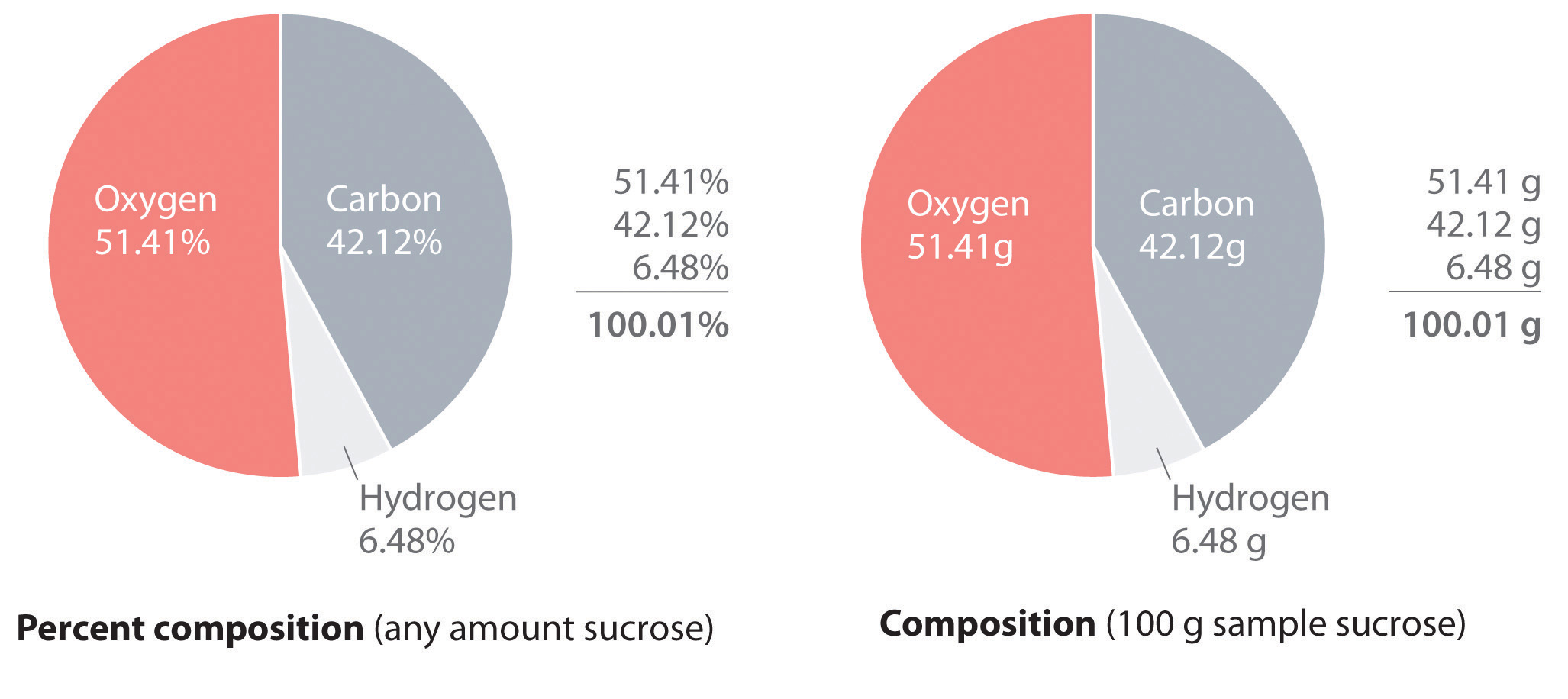
La ley de proporciones definidas establece que un compuesto químico siempre contiene la misma proporción de elementos en masa; es decir, la composición porcentual (el porcentaje de cada elemento presente en una sustancia pura). Con pocas excepciones, la composición porcentual de un compuesto químico es constante (ver ley de proporciones definidas). —el porcentaje de cada elemento presente en una sustancia pura— es constante (aunque ahora sabemos que hay excepciones a esta ley). Por ejemplo, la sacarosa (azúcar de caña) es 42.11% de carbono, 6.48% de hidrógeno y 51.41% de oxígeno en masa. Esto significa que 100.00 g de sacarosa siempre contienen 42.11 g de carbono, 6.48 g de hidrógeno y 51.41 g de oxígeno. Primero usaremos la fórmula molecular de sacarosa (C 12 H 22 O 11) para calcular el porcentaje de masa de los elementos componentes; luego mostraremos cómo se pueden usar los porcentajes de masa para determinar una fórmula empírica.
De acuerdo con su fórmula molecular, cada molécula de sacarosa contiene 12 átomos de carbono, 22 átomos de hidrógeno y 11 átomos de oxígeno. Por lo tanto, un mol de moléculas de sacarosa contiene 12 moles de átomos de carbono, 22 moles de átomos de hidrógeno y 11 moles de átomos de oxígeno. Podemos utilizar esta información para calcular la masa de cada elemento en 1 mol de sacarosa, lo que nos dará la masa molar de sacarosa. Entonces podemos usar estas masas para calcular la composición porcentual de la sacarosa. A tres decimales, los cálculos son los siguientes:
\ (\ comenzar {matriz}
masa\; de\; C/mol\; de\; sacarosa & =12\ cancelar {mol}\ izquierda (\ dfrac {12.011\; g\; C} {\ cancel {1\; mol\; C}}\ derecha) & =144.132\; g\; C\
& &\\
masa\; de\; H/mol\; de\; sacarosa & =22\ cancel {mol}\ left (\ dfrac {1.008\; g\; H} {\ cancel {1\ ; mol\; H}}\ derecha) & =22.176\; g\; H\
& & &\
masa\; de\; O/mol\; de\; sacarosa & =11\ cancel {mol}\ izquierda (\ dfrac {15.999\; g\; O} {\ cancel {1\; mol\; O}}\ derecha) & =175.989\; g\; O
\ final {matriz})\ tag {7.2.1}\)
Así, 1 mol de sacarosa tiene una masa de 342.297 g; tenga en cuenta que más de la mitad de la masa (175.989 g) es oxígeno, y casi la mitad de la masa (144.132 g) es carbono.
El porcentaje de masa de cada elemento en sacarosa es la masa del elemento presente en 1 mol de sacarosa dividida por la masa molar de sacarosa, multiplicada por 100 para dar un porcentaje. El resultado se muestra con dos decimales:
\ (\ comienzan {matriz}
masa\;\%\; C\; en\; sacarosa & =\ dfrac {masa\; de\; C/mol\; sacarosa} {molar\; masa\; de\; sacarosa}\ veces 100 & =\ dfrac {144.132\; g\; C} {342.297\; g/mol}\ veces 100 & =42.12\%\
&\\
masa\;\%\; H\; en\; sacarosa & =\ dfrac {masa\; de\; H/mol\; sacarosa} {molar\; masa\; de\; sacarosa}\ veces 100 & =\ dfrac {22.176\; g\; H} {342.297\; g/mol}\ veces 100 & =6.48\%\
& & &\
masa\;\%\; O\; en\; sacarosa & =\ frac {masa\; de\; O/mol\; sacarosa} {molar\; masa\; de\; sacarosa}\ veces 100 & =\ dfrac {175.989\; g\; O} {342.297\; g/mol}\ veces 100 & =51.41\%
\ final {matriz}\)
Puedes verificar tu trabajo verificando que la suma de los porcentajes de todos los elementos en el compuesto es del 100%:
\( 42.12 \% + 6.48 \% + 51.41 \% = 100.01 \% \)
Si la suma no es del 100%, has cometido un error en tus cálculos. (El redondeo al número correcto de decimales puede, sin embargo, hacer que el total sea ligeramente diferente del 100%). Así 100.00 g de sacarosa contienen 42.12 g de carbono, 6.48 g de hidrógeno y 51.41 g de oxígeno; a dos decimales, la composición porcentual de la sacarosa es de hecho 42.12% de carbono, 6.48% de hidrógeno y 51.41% de oxígeno.
Composición\(\PageIndex{1}\) porcentual de la figura
También podríamos calcular los porcentajes de masa usando masas atómicas y masas moleculares, con unidades de masa atómica. Debido a que la respuesta que estamos buscando es una relación, expresada como porcentaje, las unidades de masa cancelan ya sean gramos (usando masas molares) o unidades de masa atómica (usando masas atómicas y moleculares).
El aspartamo es el edulcorante artificial que se vende como NutrasSweet e Equal. Su fórmula molecular es C 14 H 18 N 2 O 5.
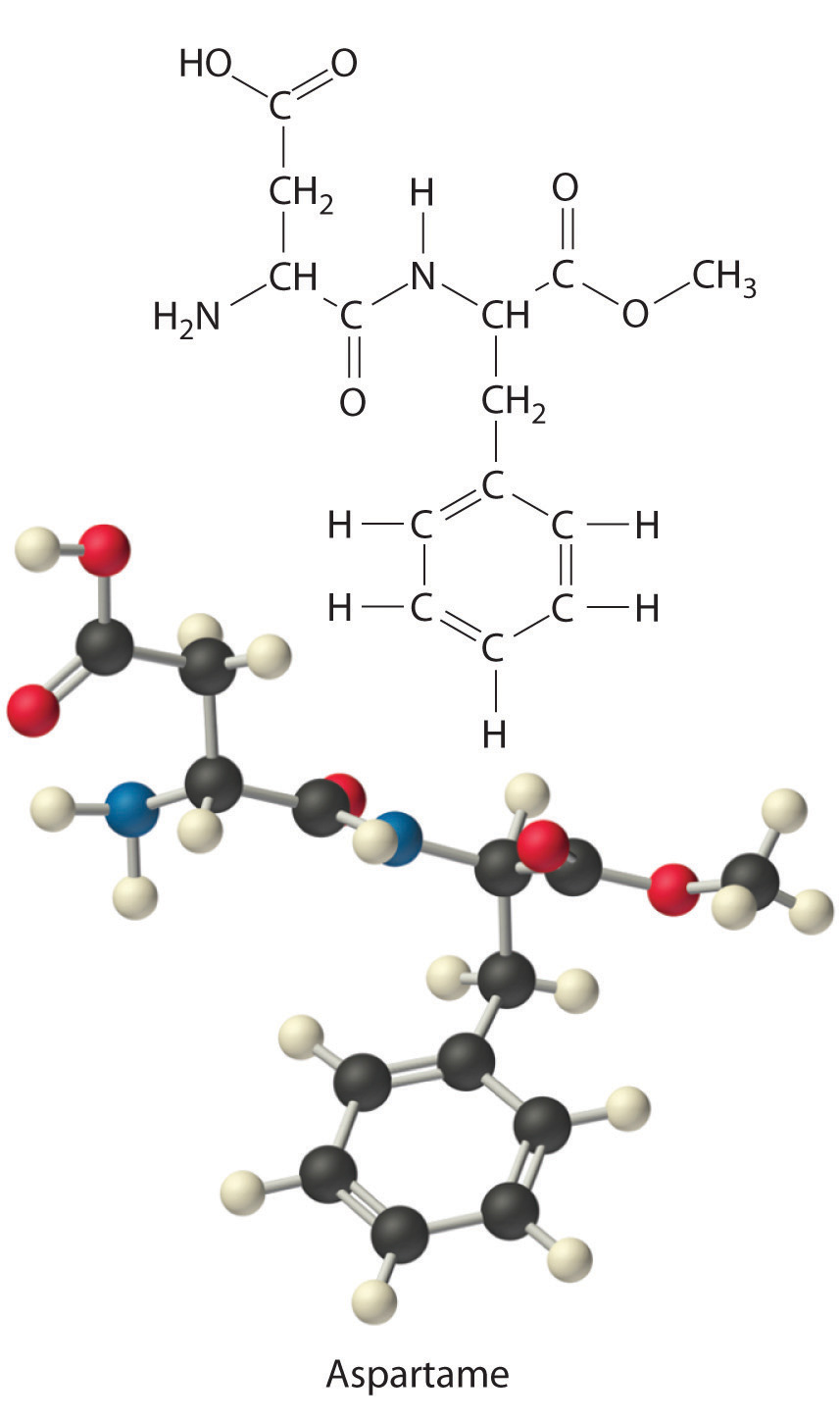
- Calcular el porcentaje de masa de cada elemento en aspartamo.
- Calcular la masa de carbono en un paquete de 1.00 g de Equal, asumiendo que es aspartamo puro.
Dado: fórmula molecular y masa de la muestra
Preguntado por: porcentaje de masa de todos los elementos y masa de un elemento en la muestra
Estrategia:
A Utilizar masas atómicas de la tabla periódica para calcular la masa molar de aspartamo.
B Dividir la masa de cada elemento por la masa molar de aspartamo; luego multiplicar por 100 para obtener porcentajes.
C Para encontrar la masa de un elemento contenido en una masa dada de aspartamo, multiplique la masa de aspartamo por el porcentaje de masa de ese elemento, expresado como decimal.
Solución
- A Calculamos la masa de cada elemento en 1 mol de aspartamo y la masa molar de aspartamo, aquí a tres decimales:
Átomos # átomos x peso atómico Resultado 14 C (14 mol C) (12.011 g/mol C) = 168.154 g 18 H (18 mol H) (1.008 g/mol H) = 18.114 g 2N (2 mol N) (14.007 g/mol N) = 28.014 g +5O (5 mol O) (15.999 g/mol O) = 79.995 g C 14 H 18 N 2 O 5 masa molar de aspartamo 294.277 g/mol Así, más de la mitad de la masa de 1 mol de aspartamo (294.277 g) es carbono (168.154 g).
B Para calcular el porcentaje de masa de cada elemento, dividimos la masa de cada elemento en el compuesto por la masa molar de aspartamo y luego multiplicamos por 100 para obtener porcentajes, aquí reportados a dos decimales:
\ (\ begin {matriz}
masa\;\%\; C & =\ dfrac {168.154\; g\; C} {294.277\; g\; aspartamo}\ veces 100 & =57.14\%\; C\
& & &\
masa\;\%\; N & =\ dfrac {18.114\; g\; H} {294.277\; g\; g\; aspartamo}\ veces 100 & =6.16\%\; C\\
& &\\
masa\;\%\; N & =\ dfrac {28.014\; g\; N} {294.277\; g\; aspartamo}\ veces 100 & =9.52\%\; C\\
& & &\
masa\;\%\; O & =\ dfrac {79.995\; g\; O} {294.277\; g\; aspartamo}\ veces 100 & =27.18\%\; C\\
\ end {matriz}\)Como cheque, podemos sumar los porcentajes juntos:
57.14% + 6.16% + 9.52% + 27.18% = 100.00%Si obtiene un total que difiera del 100% en más de aproximadamente ± 1%, debe haber un error en alguna parte del cálculo.
- C La masa de carbono en 1.00 g de aspartamo se calcula de la siguiente manera: \( mass\; of \; C =1.00 \cancel{g\; aspartame}\times \dfrac{57.14\; g\; C}{100\; \cancel{g\; aspartame}} = 0.57`\; g \; C \)
Agrega texto aquí.
Calcular el porcentaje de masa de cada elemento en óxido de aluminio (Al 2 O 3). Después se calcula la masa de aluminio en una muestra de 3.62 g de óxido de aluminio puro.
- Contestar
-
52.93% aluminio; 47.08% oxígeno; 1.92 g Al
Determinación de la Fórmula Empírica de la Penicilina
Así como podemos usar la fórmula empírica de una sustancia para determinar su composición porcentual, podemos usar la composición porcentual de una muestra para determinar su fórmula empírica, que luego puede ser utilizada para determinar su fórmula molecular. Dicho procedimiento se utilizó realmente para determinar las fórmulas empíricas y moleculares del primer antibiótico que se descubrió: la penicilina.
Los antibióticos son compuestos químicos que matan selectivamente microorganismos, muchos de los cuales causan enfermedades. A pesar de que hoy podemos dar por sentado los antibióticos, la penicilina fue descubierta hace apenas unos 80 años. El desarrollo posterior de una amplia gama de otros antibióticos para tratar muchas enfermedades comunes ha contribuido en gran medida al aumento sustancial de la esperanza de vida en los últimos 50 años. El descubrimiento de la penicilina es una historia histórica de detectives en la que el uso de porcentajes de masa para determinar fórmulas empíricas jugó un papel clave.
En 1928, Alexander Fleming, un joven microbiólogo de la Universidad de Londres, estaba trabajando con una bacteria común que causa forúnculos y otras infecciones como el envenenamiento de la sangre. Para estudios de laboratorio, las bacterias se cultivan comúnmente en la superficie de un gel que contiene nutrientes en platos de cultivo pequeños y planos. Un día Fleming notó que una de sus culturas estaba contaminada por un moho verde azulado similar al moho que se encuentra en el pan o fruta en mal estado. Tales accidentes son bastante comunes, y la mayoría de los trabajadores de laboratorio simplemente habrían tirado las culturas a la basura. Fleming notó, sin embargo, que las bacterias crecían en todas partes del gel excepto cerca del moho contaminante (parte (a) en la Figura\(\PageIndex{2}\), y planteó la hipótesis de que el moho debía estar produciendo una sustancia que matara a la bacteria o impidiera su crecimiento. Para probar esta hipótesis, cultivó el moho en un líquido y luego filtró el líquido y lo agregó a diversos cultivos bacterianos. El líquido mató no solo a la bacteria que Fleming había estado estudiando originalmente sino también a una amplia gama de otras bacterias causantes de enfermedades. Debido a que el moho era un miembro de la familia Penicillium (llamado así por sus ramas en forma de lápizbajo el microscopio) (parte (b) en la Figura\(\PageIndex{2}\)), Fleming llamó al ingrediente activo en el caldo penicilina.
Figura\(\PageIndex{2}\) Penicillium
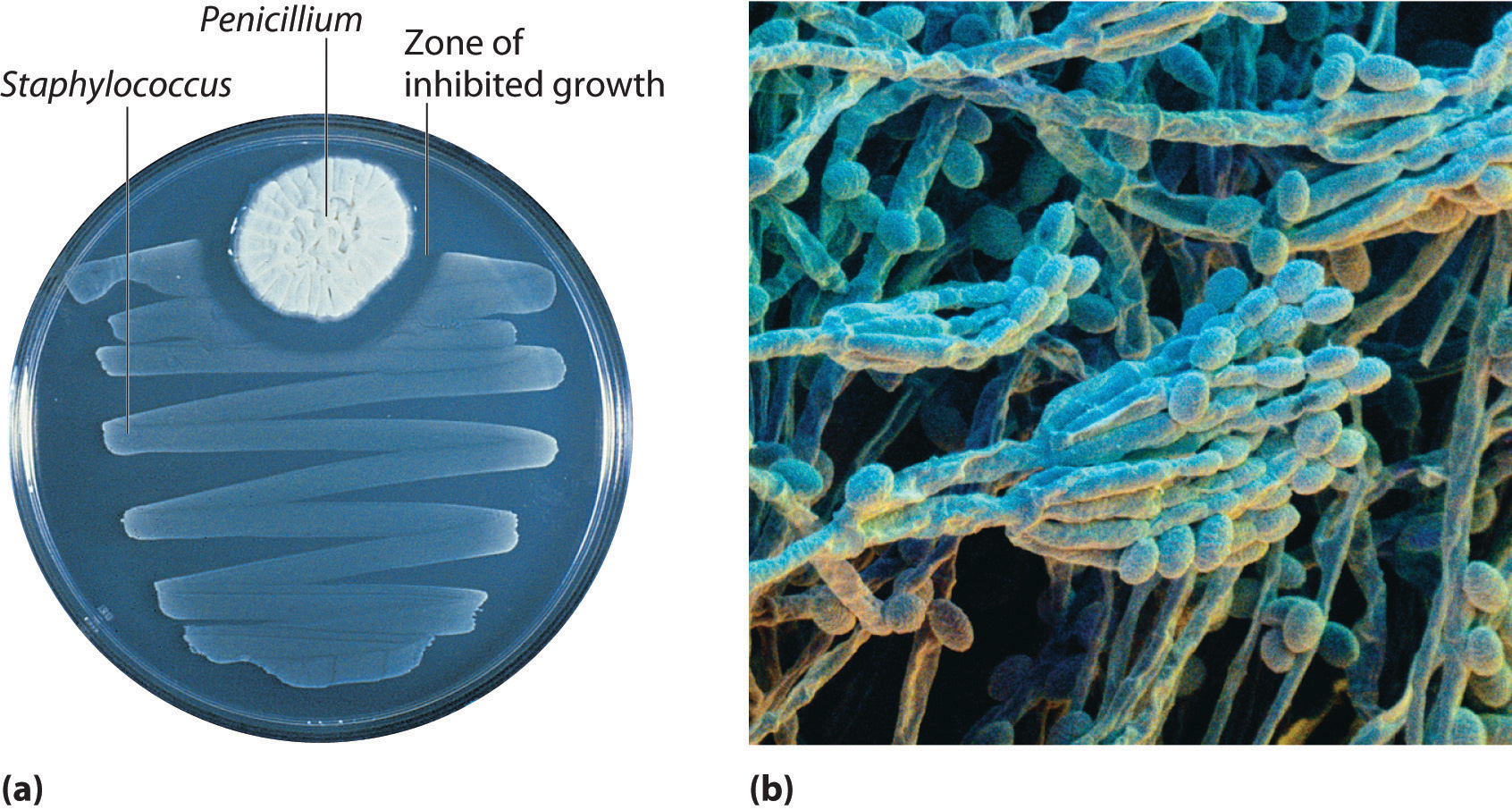
a) El moho de Penicillium está creciendo en una placa de cultivo; la foto muestra su efecto sobre el crecimiento bacteriano. (b) En esta fotomicrografía de Penicillium son visibles sus ramas en forma de varilla y pluma. El nombre proviene del latín penicillus, que significa “pincel”.
Si bien Fleming no pudo aislar la penicilina en forma pura, la importancia médica de su descubrimiento estimuló a investigadores en otros laboratorios. Por último, en 1940, dos químicos de la Universidad de Oxford, Howard Florey (1898—1968) y Ernst Chain (1906—1979), pudieron aislar un producto activo, al que llamaron penicilina G. En tres años, la penicilina G era de uso generalizado para tratar neumonía, gangrena, gonorrea y otras enfermedades, y su uso aumentó en gran medida la tasa de supervivencia de los soldados heridos en la Segunda Guerra Mundial. Como resultado de su trabajo, Fleming, Florey y Chain compartieron el Premio Nobel de Medicina en 1945.
Tan pronto como lograron aislar la penicilina G pura, Florey y Chain sometieron al compuesto a un procedimiento llamado análisis de combustión (descrito más adelante en esta sección) para determinar qué elementos estaban presentes y en qué cantidades. Los resultados de dichos análisis generalmente se reportan como porcentajes de masa. Descubrieron que una muestra típica de penicilina G contiene 53.9% de carbono, 4.8% de hidrógeno, 7.9% de nitrógeno, 9.0% de azufre y 6.5% de sodio en masa. La suma de estos números es de sólo 82.1%, en lugar de 100.0%, lo que implica que debe haber uno o más elementos adicionales. Un candidato razonable es el oxígeno, que es un componente común de compuestos que contienen carbono e hidrógeno; No asuma que la masa “faltante” siempre se debe al oxígeno. Podría ser cualquier otro elemento. por razones técnicas, sin embargo, es difícil analizar el oxígeno directamente. Si asumimos que toda la masa faltante se debe al oxígeno, entonces la penicilina G contiene (100.0% − 82.1%) = 17.9% de oxígeno. A partir de estos porcentajes de masa, se puede determinar la fórmula empírica y eventualmente la fórmula molecular del compuesto.
Para determinar la fórmula empírica a partir de los porcentajes de masa de los elementos en un compuesto como la penicilina G, necesitamos convertir los porcentajes de masa a números relativos de átomos. Por conveniencia, asumimos que estamos tratando con una muestra de 100.0 g del compuesto, aunque los tamaños de las muestras utilizadas para los análisis son generalmente mucho más pequeños, generalmente en miligramos. Esta suposición simplifica la aritmética porque un porcentaje en masa de carbono de 53.9% corresponde a 53.9 g de carbono en una muestra de 100.0 g de penicilina G; así mismo, 4.8% de hidrógeno corresponde a 4.8 g de hidrógeno en 100.0 g de penicilina G; y así sucesivamente para los demás elementos. Luego podemos dividir cada masa por la masa molar del elemento para determinar cuántos moles de cada elemento están presentes en la muestra de 100.0 g:
\( \frac{mass\left ( g \right )}{molar\;mass\left ( g/mol \right )}=\left ( \cancel{g} \right )\left ( \frac{mol}{\cancel{g}} \right )=mol \tag{7.2.2} \)
\ (\ comenzar {matriz}
53.9\;\ cancel {g\; C}\ dfrac {1\; mol\; C} {12.011\;\ cancel {g\; C}} &=4.49\; mol\; C\\
&\
4.8\; cancelar {g\; H}\ dfrac {1\; mol\; H} {1.008\; cancelar {g\; H}} &=4.49\; mol\; H\\
&\
7.9\;\ cancel {g\; N}\ dfrac {1\; mol\; N} {14.007\;\ cancel {g\; N}} &=0.56\; mol\; N\
&\
9.0\;\ cancel {g\; S}\ dfrac {1\; mol\; S} {32.065\;\ cancel {g\; S}} &=0.28\; mol\; S\
&\\
6.5\;\ cancel {g\; Na}\ dfrac {1\; mol\; Na} {22.990\;\ cancel {g\; Na}} &=0.28\ ; mol\; Na\\
&\
17.9\;\ cancel {g\; O}\ dfrac {1\; mol\; O} {15.999\;\ cancel {g\; O}} &=1.12\; mol\; O
\ end {matriz}\)
Así 100.0 g de penicilina G contiene 4.49 mol de carbono, 4.8 mol de hidrógeno, 0.56 mol de nitrógeno, 0.28 mol de azufre, 0.28 mol de sodio y 1.12 mol de oxígeno (asumiendo que toda la masa faltante era oxígeno). El número de cifras significativas en el número de moles de elementos varía entre dos y tres debido a que algunos de los datos analíticos se reportaron a solo dos cifras significativas.
Estos resultados nos indican las proporciones de los moles de los diversos elementos en la muestra (4.49 mol de carbono a 4.8 mol de hidrógeno por 0.56 mol de nitrógeno, etc.), pero no son las relaciones de número entero que necesitamos para la fórmula empírica, la fórmula empírica expresa los números relativos de átomos en los números enteros más pequeños posibles. Para obtener números enteros, dividimos los números de moles de todos los elementos de la muestra por el número de moles del elemento presente en la cantidad relativa más baja, que en este ejemplo es azufre o sodio. Los resultados serán los subíndices de los elementos en la fórmula empírica. A dos cifras significativas, los resultados son
\ (\ begin {matrix}
C:\dfrac {4.49} {0.28} = 16 & H:\dfrac {4.8} {0.28} = 17 & N:\dfrac {0.56} {0.28} = 2.0\\
& & &\
S:\dfrac {0.28} {0.28} = 1.0 & N a:\dfrac {0.28} {0.28} = 1.0 & O:\dfrac {1.12} {0.28} = 1.0
\ end {matrix}\ tag {7.2.3}\)
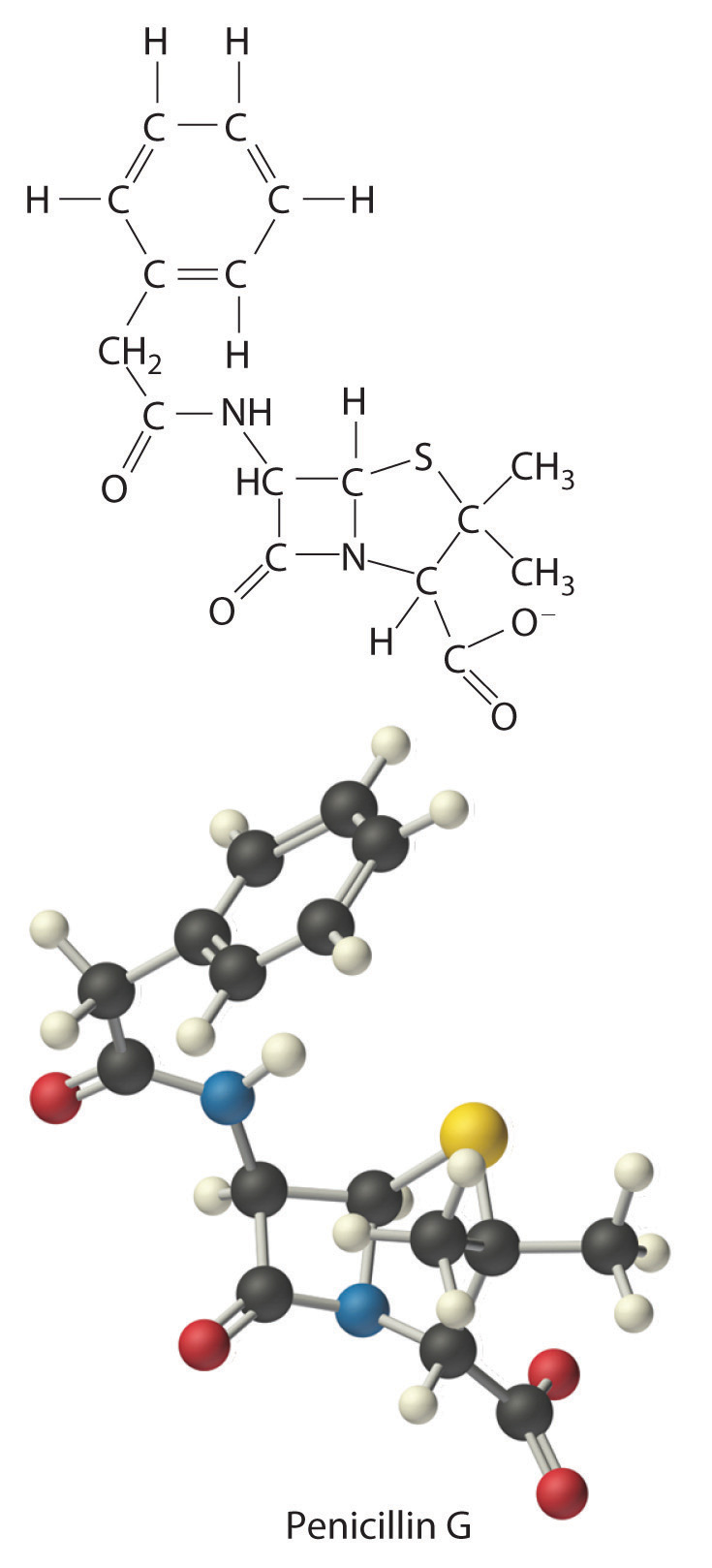
La fórmula empírica de la penicilina G es por lo tanto C 16 H 17 N 2 NaO 4 S. Otros experimentos han demostrado que la penicilina G es en realidad un compuesto iónico que contiene cationes Na + y [C 16 H 17 N 2 O 4 S] − aniones en una proporción 1:1. La compleja estructura de la penicilina G (Figura\(\PageIndex{3}\)) no se determinó hasta 1948.
Figura Fórmula\(\PageIndex{3}\) estructural
y modelo de bola y barra del
anión de penicilina G
En algunos casos, uno o más de los subíndices en una fórmula calculada mediante este procedimiento pueden no ser enteros. ¿Significa esto que el compuesto de interés contiene un número no integral de átomos? No; los errores de redondeo en los cálculos así como los errores experimentales en los datos pueden resultar en proporciones no integrales. Cuando esto sucede, se debe ejercer algún juicio al interpretar los resultados, como se ilustra en el Ejemplo 6. En particular, las proporciones de 1.50, 1.33 o 1.25 sugieren que se deben multiplicar todos los subíndices de la fórmula por 2, 3 o 4, respectivamente. Solo si la relación está dentro del 5% de un valor integral debe considerar redondear al entero más cercano.
Calcular la fórmula empírica del compuesto iónico fosfato de calcio, un componente principal del fertilizante y un agente pulidor en pastas dentales. El análisis elemental indica que contiene 38.77% de calcio, 19.97% de fósforo y 41.27% de oxígeno.
Dado: porcentaje de composición
Preguntado por: fórmula empírica
Estrategia:
A Asumir una muestra de 100 g y calcular el número de moles de cada elemento en esa muestra.
B Obtener los números relativos de átomos de cada elemento en el compuesto dividiendo el número de moles de cada elemento en la muestra de 100 g por el número de moles del elemento presente en la menor cantidad.
C Si las proporciones no son números enteros, multiplique todos los subíndices por el mismo número para dar valores integrales.
D Debido a que este es un compuesto iónico, identificar el anión y el catión y escribir la fórmula para que las cargas se equilibren.
Solución
Una muestra de 100 g de fosfato de calcio contiene 38.77 g de calcio, 19.97 g de fósforo y 41.27 g de oxígeno. Dividiendo la masa de cada elemento en la muestra de 100 g por su masa molar da el número de moles de cada elemento en la muestra:
\ (\ begin {matriz}moles\; Ca & =38.77\;\ cancel {g\; Ca}\ dfrac {1\; mol\; Ca} {40.078\;\ cancel {g\; Ca}} & =0.9674\; mol\; Ca\\
& &\
moles\; P & =19.97\;\ cancel {g\; P}\ dfrac {1\; mol\; P} {30.9738\;\ cancel {g\; Ca}} & =0.6447\; mol\; P\
& &\\
moles\; O & =41.27\;\ cancel {g\; O}\ dfrac {1\; mol\; O} {15.994\;\ cancel {g\; O}} & =2.5800\; mol\; O
\ end {matriz}\)
B Para obtener los números relativos de átomos de cada elemento en el compuesto, divida el número de moles de cada elemento en la muestra de 100 g por el número de moles del elemento en la menor cantidad, en este caso fósforo:
\ (\ begin {matriz}P:\frac {0.6447\; mol P} {0.6447\; mol P} = 1.00 & C a:\dfrac {0.9674} {0.6447} = 1.501 & O:\dfrac {2.5800} {0.6447} = 4.002
\ end {matriz}\)
C Podríamos escribir la fórmula empírica del fosfato de calcio como Ca 1.501 P 1.000 O 4.002, pero la fórmula empírica debe mostrar las proporciones de los elementos como números enteros pequeños. Para convertir el resultado a forma integral, multiplica todos los subíndices por 2 para obtener Ca 3.002 P 2.000 O 8.004. La desviación de las relaciones atómicas integrales es pequeña y puede atribuirse a errores experimentales menores; por lo tanto, la fórmula empírica es Ca 3 P 2 O 8.
D El ion calcio (Ca 2 +) es un catión, por lo que para mantener la neutralidad eléctrica, el fósforo y el oxígeno deben formar un anión poliatómico. Sabemos por la Sección 6.3 2 que el fósforo y el oxígeno forman el ion fosfato (PO 4 3−; ver Cuadro 7.21). Debido a que hay dos átomos de fósforo en la fórmula empírica, deben estar presentes dos iones fosfato. Entonces escribimos la fórmula del fosfato de calcio como Ca 3 (PO 4) 2.
Calcular la fórmula empírica del nitrato amónico, compuesto iónico que contiene 35.00% de nitrógeno, 5.04% de hidrógeno y 59.96% de oxígeno en masa; consulte el Cuadro 7.2.1 si es necesario. Aunque el nitrato de amonio es ampliamente utilizado como fertilizante, puede ser peligrosamente explosivo. Por ejemplo, fue un componente importante del explosivo utilizado en el atentado de Oklahoma City en 1995.
- Contestar
-
N 2 H 4 O 3 es NH 4 + NO 3 −, escrito como NH 4 NO 3
Análisis de Combustión
Una de las formas más comunes de determinar la composición elemental de un hidrocarburo desconocido es un procedimiento analítico llamado análisis de combustión. Una muestra pequeña y cuidadosamente pesada de un compuesto desconocido que puede contener carbono, hidrógeno, nitrógeno y/o azufre se quema en una atmósfera de oxígeno. Otros elementos, como los metales, se pueden determinar por otros métodos. y las cantidades de los productos gaseosos resultantes (CO 2, H 2 O, N 2 y SO 2, respectivamente) se determinan por uno de varios métodos posibles. Un procedimiento utilizado en el análisis de combustión se describe esquemáticamente en la Figura\(\PageIndex{4}\), y un análisis de combustión típico se ilustra en el Ejemplo 7.
Figura\(\PageIndex{4}\) Pasos para Obtener una Fórmula Empírica a partir del Análisis de Combustión

La naftalina, el ingrediente activo en una variedad de bolas de naftalina, es un compuesto orgánico que solo contiene carbono e hidrógeno. La combustión completa de una muestra de 20.10 mg de naftaleno en oxígeno arrojó 69.00 mg de CO 2 y 11.30 mg de H 2 O. Determinar la fórmula empírica del naftaleno.
Dado: masa de muestra y masa de productos de combustión
Preguntado por: fórmula empírica
Estrategia:
A Utilizar las masas y masas molares de los productos de combustión, CO 2 y H 2 O, para calcular las masas de carbono e hidrógeno presentes en la muestra original de naftaleno.
B Utilizar esas masas y las masas molares de los elementos para calcular la fórmula empírica del naftaleno.
Solución
A Tras la combustión, se produce 1 mol de CO 2 por cada mol de átomos de carbono en la muestra original. De igual manera, se produce 1 mol de H 2 O por cada 2 mol de átomos de hidrógeno presentes en la muestra. Las masas de carbono e hidrógeno en la muestra original se pueden calcular a partir de estas relaciones, las masas de CO 2 y H 2 O, y sus masas molares. Debido a que las unidades de masa molar son gramos por mol, primero debemos convertir las masas de miligramos a gramos:
\( mass\; of\; C=69.00\cancel{mg\; CO_{2}}\times \dfrac{1\;\cancel{g}}{1000\;\cancel{mg}}\times \dfrac{1\; \cancel{mol\;CO_{2}}}{44.010\; \cancel{g\; CO_{2}}}\times \dfrac{1\;\cancel{mol\; C}}{1\;\cancel{mol\; CO_{2}}}\times \dfrac{12.011\; g}{1 \cancel{mol\; C}} \)
\( = 1.883 \times 10^{-2}\; g\; C) \)
\( mass\; of\; H=11.30\; \cancel{mg\; H_{2}O}\times \dfrac{1\;\cancel{g}}{1000\;\cancel{mg}}\times \dfrac{1\; \cancel{mol\;H_{2}O}}{18.015\; \cancel{g\; H_{2}O}}\times \dfrac{2\;\cancel{mol\; H}}{1\;\cancel{mol\; H_{2}O}}\times \dfrac{1.0079\; g}{1 \cancel{mol\; C}} \)
\( = 1.264 \times 10^{-3}\; g\; H) \)
B Para obtener los números relativos de átomos de ambos elementos presentes, necesitamos calcular el número de moles de cada uno y dividir por el número de moles del elemento presente en la menor cantidad:
\( moles\; C= 1.883 \times 10^{-2}\; \cancel{g\; C}\times \dfrac{1\; mol\; C}{12.011\; \cancel{g\; C}}= 1.568\times 10^{-3}\; mol\; C \)
\( moles\; H= 1.264 \times 10^{-3}\; \cancel{g\; H}\times \dfrac{1\; mol\; H}{1.0079\; \cancel{g\; H}}= 1.254\times 10^{-3}\; mol\; H \)
Dividiendo cada número por el número de moles del elemento presente en la menor cantidad da
\ (\ begin {matrix}
H:\dfrac {1.254\ times 10^ {-3}} {1.254\ times 10^ {-3}} =1.000 & C:\dfrac {1.568\ times 10^ {-3}} {1.254\ times 10^ {-3}} =1.250
\ end {matrix}\)
Así, el naftaleno contiene una relación de 1. 25:1 de moles de carbono a moles de hidrógeno: C 1.25 H 1.0. Debido a que las proporciones de los elementos en la fórmula empírica deben expresarse como pequeños números enteros, multiplique ambos subíndices por 4, lo que da C 5 H 4 como la fórmula empírica del naftaleno. De hecho, la fórmula molecular del naftaleno es C 10 H 8, lo que concuerda con nuestros resultados.
- El xileno, un compuesto orgánico que es un componente importante de muchas mezclas de gasolina, solo contiene carbono e hidrógeno. La combustión completa de una muestra de 17.12 mg de xileno en oxígeno arrojó 56.77 mg de CO 2 y 14.53 mg de H 2 O. Determinar la fórmula empírica del xileno.
- La fórmula empírica del benceno es CH (su fórmula molecular es C 6 H 6). Si 10.00 mg de benceno se someten a análisis de combustión, ¿qué masa de CO 2 y H 2 O se producirá?
- Contestar
-
- La fórmula empírica es C 4 H 5. (La fórmula molecular del xileno es en realidad C 8 H 10.)
- 33.81 mg de CO 2; 6.92 mg de H 2 O
De la fórmula empírica a la fórmula molecular
La fórmula empírica da solo los números relativos de átomos en una sustancia en la menor proporción posible. Para una sustancia covalente, generalmente nos interesa más la fórmula molecular, que da el número real de átomos de cada tipo presentes por molécula. Sin información adicional, sin embargo, es imposible saber si la fórmula de la penicilina G, por ejemplo, es C 16 H 17 N 2 NaO 4 S o un múltiplo integral, como C 32 H 34 N 4 Na 2 O 8 S 2, C 48 H 51 N 6 Na 3 O 12 S 3, o (C 16 H 17 N 2 NaO 4 S) n, donde n es un número entero. (La estructura real de la penicilina G se muestra en la Figura 7.2.3).
Considera la glucosa, el azúcar que circula en nuestra sangre para proporcionar combustible a nuestros cuerpos y especialmente a nuestros cerebros. Los resultados del análisis de combustión de glucosa reportan que la glucosa contiene 39.68% de carbono y 6.58% de hidrógeno. Debido a que la combustión ocurre en presencia de oxígeno, es imposible determinar directamente el porcentaje de oxígeno en un compuesto mediante el uso de análisis de combustión; otros métodos más complejos son necesarios. Si asumimos que el porcentaje restante se debe al oxígeno, entonces la glucosa contendría 53.79% de oxígeno. Por lo tanto, una muestra de 100.0 g de glucosa contendría 39.68 g de carbono, 6.58 g de hidrógeno y 53.79 g de oxígeno. Para calcular el número de moles de cada elemento en la muestra de 100.0 g, dividimos la masa de cada elemento por su masa molar:
\ (\ comenzar {matriz}
moles\; C &=39.68\;\ cancel {g\; C}\ dfrac {1\; mol\; C} {12.011\;\ cancel {gC}} & = 3.304\; mol\; C\\
& &\
moles\; H & =6.58\;\ cancel {g\; H}\ dfrac {1\; mol\;; H} {1.0079\;\ cancel {gH}} & = 6.53\; mol\; H\\
& & amp;\\
moles\; O & =53.79\;\ cancel {g\; O}\ dfrac {1\; mol\; C} {15.9994\;\ cancel {go}} & = 3.362\; mol\; O
\ end {matriz}\ tag {7.2.4}\)
Una vez más, encontramos los subíndices de los elementos en la fórmula empírica dividiendo el número de moles de cada elemento por el número de moles del elemento presente en la menor cantidad:
\ (\ begin {matrix}
C:\dfrac {3.304} {3.304} =1.000 & H:\dfrac {6.53} {3.304} =1.98 & O:\dfrac {3.362} {3.304} =1.018
\ end {matriz}\)
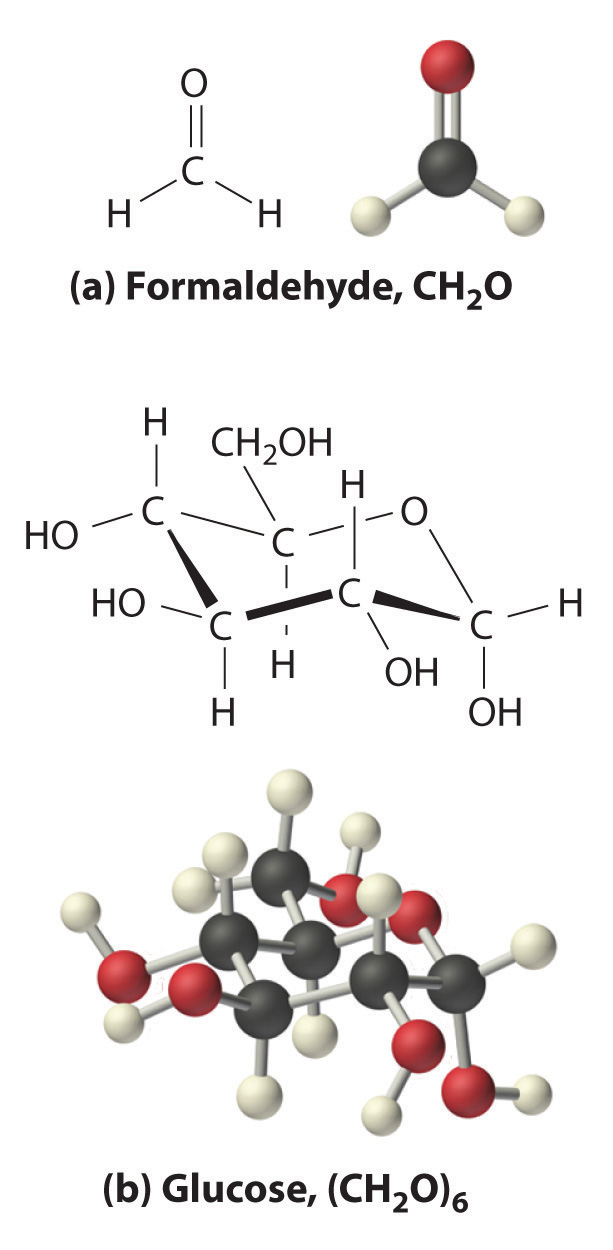
La relación oxígeno:carbono es 1.018, o aproximadamente 1, y la relación hidrógeno:carbono es aproximadamente 2. La fórmula empírica de la glucosa es por lo tanto CH 2 O, pero ¿cuál es su fórmula molecular?
Muchos compuestos conocidos tienen la fórmula empírica CH 2 O, incluyendo el formaldehído, que se utiliza para preservar especímenes biológicos y tiene propiedades que son muy diferentes al azúcar que circula en nuestra sangre. En este punto, no podemos saber si la glucosa es CH 2 O, C 2 H 4 O 2, o cualquier otra (CH 2 O) n. Sin embargo, podemos usar la masa molar de glucosa determinada experimentalmente (180 g/mol) para resolver este dilema.
Primero, calculamos la masa de fórmula, la masa molar de la unidad de fórmula, que es la suma de las masas atómicas de los elementos en la fórmula empírica multiplicada por sus respectivos subíndices. Para la glucosa,
\( formula\; mass\; of\; CH_{2}O=\left [ 1\; \cancel{mol\; C}\left ( \dfrac{12.011\; g}{1\; \cancel{mol\; C}} \right ) \right ]+\left [ 2\; \cancel{mol\; H}\left ( \dfrac{1.0079\; g}{1\; \cancel{mol\; H}} \right ) \right ]+\left [ 1\; \cancel{mol\; O}\left ( \dfrac{15.9994\; g}{1\; \cancel{mol\; O}} \right ) \right ] \tag{7.2.4} \)
Esto es mucho menor que la masa molar observada de 180 g/mol.
Segundo, determinamos el número de unidades de fórmula por mol. Para la glucosa, podemos calcular el número de unidades (CH 2 O), es decir, la n en (CH 2 O) n, dividiendo la masa molar de glucosa por la masa de fórmula de CH 2 O:
\( n=\dfrac{180\; g}{30.026\; g\; CH_{2}O}=5.99\approx 6 CH^{_{2}O\; formula\; units} \tag{7.2.5} \)
Cada glucosa contiene seis unidades de fórmula CH 2 O, lo que da una fórmula molecular para la glucosa de (CH 2 O) 6, que se escribe más comúnmente como C 6 H 12 O 6. Las estructuras moleculares de formaldehído y glucosa, ambas con la fórmula empírica CH 2 O, se muestran en la Figura\(\PageIndex{5}\)
Figura Fórmulas\(\PageIndex{5}\) Estructurales y Modelos de Bola y Palo de (a) Formaldehído y (b) Glucosa
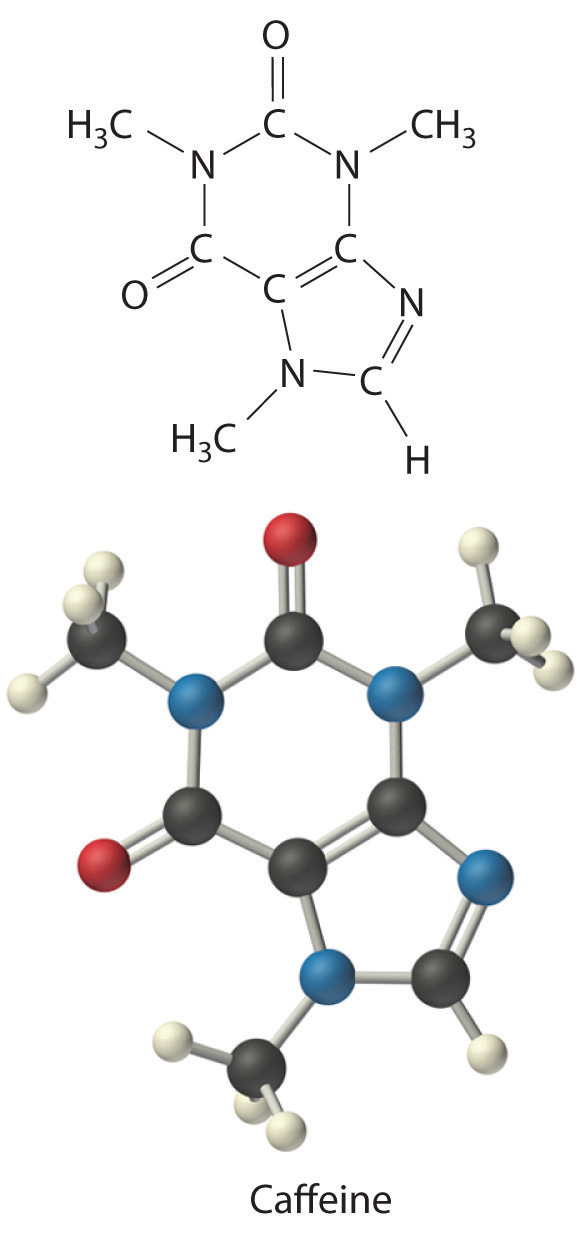
Calcular la fórmula molecular de la cafeína, un compuesto que se encuentra en el café, el té y las bebidas de cola que tiene un marcado efecto estimulante en los mamíferos. El análisis químico de la cafeína muestra que contiene 49.18% de carbono, 5.39% de hidrógeno, 28.65% de nitrógeno y 16.68% de oxígeno en masa, y su masa molar determinada experimentalmente es de 196 g/mol.
Dado: porcentaje de composición y masa molar
Preguntado por: fórmula molecular
Estrategia:
A Supongamos 100 g de cafeína. A partir de los porcentajes dados, utilice el procedimiento dado en el Ejemplo 6 para calcular la fórmula empírica de la cafeína.
B Calcular la masa de la fórmula y luego dividir la masa molar determinada experimentalmente por la masa de la fórmula. Esto da el número de unidades de fórmula presentes.
C Multiplique cada subíndice en la fórmula empírica por el número de unidades de fórmula para dar la fórmula molecular.
Solución
A Comenzamos dividiendo la masa de cada elemento en 100.0 g de cafeína (49.18 g de carbono, 5.39 g de hidrógeno, 28.65 g de nitrógeno, 16.68 g de oxígeno) por su masa molar. Esto da el número de moles de cada elemento en 100 g de cafeína.
\ (\ comenzar {matriz}
moles\; C &=49.18\;\ cancel {g\; C}\ dfrac {1\; mol\; C} {12.011\;\ cancel {gC}} & = 4.095\; mol\; C\
& &\\
moles\; H & =5.93\;\ cancel {g\; H}\ dfrac {1\; mol\;; H} {1.0079\;\ cancel {gH}} & = 5.35\; mol\; H\\
& & amp;\\
moles\; N & =28.65\;\ cancel {g\; N}\ dfrac {1\; mol\; H} {14.0067\;\ cancel {gH}} & = 2.045\; mol\; N\\
& &\
moles\; O & =16.68\;\ cancel {g\; O}\ dfrac {1\; mol\; C} {15.9994\;\ cancel {GO}} & = 1.043\; mol\; O
\ final {matriz}\)
Para obtener los números relativos de átomos de cada elemento presente, divida el número de moles de cada elemento por el número de moles del elemento presente en la menor cantidad:
\ (\ begin {matrix}
O:\dfrac {1.043} {1.043} =1.000 & C:\dfrac {4.095} {1.043} =3.926 & H:\dfrac {5.35} {1.043} =5.13 & N:\dfrac {2.045} {1.043} =1.960
\ end {matrix}\)
Estos resultados son bastante típicos de los datos experimentales reales. Ninguna de las relaciones atómicas es exactamente integral, pero todas están dentro del 5% de los valores integrales. Al igual que en el Ejemplo 6, es razonable suponer que tales pequeñas desviaciones de los valores integrales se deben a errores experimentales menores, por lo que redondear al entero más cercano. La fórmula empírica de la cafeína es así C 4 H 5 N 2 O.
B La fórmula molecular de la cafeína podría ser C 4 H 5 N 2 O, pero también podría ser cualquier múltiplo integral de esto. Para determinar la fórmula molecular real, debemos dividir la masa molar determinada experimentalmente por la masa de fórmula. La masa de la fórmula se calcula de la siguiente manera:
Dividiendo la masa molar medida de cafeína (196 g/mol) por la masa de fórmula calculada da
\( \dfrac{196\; g/mol}{97.096\; g/C_{4}H_{5}N_{2}O}=2.02\approx 2C_{4}H_{5}N_{2}O \)
C Hay dos unidades de fórmula C 4 H 5 N 2 O en la cafeína, por lo que la fórmula molecular debe ser (C 4 H 5 N 2 O) 2 = C 8 H 10 N 4 O 2. La estructura de la cafeína es la siguiente:
Calcular la fórmula molecular de Freón-114, que tiene 13.85% de carbono, 41.89% de cloro y 44.06% de flúor. La masa molar medida experimentalmente de este compuesto es de 171 g/mol. Al igual que el Freón-11, el Freón-114 es un refrigerante de uso común que ha sido implicado en la destrucción de la capa de ozono.
- Contestar
-
C 2 Cl 2 F 4
Resumen
La fórmula empírica de una sustancia se puede calcular a partir de la composición porcentual determinada experimentalmente, el porcentaje de cada elemento presente en una sustancia pura en masa. En muchos casos, estos porcentajes se pueden determinar mediante análisis de combustión. Si se conoce la masa molar del compuesto, la fórmula molecular se puede determinar a partir de la fórmula empírica.
Llave para llevar
- La fórmula empírica de una sustancia se puede calcular a partir de su composición porcentual, y la fórmula molecular se puede determinar a partir de la fórmula empírica y la masa molar del compuesto.
Problemas conceptuales
-
¿Cuál es la relación entre una fórmula empírica y una fórmula molecular?
-
Construya un diagrama de flujo que muestre cómo determinaría la fórmula empírica de un compuesto a partir de su composición porcentual.
Problemas numéricos
Por favor, asegúrese de estar familiarizado con los temas tratados en Habilidades Esenciales 2 (Sección 7.7) antes de proceder a los Problemas Numéricos.
-
¿Cuál es el porcentaje de masa de agua en cada hidrato?
- H 3 ASO 4 ·0·5H 2 O
- NH 4 NiCl 3 ·6H 2 O
- Al (NO 3) 3 ·9H 2 O
-
¿Cuál es el porcentaje de masa de agua en cada hidrato?
- CASO 4 ·2H 2 O
- Fe (NO 3) 3 ·9H 2 O
- (NH 4) 3 ZrOH (CO 3) 3 ·2H 2 O
-
¿Cuál de las siguientes tiene el mayor porcentaje de masa de oxígeno: KMnO 4, K 2 Cr 2 O 7, o Fe 2 O 3?
-
¿Cuál de las siguientes tiene el mayor porcentaje de masa de oxígeno: THOCl 2, MgCO 3 o NO 2 Cl?
-
Calcular la composición porcentual del elemento que se muestra en negrita en cada compuesto.
- Sb Br 3
- Como 2 I 4
- Al P O 4
- C 6 H 10 O
-
Calcular la composición porcentual del elemento que se muestra en negrita en cada compuesto.
- H Br O 3
- Cs ReO 4
- C 3 H 8 O
- Fe S O 4
-
Una muestra de un compuesto de cromo tiene una masa molar de 151.99 g/mol. El análisis elemental del compuesto muestra que contiene 68.43% de cromo y 31.57% de oxígeno. ¿Cuál es la identidad del recinto?
-
Los porcentajes de hierro y oxígeno en los tres compuestos binarios más comunes de hierro y oxígeno se dan en la siguiente tabla. Escribir las fórmulas empíricas de estos tres compuestos.
Compuesto % Hierro % Oxígeno Fórmula empírica 1 69.9 30.1 2 77.7 22.3 3 72.4 27.6 -
¿Cuál es el porcentaje de masa de agua en cada hidrato?
- Licl·h 2 O
- MgSO 4 ·7H 2 O
- Sr (NO 3) 2·4H 2 O
-
¿Cuál es el porcentaje de masa de agua en cada hidrato?
- CaHpo 4 ·2H 2 O
- FeCl 2·4H 2 O
- Mg (NO 3) 2·4H 2 O
-
Se pesaron dos hidratos, se calentaron para expulsar las aguas de hidratación y luego se enfriaron. Luego se volvieron a pesar los residuos. Con base en los siguientes resultados, ¿cuáles son las fórmulas de los hidratos?
Compuesto Masa Inicial (g) Masa después del enfriamiento (g) NiSO 4 · x H 2 O 2.08 1.22 CoCl 2 · x H 2 O 1.62 0.88 -
¿Cuál contiene el mayor porcentaje de masa de azufre—Fes 2, Na 2 S 2 O 4, o Na 2 S?
-
Dadas masas iguales de cada uno, ¿cuál contiene el mayor porcentaje de masa de azufre — Nahso 4 o K 2 SO 4?
-
Calcular el porcentaje de masa de oxígeno en cada ion poliatómico.
- bicarbonato
- cromato
- acetato
- sulfito
-
Calcular el porcentaje de masa de oxígeno en cada ion poliatómico.
- oxalato
- nitrito
- fosfato de dihidrógeno
- tiocianato
-
La fórmula empírica del granate, una piedra preciosa, es Fe 3 Al 2 Si 3 O 12. Un análisis de una muestra de granate dio un valor de 13.8% para el porcentaje de masa de silicio. ¿Esto es consistente con la fórmula empírica?
-
Un compuesto tiene la fórmula empírica C 2 H 4 O, y su masa de fórmula es de 88 g. ¿Cuál es su fórmula molecular?
-
Mirex es un insecticida que contiene 22.01% de carbono y 77.99% de cloro. Tiene una masa molecular de 545.59 g. ¿Cuál es su fórmula empírica? ¿Cuál es su fórmula molecular?
-
¿Cuántos moles de CO 2 y H 2 O se producirán por análisis de combustión de 0.010 mol de estireno?
-
¿Cuántos moles de CO 2, H 2 O y N 2 se producirán por análisis de combustión de 0.0080 mol de anilina?
-
¿Cuántos moles de CO 2, H 2 O y N 2 se producirán por análisis de combustión de 0.0074 mol de aspartamo?
-
¿Cuántos moles de CO 2, H 2 O, N 2 y SO 2 se producirán por análisis de combustión de 0.0060 mol de penicilina G?
-
La combustión de una muestra de 34.8 mg de benzaldehído, que contiene solo carbono, hidrógeno y oxígeno, produjo 101 mg de CO 2 y 17.7 mg de H 2 O.
- ¿Cuál era la masa de carbono e hidrógeno en la muestra?
- Suponiendo que la muestra original solo contenía carbono, hidrógeno y oxígeno, ¿cuál era la masa de oxígeno en la muestra?
- ¿Cuál fue el porcentaje de masa de oxígeno en la muestra?
- ¿Cuál es la fórmula empírica del benzaldehído?
- La masa molar del benzaldehído es 106.12 g/mol. ¿Cuál es su fórmula molecular?
-
El ácido salicílico se utiliza para elaborar aspirina. Contiene solo carbono, oxígeno e hidrógeno. La combustión de una muestra de 43.5 mg de este compuesto produjo 97.1 mg de CO 2 y 17.0 mg de H 2 O.
- ¿Cuál es la masa de oxígeno en la muestra?
- ¿Cuál es el porcentaje de masa de oxígeno en la muestra?
- ¿Cuál es la fórmula empírica del ácido salicílico?
- La masa molar de ácido salicílico es de 138.12 g/mol. ¿Cuál es su fórmula molecular?
-
Dadas las masas iguales de los siguientes ácidos, ¿cuál contiene la mayor cantidad de hidrógeno que puede disociarse para formar H + —ácido nítrico, ácido yodhídrico, ácido cianhídrico o ácido clórico?
-
Calcular la masa de fórmula o la masa molecular de cada compuesto.
- ácido heptanoico (un ácido carboxílico de siete carbonos)
- 2-propanol (un alcohol de tres carbonos)
- KmNo 4
- tetraetilplomo
- ácido sulfuroso
- etilbenceno (un hidrocarburo aromático de ocho carbonos)
-
Calcular la masa de fórmula o la masa molecular de cada compuesto.
- MoCl 5
- B 2 O 3
- bromobenceno
- ciclohexeno
- ácido fosfórico
- etilamina
-
Dadas las mismas masas de butano, ciclobutano y propeno, ¿cuál contiene la mayor masa de carbono?
-
Dadas masas iguales de urea [(NH 2) 2 CO] y sulfato de amonio, ¿cuál contiene más nitrógeno para su uso como fertilizante?
RESPUESTAS
-
A dos decimales, los porcentajes son:
- 5.97%
- 37.12%
- 43.22%
-
% oxígeno: KMnO 4, 40.50%; K 2 Cr 2 O 7, 38.07%; Fe 2 O 3, 30.06%
-
A dos decimales, los porcentajes son:
- 66.32% Br
- 22.79% As
- 25.40% P
- 73.43% C
-
Cr 2 O 3.
-
A dos decimales, los porcentajes son:
- 29.82%
- 51.16%
- 25.40%
-
NiSO 4 · 6H 2 O y CoCl 2 · 6H 2 O
-
NaHSO 4
-
- 72.71%
- 69.55%
- 65.99%
- 0%
-
C 4 H 8 O 2
-
- 27.6 mg C y 1.98 mg H
- 5.2 mg O
- 15%
- C 7 H 6 O
- C 7 H 6 O
-
ácido cianhídrico, HCN
-
A dos decimales, los valores son:
- 273.23 amu
- 69.62 amu
- 157.01 amu
- 82.14 amu
- 98.00 amu
- 45.08 amu
-
Urea
Colaboradores
- Anonymous
Modificado por Joshua Halpern


