3.3: Ecuaciones Químicas
- Page ID
- 78368
- Describir una reacción química.
- Calcular las cantidades de compuestos producidos o consumidos en una reacción química. bjetivo
Como se muestra en la Figura\(\PageIndex{1}\), aplicar una pequeña cantidad de calor a una pila de polvo de dicromato de amonio naranja da como resultado una reacción vigorosa conocida como el volcán dicromato de amonio. El calor, la luz y el gas se producen a medida que se forma una gran pila de óxido de cromo verde esponjoso (III). Podemos describir esta reacción con una ecuación química Una expresión que da las identidades y cantidades de las sustancias en una reacción química. Se utilizan fórmulas químicas para indicar los reactivos a la izquierda y los productos a la derecha. Una flecha apunta desde los reactivos hasta los productos. , expresión que da las identidades y cantidades de las sustancias en una reacción química. Las fórmulas químicas y otros símbolos se utilizan para indicar el (los) material (s) de partida, o reactivo (s) El (los) material (s) de partida en una reacción química. , que por convención están escritos en el lado izquierdo de la ecuación, y el/los compuesto (s) final (s), o producto (s) El (los) compuesto (s) final (s) producido (s) en una reacción química. , que están escritos a la derecha. Una flecha apunta desde el reactivo a los productos:
Figura\(\PageIndex{1}\) Un volcán dicromato de amonio: cambio durante una reacción química
El material de partida (izquierda) es dicromato amónico sólido. Una reacción química (derecha) lo transforma en óxido de cromo sólido (III), representado mostrando una porción de su estructura encadenada, gas nitrógeno y vapor de agua. (Además, se libera energía en forma de calor y luz.) Durante la reacción, la distribución de los átomos cambia, pero el número de átomos de cada elemento no cambia. Debido a que los números de cada tipo de átomo son los mismos en los reactivos y en los productos, la ecuación química está equilibrada.
\ [\ comenzar {matriz}
\ izquierda (NH_ {4}\ derecha) _ {2} Cr_ {2} O_ {7} &\ fila derecha Cr_ {2} O_ {3} +N^ {_ {2}} +4H_ {2})\\
reactivo y productos
\ final {matriz}\]
La flecha se lee como “cede” o “reacciona a la forma”. Entonces Ecuación nos\(\PageIndex{1}\) dice que el dicromato de amonio (el reactivo) produce óxido de cromo (III), nitrógeno y agua (los productos).
La ecuación para esta reacción es aún más informativa cuando se escribe como
\[{(N{H_4})_2}C{r_2}{O_7}\left( s \right){\text{ }} \to {\text{ }}C{r_2}{O_3}\left( s \right) + {N_2}\left( g \right) + 4{H_2}O\left( g \right){\text{ }} \]
\(\PageIndex{2}\)La ecuación es idéntica a la ecuación\(\PageIndex{1}\) excepto por la adición de abreviaturas entre paréntesis para indicar el estado físico de cada especie. Las abreviaturas son para sólido, (l) para líquido, (g) para gas y (ac) para una solución acuosa, una solución de la sustancia en agua.
Consistente con la ley de conservación de la masa, los números de cada tipo de átomo son los mismos en ambos lados de la Ecuación\(\PageIndex{1}\) y la Ecuación\(\PageIndex{2}\). (Para mayor información sobre la ley de conservación de la masa, ver Sección 1.4) Como se ilustra en la Figura\(\PageIndex{1}\), cada lado tiene dos átomos de cromo, siete átomos de oxígeno, dos átomos de nitrógeno y ocho átomos de hidrógeno. En una ecuación química equilibrada, tanto los números de cada tipo de átomo como la carga total son los mismos en ambos lados. Ecuación\(\PageIndex{1}\) y Ecuación\(\PageIndex{2}\) son ecuaciones químicas balanceadas. Lo que es diferente en cada lado de la ecuación es cómo se disponen los átomos para hacer moléculas o iones. Una reacción química representa un cambio en la distribución de átomos pero no en el número de átomos. En esta reacción, y en la mayoría de las reacciones químicas, los enlaces se rompen en los reactivos (aquí, los enlaces Cr—O y N-H), y se forman nuevos enlaces para crear los productos (aquí, los enlaces O—H y N=N). Si los números de cada tipo de átomo son diferentes en los dos lados de una ecuación química, entonces la ecuación está desequilibrada, y no puede describir correctamente lo que sucede durante la reacción. Para proceder, primero se debe equilibrar la ecuación.
Tenga en cuenta el patrón
Una reacción química cambia solo la distribución de los átomos, no el número de átomos.
Interpretación de ecuaciones químicas
Además de proporcionar información cualitativa sobre las identidades y estados físicos de los reactivos y productos, una ecuación química equilibrada proporciona información cuantitativa. Específicamente, indica las cantidades relativas de reactivos y productos consumidos o producidos en una reacción. El número de átomos, moléculas o unidades de fórmula de un reactivo o un producto en una ecuación química equilibrada es el coeficiente Un número mayor que 1 que precede a una fórmula en una ecuación química equilibrada e indica el número de átomos, moléculas o unidades de fórmula de un reactivo o un producto. de esa especie (e.g., los 4 anteriores H 2 O en la Ecuación 7.3 .2). Cuando no se escribe ningún coeficiente frente a una especie, se supone que el coeficiente es 1. Como se ilustra en la Figura\(\PageIndex{2}\), los coeficientes nos permiten interpretar la Ecuación 7.3.1 de cualquiera de las siguientes maneras:
- Dos iones NH 4 + y un ion Cr 2 O 7 2− producen 1 unidad de fórmula de Cr 2 O 3, 1 N 2 molécula y 4 H 2 O moléculas.
- Un mol de (NH 4) 2 Cr 2 O 7 produce 1 mol de Cr 2 O 3, 1 mol de N 2 y 4 mol de H 2 O.
- Una masa de 252 g de (NH 4) 2 Cr 2 O 7 rinde 152 g de Cr 2 O 3, 28 g de N 2 y 72 g de H 2 O.
- Un total de 6.022 × 10 23 unidades de fórmula de (NH 4) 2 Cr 2 O 7 produce 6.022 × 10 23 unidades de fórmula de Cr 2 O 3, 6.022 × 10 23 moléculas de N 2, y 24.09 × 10 23 moléculas de H 2 O.
Figura\(\PageIndex{2}\) Las relaciones entre moles, masas y unidades de fórmula de compuestos en la reacción química equilibrada para el volcán dicromato de amonio
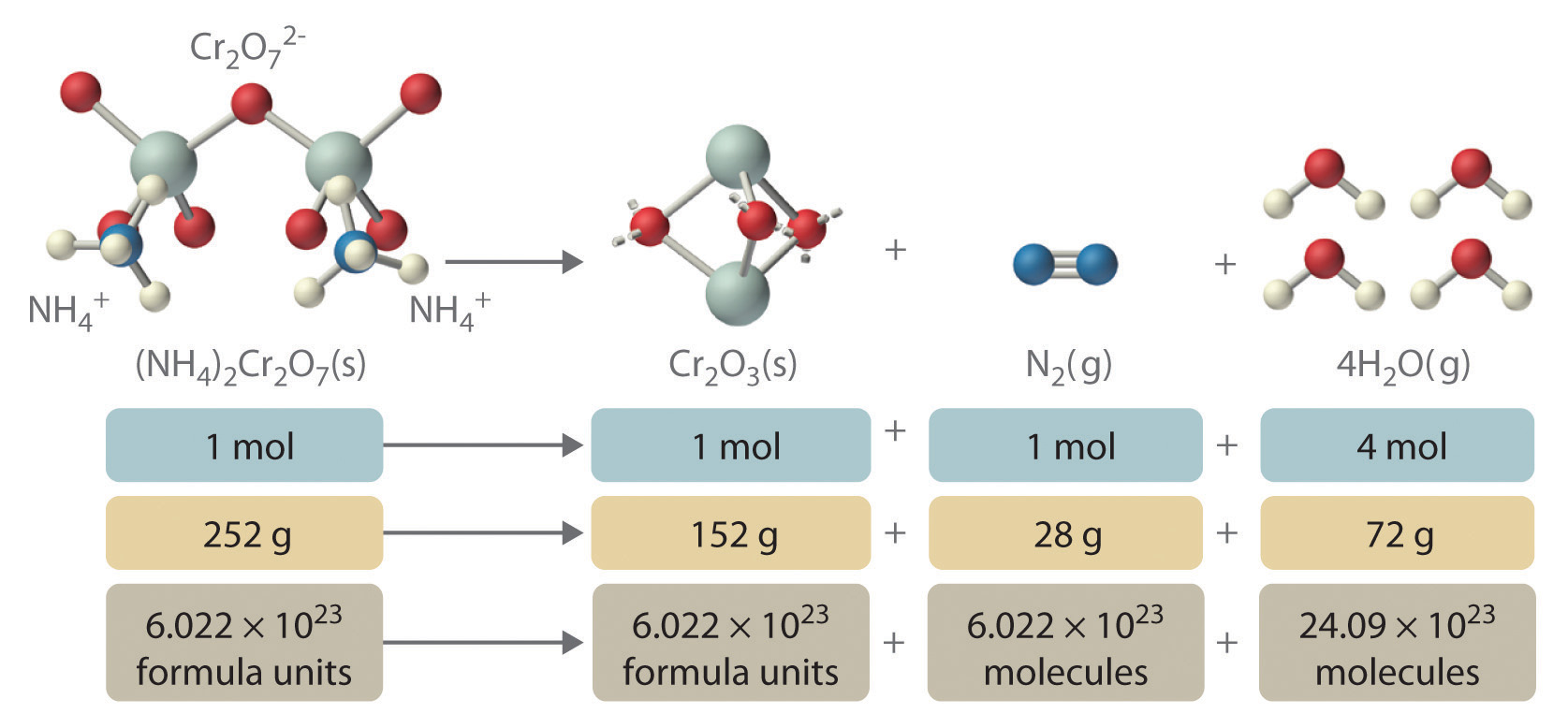
Todas estas son formas químicamente equivalentes de afirmar la información dada en la ecuación química equilibrada, utilizando los conceptos de masa molar, molar o fórmula, y el número de Avogadro. La relación entre el número de moles de una sustancia y el número de moles de otra se denomina relación molar La relación entre el número de moles de una sustancia y el número de moles de otra, como se representa mediante una ecuación química equilibrada. . Por ejemplo, la relación molar de H 2 O a N 2 en la Ecuación \(\PageIndex{1}\)es 4:1. La masa total de reactivos es igual a la masa total de productos, según lo predicho por la ley de conservación de masa de Dalton: 252 g de (NH 4) 2 Cr 2 O 7 rinde 152 + 28 + 72 = 252 g de productos. Sin embargo, la ecuación química no muestra la velocidad de reacción (rápida, lenta o nada) o si se emite energía en forma de calor o luz. Consideraremos estos temas con más detalle en el segundo semestre.
Una reacción química importante fue analizada por Antoine Lavoisier, químico francés del siglo XVIII, quien se interesó por la química de los organismos vivos así como los sistemas químicos simples. En una serie clásica de experimentos, midió el dióxido de carbono y el calor producidos por un conejillo de indias durante la respiración, en los que los compuestos orgánicos se utilizan como combustible para producir energía, dióxido de carbono y agua. Lavoisier encontró que la relación entre el calor producido y el dióxido de carbono exhalado fue similar a la relación observada para la reacción del carbón vegetal con oxígeno en el aire para producir dióxido de carbono, un proceso que los químicos llaman combustión. A partir de estos experimentos, propuso que “la respiración es una combustión, lenta es cierto, pero por lo demás perfectamente similar a la del carbón”. Lavoisier fue correcto, aunque los compuestos orgánicos consumidos en la respiración son sustancialmente diferentes de los que se encuentran en el carbón vegetal. Uno de los combustibles más importantes en el cuerpo humano es la glucosa (C 6 H 12 O 6), que es prácticamente el único combustible que se utiliza en el cerebro. Así, la combustión y la respiración son ejemplos de reacciones químicas.
La ecuación química equilibrada para la combustión de glucosa en el laboratorio (o en el cerebro) es la siguiente:
\[{C_6}{H_{12}}{O_6}\left( s \right) + 6{O_2}\left( g \right){\text{ }} \to {\text{ }}6C{O_2}\left( g \right) + 6{H_2}O\left( l \right) \notag \]
Construir una tabla que muestre cómo interpretar la información en esta ecuación en términos de
- una sola molécula de glucosa.
- moles de reactivos y productos.
- gramos de reactivos y productos representados por 1 mol de glucosa.
- números de moléculas de reactivos y productos representados por 1 mol de glucosa.
Dado: ecuación química equilibrada
Preguntado por: molécula, mole, y relaciones de masas
Estrategia:
A Utilice los coeficientes de la ecuación química balanceada para determinar las relaciones moleculares y molares.
B Utilizar las masas molares de los reactivos y productos para convertir de moles a gramos.
C Utilice el número de Avogadro para convertir de moles al número de moléculas.
Solución
Esta ecuación se equilibra como está escrita: cada lado tiene 6 átomos de carbono, 18 átomos de oxígeno y 12 átomos de hidrógeno. Por lo tanto, podemos usar los coeficientes directamente para obtener la información deseada.
A Una molécula de glucosa reacciona con 6 moléculas de O 2 para producir 6 moléculas de CO 2 y 6 moléculas de H 2 O.
B Un mol de glucosa reacciona con 6 mol de O 2 para producir 6 mol de CO 2 y 6 mol de H 2 O.
C Para interpretar la ecuación en términos de masas de reactivos y productos, necesitamos sus masas molares y las relaciones molares de la parte b. Las masas molares en gramos por mol son las siguientes: glucosa, 180.16; O 2, 31.9988; CO 2, 44.010; y H 2 O, 18.015.
\ (\ begin {matriz}
masa\; de\; reactivos &=& masa\; de\; productos\\
&\
g\; glucosa &=& g\; CO_ {2} + g\; H_ {2} O\\
&\\
1\ cancel {mol\; glucosa}\ left (\ dfrac {180.16\; g} {1\;\ cancel {mol\; glucosa}}\ derecha) +6\ cancel {mol\; O_ {2}}\ left (\ dfrac {31.9988\; g} {1\;\ cancel {mol\; O_ {2}}}\ derecha) &=& 6\ cancel {mol\; CO_ {2}}\ left (\ dfrac {44.010\; g} {1\;\ cancel {mol\; CO_ {2}}\ derecha) +6\ cancel {mol\; H_ {2} O}\ izquierda (\ dfrac {18.0158\; g} {1\;\ cancel {mol\; H_ {2} O}}\ derecha)\\
&\
372.15 \; g &=& 372.15\; g
\ end {matriz}\ noetiqueta\)
- C Un mol de glucosa contiene el número de Avogadro (6.022 × 10 23) de moléculas de glucosa. Así 6.022 × 10 23 moléculas de glucosa reaccionan con (6 × 6.022 × 10 23) = 3.613 × 10 24 moléculas de oxígeno para producir (6 × 6.022 × 10 23) = 3.613 × 10 24 moléculas cada una de CO 2 y H 2 O.
En forma tabular:
C 6 H 12 O 6 (s) + 6O 2 (g) → 6CO 2 (g) + 6H 2 O (l) a. 1 molécula 6 moléculas 6 moléculas 6 moléculas b. 1 mol 6 mol 6 mol 6 mol c. 180.16 g 191.9928 g 264.06 g 108.09 g d. 6.022 × 10 23 moléculas 3.613 × 10 24 moléculas 3.613 × 10 24 moléculas 3.613 × 10 24 moléculas
El nitrato de amonio es un fertilizante común, pero en condiciones incorrectas puede ser peligroso. En 1947, un barco cargado con nitrato de amonio se incendió durante la descarga y explotó, destruyendo la ciudad de Texas City, Texas. La explosión resultó de la siguiente reacción:
\[2N{H_4}N{O_3}\left( s \right){\text{ }} \to {\text{ }}2{N_2}\left( g \right) + 4{H_2}O\left( g \right) + {O_2}\left( g \right) \notag \]
Construir una tabla que muestre cómo interpretar la información en la ecuación en términos de
- moléculas e iones individuales.
- moles de reactivos y productos.
- gramos de reactivos y productos dados 2 mol de nitrato amónico.
- números de moléculas o unidades de fórmula de reactivos y productos dados 2 mol de nitrato de amonio.
- Contestar
-
2NH 4 NO 3 (s) → 2N 2 (g) + 4H 2 O (g) + O 2 (g) a. 2NH 4 + iones y 2NO 3 − iones 2 moléculas 4 moléculas 1 molécula b. 2 mol 2 mol 4 mol 1 mol c. 160.0864 g 56.0268 g 72.0608 g 31.9988 g d. 1.204 × 10 24 unidades de fórmula 1.204 × 10 24 moléculas 2.409 × 10 24 moléculas 6.022 × 10 23 moléculas 
El nitrato de amonio puede ser peligroso. Esta fotografía aérea de la ciudad de Texas, Texas, muestra la devastación causada por la explosión de un buque de nitrato de amonio el 16 de abril de 1947.
El nitrato de amonio es un fertilizante común, pero en condiciones incorrectas puede ser peligroso. En 1947, un barco cargado con nitrato de amonio se incendió durante la descarga y explotó, destruyendo la ciudad de Texas City, Texas. La explosión resultó de la siguiente reacción:
\[2N{H_4}N{O_3}\left( s \right){\text{ }} \to {\text{ }}2{N_2}\left( g \right) + 4{H_2}O\left( g \right) + {O_2}\left( g \right) \notag \]
Construir una tabla que muestre cómo interpretar la información en la ecuación en términos de
- moléculas e iones individuales.
- moles de reactivos y productos.
- gramos de reactivos y productos dados 2 mol de nitrato amónico.
- números de moléculas o unidades de fórmula de reactivos y productos dados 2 mol de nitrato de amonio.
Contestar
Equilibrio de ecuaciones químicas simples
Cuando un químico se encuentra con una nueva reacción, no suele venir con una etiqueta que muestre la ecuación química equilibrada. En cambio, el químico debe identificar los reactivos y productos y luego escribirlos en forma de una ecuación química que puede o no ser equilibrada como se escribió primero. Consideremos, por ejemplo, la combustión de n-heptano (C 7 H 16), un componente importante de la gasolina:
\[{C_7}{H_{16}}\left( l \right) + {O_2}\left( g \right){\text{ }} \to {\text{ }}C{O_2}\left( g \right) + {H_2}O\left( g \right) \]
La combustión completa de cualquier hidrocarburo con suficiente oxígeno siempre produce dióxido de carbono y agua (Figura\(\PageIndex{3}\)).
Figura\(\PageIndex{3}\) Un Ejemplo de una Reacción de Combustión
La cera en una vela es un hidrocarburo de alta masa molecular, que produce dióxido de carbono gaseoso y vapor de agua en una reacción de combustión. Cuando se deja quemar la vela dentro de un matraz, se forman gotas de agua, uno de los productos de la combustión, las cuales podemos verificar usando papel de prueba de cloruro de cobalto. Podemos demostrar que el dióxido de carbono es un producto precipitando carbonato de calcio a partir del agua de cal.
La ecuación no\(\PageIndex{3}\) está equilibrada: los números de cada tipo de átomo en el lado reactivo de la ecuación (7 átomos de carbono, 16 átomos de hidrógeno y 2 átomos de oxígeno) no son los mismos que los números de cada tipo de átomo en el lado del producto (1 átomo de carbono, 2 átomos de hidrógeno y 3 átomos de oxígeno). En consecuencia, debemos ajustar los coeficientes de los reactivos y productos para dar los mismos números de átomos de cada tipo en ambos lados de la ecuación. Debido a que las identidades de los reactivos y productos son fijas, no podemos equilibrar la ecuación cambiando los subíndices de los reactivos o los productos. Para ello cambiaría la identidad química de las especies que se describen, como se ilustra en la Figura\(\PageIndex{4}\).
Ecuaciones\(\PageIndex{4}\) de equilibrio de figuras
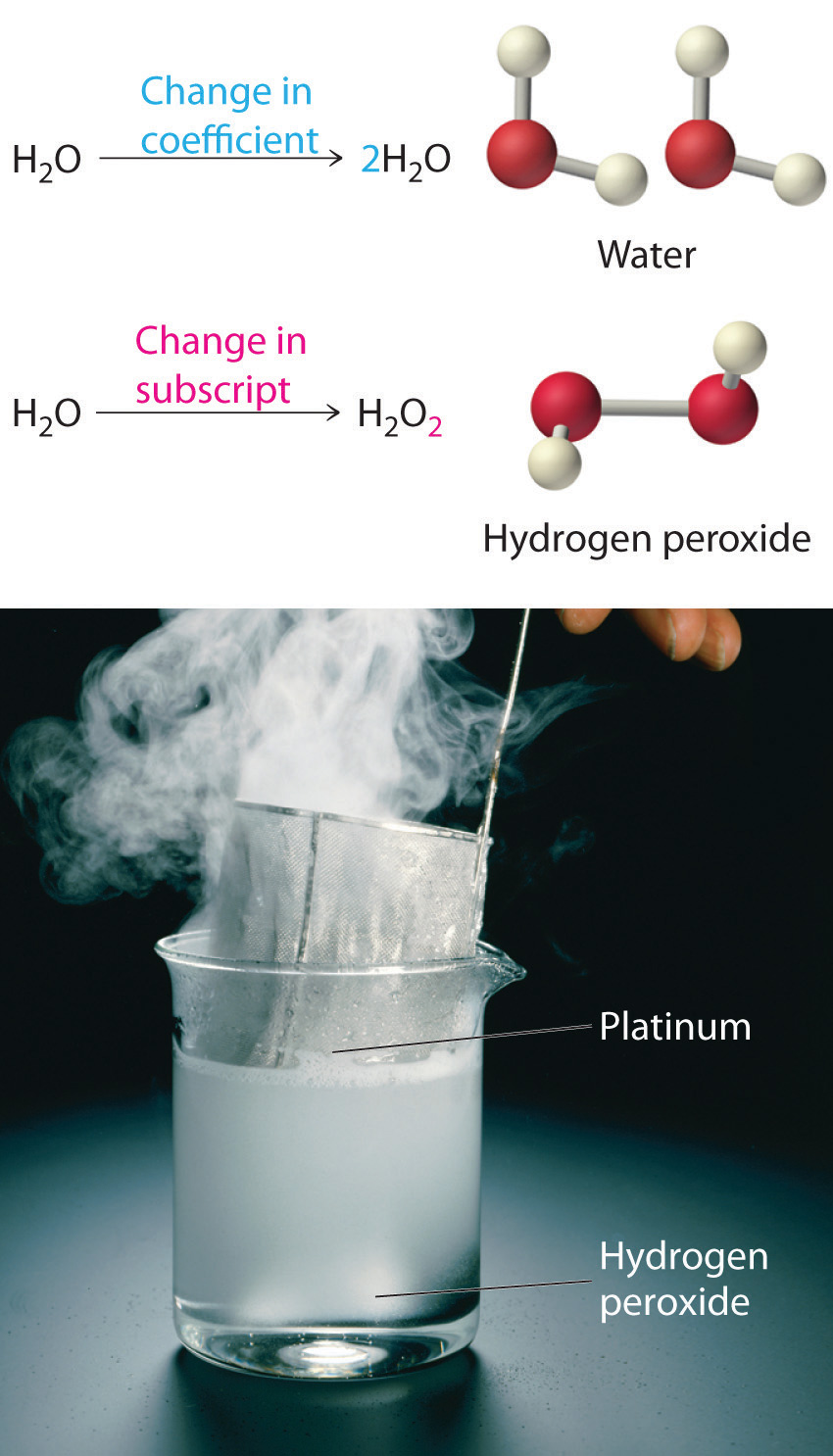
No se pueden cambiar subíndices en una fórmula química para equilibrar una ecuación química; solo se pueden cambiar los coeficientes. El cambio de subíndices cambia las proporciones de átomos en la molécula y las propiedades químicas resultantes. Por ejemplo, el agua (H 2 O) y el peróxido de hidrógeno (H 2 O 2) son sustancias químicamente distintas. H 2 O 2 se descompone a H 2 O y O 2 gas cuando entra en contacto con el metal platino, mientras que no se produce tal reacción entre el agua y el platino.
El método más simple y generalmente útil para equilibrar ecuaciones químicas es la “inspección”, mejor conocida como ensayo y error. Presentamos un enfoque eficiente para equilibrar una ecuación química usando este método.
Pasos para equilibrar una ecuación química
- Identificar la sustancia más compleja.
- Comenzando con esa sustancia, elija un elemento que aparezca en un solo reactivo y un producto, si es posible. Ajustar los coeficientes para obtener el mismo número de átomos de este elemento en ambos lados.
- Equilibrar iones poliatómicos (si están presentes) como una unidad.
- Equilibrar los átomos restantes, generalmente terminando con la sustancia menos compleja y usando coeficientes fraccionarios si es necesario. Si se ha utilizado un coeficiente fraccionario, multiplique ambos lados de la ecuación por el denominador para obtener números enteros para los coeficientes.
- Contar los números de átomos de cada tipo en ambos lados de la ecuación para asegurarse de que la ecuación química está equilibrada.
Para demostrar este enfoque, usemos como ejemplo la combustión de n-heptano (Ecuación\(\PageIndex{3}\)).
- Identificar la sustancia más compleja. La sustancia más compleja es la que tiene el mayor número de átomos diferentes, que es C 7 H 16. Supondremos inicialmente que la ecuación química equilibrada final contiene 1 molécula o unidad de fórmula de esta sustancia.
- Ajustar los coeficientes. Trate de ajustar los coeficientes de las moléculas del otro lado de la ecuación para obtener los mismos números de átomos en ambos lados. Debido a que una molécula de n-heptano contiene 7 átomos de carbono, necesitamos 7 moléculas de CO 2, cada una de las cuales contiene 1 átomo de carbono, en el lado derecho:
\[{C_7}{H_{16}} + {O_2} \to 7C{O_2} + {H_2}O \]
-
Equilibrar iones poliatómicos como unidad. No hay iones poliatómicos a considerar en esta reacción.
- Equilibrar los átomos restantes. Debido a que una molécula de n-heptano contiene 16 átomos de hidrógeno, necesitamos 8 moléculas de H 2 O, cada una de las cuales contiene 2 átomos de hidrógeno, en el lado derecho:
\[{C_7}{H_{16}} + {O_2} \to {\text{ }}7C{O_2} + 8{H_2}O \]
- Los átomos de carbono e hidrógeno están ahora equilibrados, pero tenemos 22 átomos de oxígeno en el lado derecho y solo 2 átomos de oxígeno en el izquierdo. Podemos equilibrar los átomos de oxígeno ajustando el coeficiente frente a la sustancia menos compleja, O 2, en el lado reactivo:
\[{C_7}{H_{16}} + 11{O_2} \to {\text{ }}7C{O_2} + 8{H_2}O \]
- Revisa tu trabajo. La ecuación ahora está equilibrada, y no hay coeficientes fraccionarios: hay 7 átomos de carbono, 16 átomos de hidrógeno y 22 átomos de oxígeno en cada lado. Siempre verifique para asegurarse de que una ecuación química esté equilibrada.
La suposición de que la ecuación química equilibrada final contiene solo una molécula o unidad de fórmula de la sustancia más compleja no siempre es válida, pero es un buen lugar para comenzar. Consideremos, por ejemplo, una reacción similar, la combustión de isooctano (C 8 H 18). Debido a que la combustión de cualquier hidrocarburo con oxígeno produce dióxido de carbono y agua, la ecuación química desequilibrada es la siguiente:
\[{C_8}{H_{18}}\left( l \right) + {O_2}\left( g \right){\text{ }} \to {\text{ }}C{O_2}\left( g \right) + {H_2}O\left( g \right) \]
- Identificar la sustancia más compleja. Comience el proceso de equilibrio asumiendo que la ecuación química equilibrada final contiene una sola molécula de isooctano.
- Ajustar los coeficientes. El primer elemento que aparece solo una vez en los reactivos es el carbono: 8 átomos de carbono en isooctano significa que debe haber 8 moléculas de CO 2 en los productos:
\[{C_8}{H_{18}}\left( l \right) + {O_2}\left( g \right){\text{ }} \to {\text{ 8}}C{O_2}\left( g \right) + {H_2}O\left( g \right) \]
- Equilibrar iones poliatómicos como unidad. Este paso no se aplica a esta ecuación.
- Equilibrar los átomos restantes. Dieciocho átomos de hidrógeno en isooctano significa que debe haber 9 moléculas de H 2 O en los productos:
\[{C_8}{H_{18}}\left( l \right) + {O_2}\left( g \right){\text{ }} \to {\text{ 8}}C{O_2}\left( g \right) + 9{H_2}O\left( g \right) \]
Los átomos de carbono e hidrógeno están ahora equilibrados, pero tenemos 25 átomos de oxígeno en el lado derecho y solo 2 átomos de oxígeno en el izquierdo. Podemos equilibrar la sustancia menos compleja, O 2, pero debido a que hay 2 átomos de oxígeno por molécula de O 2, debemos usar un coeficiente fraccional (25/2) para equilibrar los átomos de oxígeno:
\[{C_8}{H_{18}}\left( l \right) + 25/2{O_2}\left( g \right){\text{ }} \to {\text{ 8}}C{O_2}\left( g \right) + 9{H_2}O\left( g \right) \]
La ecuación 7.3.1 0 ahora está balanceada, pero usualmente escribimos ecuaciones con coeficientes de número entero. Podemos eliminar el coeficiente fraccional multiplicando todos los coeficientes en ambos lados de la ecuación química por 2:
\[2{C_8}{H_{18}}\left( l \right) + 25{O_2}\left( g \right){\text{ }} \to {\text{ 16}}C{O_2}\left( g \right) + 18{H_2}O\left( g \right) \]
- Revisa tu trabajo. La ecuación química equilibrada tiene 16 átomos de carbono, 36 átomos de hidrógeno y 50 átomos de oxígeno en cada lado.
Equilibrar ecuaciones requiere algo de práctica de tu parte así como algo de sentido común. Si te encuentras usando coeficientes muy grandes o si has pasado varios minutos sin éxito, regresa y asegúrate de haber escrito correctamente las fórmulas de los reactivos y productos.
La reacción del mineral hidroxiapatita [Ca 5 (PO 4) 3 (OH)] con ácido fosfórico y agua da Ca (H 2 PO 4) 2 ·H 2 O (dihidrogenofosfato de calcio monohidrato). Escribe y equilibra la ecuación para esta reacción.
Dado: reactivos y producto
Preguntado por: ecuación química balanceada
Estrategia:
A Identificar el producto y los reactivos y luego escribir la ecuación química desequilibrada.
B Siga los pasos para equilibrar una ecuación química.
Solución
Primero debemos identificar el producto y los reactivos y escribir una ecuación para la reacción. Las fórmulas para hidroxiapatita y dihidrogenofosfato de calcio monohidrato se dan en el problema. Recordemos que el ácido fosfórico es H 3 PO 4. La ecuación inicial (desequilibrada) es la siguiente:
\[C{a_5}{(P{O_4})_3}\left( {OH} \right)\left( s \right) + {H_3}P{O_4}\left( {aq} \right) + {H_2}O\left( l \right){\text{ }} \to {\text{ }}Ca{({H_2}P{O_4})_2}\cdot{H_2}O\left( s \right) \notag \]
- Identificar la sustancia más compleja. Comenzamos asumiendo que solo una molécula o unidad de fórmula de la sustancia más compleja, Ca 5 (PO 4) 3 (OH), aparece en la ecuación química equilibrada.
- Ajustar los coeficientes. Debido a que el calcio está presente en un solo reactivo y un producto, comenzamos con él. Una unidad de fórmula de Ca 5 (PO 4) 3 (OH) contiene 5 átomos de calcio, por lo que necesitamos 5 Ca (H 2 PO 4) 2 ·H 2 O en el lado derecho: \[C{a_5}{(P{O_4})_3}\left( {OH} \right) + {H_3}P{O_4} + {H_2}O{\text{ }} \to {\text{ }}5Ca{({H_2}P{O_4})_2}\cdot{H_2}O \notag \]
- Equilibrar iones poliatómicos como unidad. Por lo general, es más fácil equilibrar una ecuación si reconocemos que ciertas combinaciones de átomos ocurren en ambos lados. En esta ecuación, el ion fosfato poliatómico (PO 4 3−), aparece en tres lugares. En H 3 PO 4, el ion fosfato se combina con tres iones H + para producir ácido fosfórico (H 3 PO 4), mientras que en Ca (H 2 PO 4) 2 ·H 2 O se combina con dos iones H + para dar el ion dihidrógeno fosfato. Por lo tanto, es más fácil equilibrar PO 4 como una unidad en lugar de contar átomos individuales de fósforo y oxígeno. Hay 10 unidades PO 4 en el lado derecho pero solo 4 en el izquierdo. La forma más sencilla de equilibrar las unidades PO 4 es colocar un coeficiente de 7 frente a H 3 PO 4:
\[C{a_5}{(P{O_4})_3}\left( {OH} \right) + 7{H_3}P{O_4} + {H_2}O{\text{ }} \to {\text{ }}5Ca{({H_2}P{O_4})_2}\cdot{H_2}O \notag \]
Aunque OH − también es un ion poliatómico, no aparece en ambos lados de la ecuación. Por lo que el oxígeno y el hidrógeno deben equilibrarse por separado.
- Equilibrar los átomos restantes. Ahora tenemos 30 átomos de hidrógeno en el lado derecho pero solo 24 en el izquierdo. Podemos equilibrar los átomos de hidrógeno usando la sustancia menos compleja, H 2 O, colocando un coeficiente de 4 frente a H 2 O en el lado izquierdo, dando un total de 4 moléculas de H 2 O:
\[C{a_5}{(P{O_4})_3}\left( {OH} \right)\left( s \right) + 7{H_3}P{O_4}\left( {aq} \right) + 4{H_2}O\left( l \right){\text{ }} \to {\text{ }}5Ca{({H_2}P{O_4})_2}\cdot{H_2}O\left( s \right) \notag \]
La ecuación ahora está equilibrada. A pesar de que no hemos equilibrado explícitamente los átomos de oxígeno, hay 45 átomos de oxígeno en cada lado.
- Revisa tu trabajo. Ambos lados de la ecuación contienen 5 átomos de calcio, 7 átomos de fósforo, 30 átomos de hidrógeno y 45 átomos de oxígeno.
La fermentación es un proceso bioquímico que permite que las células de levadura vivan en ausencia de oxígeno. Los humanos la han explotado durante siglos para producir vino y cerveza y hacer subir el pan. En la fermentación, azúcares como la glucosa se convierten en etanol y dióxido de carbono. Escribir una reacción química equilibrada para la fermentación de la glucosa.

Uso comercial de la fermentación. a) Se utilizan cubas de microcervecería para preparar cerveza. b) La fermentación de la glucosa por células de levadura es la reacción que hace posible la producción de cerveza.
- Contestar
-
\( {C_6}{H_{12}}{O_6}\left( s \right){\text{ }} \to {\text{ }}2{C_2}{H_5}OH\left( l \right) + 2C{O_2}\left( g \right) \notag \)
Resumen
En una reacción química, una o más sustancias se transforman en nuevas sustancias. Una reacción química se describe mediante una ecuación química, una expresión que da las identidades y cantidades de las sustancias involucradas en una reacción. Una ecuación química muestra el compuesto o compuestos de partida —los reactivos — a la izquierda y los compuestos finales —los productos — a la derecha, separados por una flecha. En una ecuación química equilibrada, los números de átomos de cada elemento y la carga total son los mismos en ambos lados de la ecuación. El número de átomos, moléculas o unidades de fórmula de un reactivo o producto en una ecuación química equilibrada es el coeficiente de esa especie. La relación molar de dos sustancias en una reacción química es la relación de sus coeficientes en la ecuación química equilibrada.
Llave para llevar
- Una reacción química se describe mediante una ecuación química que da las identidades y cantidades de los reactivos y los productos.
Problemas conceptuales
-
¿Cómo concuerda una ecuación química equilibrada con la ley de proporciones definidas?
-
¿Cuál es la diferencia entre S 8 y 8S? Utilice este ejemplo para explicar por qué no se deben cambiar los subíndices en una fórmula.
-
¿Qué factores determinan si una ecuación química está equilibrada?
-
¿Qué información se puede obtener de una ecuación química equilibrada? ¿Una ecuación química equilibrada da información sobre la velocidad de una reacción?
Problemas numéricos
-
Equilibrar cada ecuación química.
- KI (aq) + Br 2 (l) → KBr (aq) + I 2 (s)
- MnO 2 (s) + HCl (ac) → MnCl 2 (ac) + Cl 2 (g) + H 2 O (l)
- Na 2 O (s) + H 2 O (l) → NaOH (ac)
- Cu (s) + AgnO 3 (aq) → Cu (NO 3) 2 (aq) + Ag (s)
- SO 2 (g) + H 2 O (l) → H 2 SO 3 (aq)
- S 2 Cl 2 (l) + NH 3 (l) → S 4 N 4 (s) + S 8 (s) + NH 4 Cl (s)
-
Equilibrar cada ecuación química.
- Ser (s) + O 2 (g) → BeO (s)
- N 2 O 3 (g) + H 2 O (l) → HNO 2 (aq)
- Na (s) + H 2 O (l) → NaOH (ac) + H 2 (g)
- CaO (s) + HCl (ac) → CaCl 2 (aq) + H 2 O (l)
- CH 3 NH 2 (g) + O 2 (g) → H 2 O (g) + CO 2 (g) + N 2 (g)
- Fe (s) + H 2 SO 4 (aq) → FESO 4 (aq) + H 2 (g)
-
Equilibrar cada ecuación química.
- N 2 O 5 (g) → NO 2 (g) + O 2 (g)
- Nano 3 (s) → NaNO 2 (s) + O 2 (g)
- Al (s) + NH 4 NO 3 (s) → N 2 (g) + H 2 O (l) + Al 2 O 3 (s)
- C 3 H 5 N 3 O 9 (l) → CO 2 (g) + N 2 (g) + H 2 O (g) + O 2 (g)
- reacción de butano con exceso de oxígeno
- IO 2 F (s) + BrF 3 (l) → SI 5 (l) + Br 2 (l) + O 2 (g)
-
Equilibrar cada ecuación química.
- H 2 S (g) + O 2 (g) → H 2 O (l) + S 8 (s)
- KCl (aq) + HNO 3 (aq) + O 2 (g) → KNO 3 (aq) + Cl 2 (g) + H 2 O (l)
- NH 3 (g) + O 2 (g) → NO (g) + H 2 O (g)
- CH 4 (g) + O 2 (g) → CO (g) + H 2 (g)
- NaF (ac) + Th (NO 3) 4 (aq) → NaN 3 (aq) + THF 4 (s)
- Ca 5 (PO 4) 3 F (s) + H 2 SO 4 (aq) + H 2 O (l) → H 3 PO 4 (aq) + CaSO 4 ·2H 2 O (s) + HF (aq)
-
Equilibrar cada ecuación química.
- NaCl (ac) + H 2 SO 4 (ac) → Na 2 SO 4 (ac) + HCl (g)
- K (s) + H 2 O (l) → KOH (aq) + H 2 (g)
- reacción de octano con exceso de oxígeno
- S 8 (s) + Cl 2 (g) → S 2 Cl 2 (l)
- CH 3 OH (l) + I 2 (s) + P 4 (s) → CH 3 I (l) + H 3 PO 4 (aq) + H 2 O (l)
- (CH 3) 3 Al (s) + H 2 O (l) → CH 4 (g) + Al (OH) 3 (s)
-
Escribe una ecuación química equilibrada para cada reacción.
- El aluminio reacciona con el bromo.
- El sodio reacciona con el cloro.
- Hidróxido de aluminio y ácido acético reaccionan para producir acetato de aluminio y agua.
- El amoníaco y el oxígeno reaccionan para producir monóxido de nitrógeno y agua.
- El nitrógeno y el hidrógeno reaccionan a temperatura y presión elevadas para producir amoníaco.
- Una solución acuosa de cloruro de bario reacciona con una solución de sulfato de sodio.
-
Escribe una ecuación química equilibrada para cada reacción.
- Quemaduras de magnesio en oxígeno.
- El dióxido de carbono y el óxido de sodio reaccionan para producir carbonato de sodio.
- El aluminio reacciona con el ácido clorhídrico.
- Una solución acuosa de nitrato de plata reacciona con una solución de cloruro de potasio.
- El metano se quema en oxígeno.
- El nitrato de sodio y el ácido sulfúrico reaccionan para producir sulfato de sodio y ácido nítrico.
Colaboradores
- Anonymous
Modificado por Joshua Halpern


