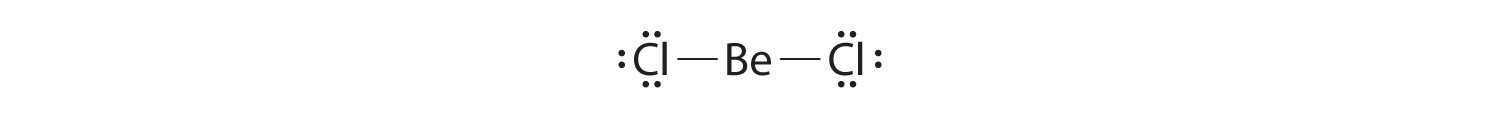8.6: Excepciones a la Regla del Octeto
- Page ID
- 78120
- Para entender por qué hay excepciones a la regla del octeto y cuáles son
Las excepciones generales a la regla del octeto incluyen moléculas que tienen un número impar de electrones y moléculas en las que uno o más átomos poseen más o menos de ocho electrones. Las moléculas con un número impar de electrones son relativamente raras en los bloques s y p, pero bastante comunes entre los elementos del bloque d y f. Los compuestos con más de un octeto de electrones alrededor de un átomo se denominan moléculas de valencia expandida. Un modelo para explicar su existencia utiliza uno o más orbitales d en unión además de los orbitales de valencia ns y np. Tales especies son conocidas solo por átomos en el período 3 o inferior, que contienen nd subconchas en su caparazón de valencia. Objetivo de Aprendizaje es asignar un símbolo de punto de Lewis a elementos que no tienen un octeto de electrones en sus compuestos.
Las estructuras de puntos de Lewis proporcionan un modelo simple para racionalizar la unión en la mayoría de los compuestos conocidos. Sin embargo, hay tres excepciones generales a la regla del octeto:
- Moléculas, tales como NO, con un número impar de electrones;
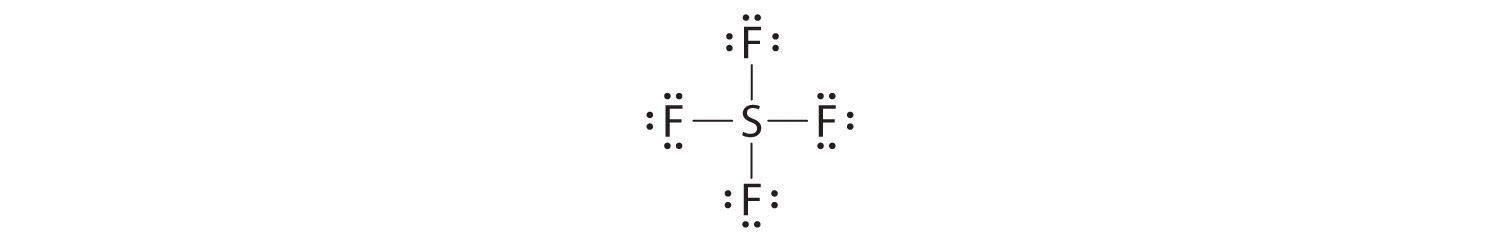
- Moléculas en las que uno o más átomos poseen más de ocho electrones, tales como SF 6; y
- Moléculas como Bcl3, en las que uno o más átomos poseen menos de ocho electrones.
Número impar de electrones
Debido a que la mayoría de las moléculas o iones que consisten en elementos de bloque s y p contienen números pares de electrones, su unión puede describirse usando un modelo que asigna cada electrón a un par de enlace o a un par solitario. Las moléculas o iones que contienen elementos del bloque d contienen frecuentemente un número impar de electrones, y su unión no puede describirse adecuadamente utilizando el enfoque simple que hemos desarrollado hasta ahora. Sin embargo, hay algunas moléculas que contienen solo elementos de p -bloque que tienen un número impar de electrones. Algunos ejemplos importantes son el óxido nítrico (NO), cuya importancia bioquímica se describió en capítulos anteriores; el dióxido de nitrógeno (NO 2), un agente oxidante en la propulsión de cohetes; y el dióxido de cloro (ClO 2), que se utiliza en plantas de purificación de agua. Considera NO, por ejemplo. Con 5 + 6 = 11 electrones de valencia, no hay manera de dibujar una estructura de Lewis que le dé a cada átomo un octeto de electrones. Moléculas como NO, NO 2 y ClO 2 requieren un tratamiento más sofisticado de unión.
| Ejemplo 1: La\(NO\) Molécula |
|---|
| \ (NO\) Molécula” class="lt-chem-38812">
Dibujar la estructura de Lewis para la molécula de óxido nitroso (NO). Solución 1. Electrones totales: 6+5= 11 2. Estructura de unión: 3. Octeto sobre elemento “exterior”: 4. Resto de electrones (11-8 = 3) en el átomo “central”: 5. Actualmente hay 5 electrones de valencia alrededor del nitrógeno. Un doble enlace colocaría 7 alrededor del nitrógeno, y un triple enlace colocaría 9 alrededor del nitrógeno. Parecemos incapaces de obtener un octeto alrededor de cada átomo |
Más que un octeto de electrones
La excepción más común a la regla del octeto es una molécula o un ion con al menos un átomo que posee más de un octeto de electrones. Dichos compuestos se encuentran para elementos del periodo 3 y posteriores. Los ejemplos de los elementos del bloque p incluyen SF 6, una sustancia utilizada por la industria de energía eléctrica para aislar líneas de alto voltaje, y los iones SO 4 2− y PO 4 3−.
Veamos el hexafluoruro de azufre (SF 6), cuya estructura de Lewis debe acomodar un total de 48 electrones de valencia [6 + (6 × 7) = 48]. Si organizamos los átomos y electrones simétricamente, obtenemos una estructura con seis enlaces al azufre; es decir, es de seis coordenadas. Cada átomo de flúor tiene un octeto, pero el átomo de azufre tiene 12 electrones rodeándolo en lugar de 8. El tercer paso en nuestro procedimiento para escribir estructuras de electrones de Lewis, en el que colocamos un par de electrones entre cada par de átomos unidos, requiere que un átomo tenga más de 8 electrones siempre que esté unido a más de 4 átomos más.

La regla del octeto se basa en el hecho de que cada orbital de valencia (típicamente, un ns y tres np orbitales) puede acomodar solo dos electrones. Para acomodar más de ocho electrones, el azufre debe estar usando no solo los orbitales de valencia ns y np sino también orbitales adicionales. El azufre tiene una configuración de electrones [Ne] 3 s 2 3 p 4 3 d 0, por lo que en principio podría acomodar más de ocho electrones de valencia mediante el uso de uno o más orbitales d. Por lo tanto, especies como SF 6 a menudo se denominan moléculas de valencia expandida. Si tales compuestos realmente utilizan o no orbitales d en la unión es polémico, pero este modelo explica por qué los compuestos existen con más de un octeto de electrones alrededor de un átomo.
No existe correlación entre la estabilidad de una molécula o un ion y si tiene o no una capa de valencia expandida. Algunas especies con valencias expandidas, como PF 5, son altamente reactivas, mientras que otras, como SF 6, son muy poco reactivas. De hecho, SF 6 es tan inerte que tiene muchas aplicaciones comerciales. Además de su uso como aislante eléctrico, se utiliza como refrigerante en algunas centrales nucleares, y es el gas presurizante en pelotas de tenis “no presurizadas”.
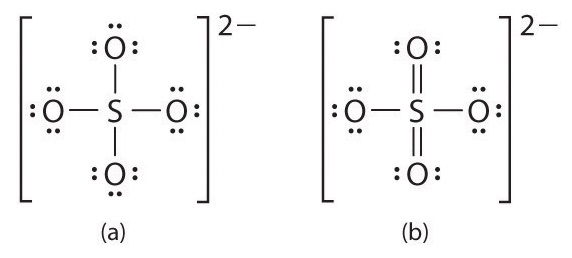
A menudo se escribe una capa de valencia expandida para oxoaniones de los elementos p -block más pesados, como sulfato (SO 4 2−) y fosfato (PO 4 3−). El sulfato, por ejemplo, tiene un total de 32 electrones de valencia [6 + (4 × 6) + 2]. Si utilizamos un solo par de electrones para conectar el azufre y cada oxígeno, obtenemos la estructura de Lewis de cuatro coordenadas (a). Sabemos que el azufre puede acomodar más de ocho electrones mediante el uso de sus orbitales de valencia d vacíos, al igual que en SF 6. Una estructura alternativa (b) se puede escribir con dobles enlaces S=O, haciendo que el azufre vuelva a seis coordenadas. Podemos dibujar otras cinco estructuras de resonancia equivalentes a (b) que varían sólo en la disposición de los enlaces simples y dobles. De hecho, los datos experimentales muestran que los enlaces S-a-O en el ion SO 4 2− tienen una longitud intermedia entre enlaces simples y dobles, como se esperaba para un sistema cuyas estructuras de resonancia contienen dos enlaces sencillos S-O y dos dobles enlaces S=O. Al calcular las cargas formales sobre las estructuras (a) y (b), vemos que el átomo S en (a) tiene una carga formal de +2, mientras que el átomo S en (b) tiene una carga formal de 0. Así, mediante el uso de un octeto expandido, se puede eliminar una carga formal +2 en S.
Menos que un octeto de electrones
Las moléculas con átomos que poseen menos de un octeto de electrones generalmente contienen los elementos de bloque s y p más ligeros, especialmente berilio, típicamente con solo cuatro electrones alrededor del átomo central, y boro, típicamente con seis. Un ejemplo, el tricloruro de boro (BCl3) se utiliza para producir fibras para reforzar raquetas de tenis y palos de golf de alta tecnología. El compuesto tiene 24 electrones de valencia y la siguiente estructura de Lewis:
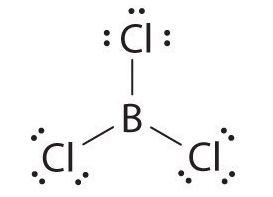
El átomo de boro tiene sólo seis electrones de valencia, mientras que cada átomo de cloro tiene ocho. Una solución razonable podría ser usar un par solitario de uno de los átomos de cloro para formar un doble enlace B a Cl:
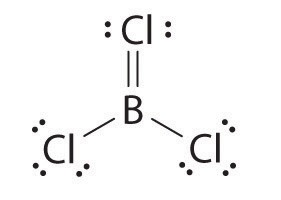
Esta estructura de resonancia, sin embargo, da como resultado una carga formal de +1 en el átomo de Cl doblemente unido y -1 en el átomo B. La alta electronegatividad de Cl hace que esta separación de carga sea poco probable y sugiere que esta no es la estructura de resonancia más importante para BcL 3. Esta conclusión se demuestra válida con base en las tres longitudes de enlace B—Cl equivalentes de 173pm que no tienen carácter de doble enlace. Los compuestos deficientes en electrones como el Bcl3 tienen una fuerte tendencia a ganar un par adicional de electrones al reaccionar con especies con un par solitario de electrones.
| Ejemplo 8 |
|---|
|
Dibuje estructuras de puntos de Lewis para cada compuesto.
Incluir las estructuras de resonancia cuando corresponda. Dado: dos compuestos Preguntado por: Estructuras de electrones de Lewis Estrategia:
Solución:
|
| Ejercicio 8 |
|---|
|
Dibuje estructuras de puntos Lewis para\(XeF_4\). Contestar 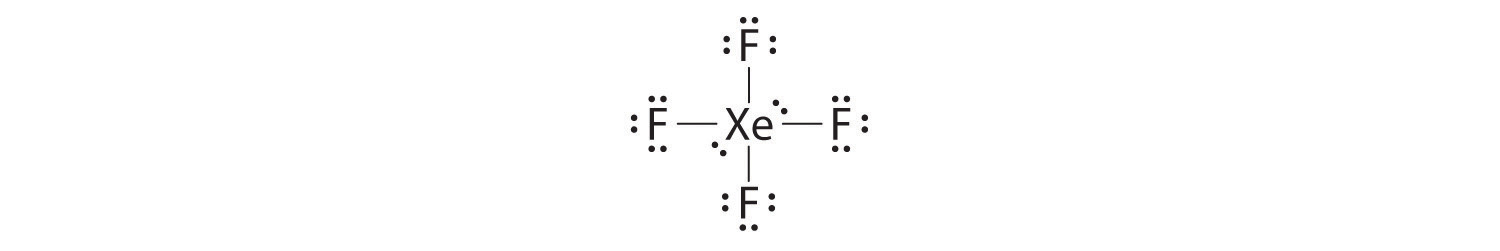 |
| Nota |
|---|
|