8.7: Ácidos y bases de Lewis
- Page ID
- 78131
Objetivos de aprendizaje
- Identificar ácidos y bases de Lewis.
Un ácido de Lewis es un compuesto con una fuerte tendencia a aceptar un par adicional de electrones de una base de Lewis, que puede donar un par de electrones. Tal reacción ácido-base forma un aducto, que es un compuesto con un enlace covalente coordinado en el que ambos electrones son proporcionados por solo uno de los átomos. Las moléculas deficientes en electrones, que tienen menos de un octeto de electrones alrededor de un átomo, son relativamente comunes. Tienden a adquirir una configuración electrónica de octeto al reaccionar con un átomo que tiene un par solitario de electrones. Objetivo de aprendizaje es identificar ácidos y bases de Lewis.
Introducción
El concepto Brønsted—Lowry de ácidos y bases define una base como cualquier especie que puede aceptar un protón, y un ácido como cualquier sustancia que pueda donar un protón. Lewis propuso una definición alternativa que se centra en pares de electrones en su lugar. Una base de Lewis se define como cualquier especie que pueda donar un par de electrones, y un ácido de Lewis es cualquier especie que pueda aceptar un par de electrones. Todas las bases Brønsted—Lowry (aceptores de protones), como OH −, H 2 O y NH 3, también son donantes de pares de electrones. Así, la definición de Lewis de ácidos y bases no contradice la definición de Brønsted-Lowry. Más bien, amplía la definición de ácidos para incluir sustancias distintas al ion H +.
Las moléculas deficientes en electrones, como Bcl3, contienen menos de un octeto de electrones alrededor de un átomo y tienen una fuerte tendencia a ganar un par adicional de electrones al reaccionar con sustancias que poseen un par solitario de electrones. La definición de Lewis, que es menos restrictiva que la definición de Brønsted—Lowry o Arrhenius, surge de su observación de esta tendencia. Una reacción general de Brønsted-Lowry ácido-base se puede representar en símbolos de electrones de Lewis de la siguiente manera:
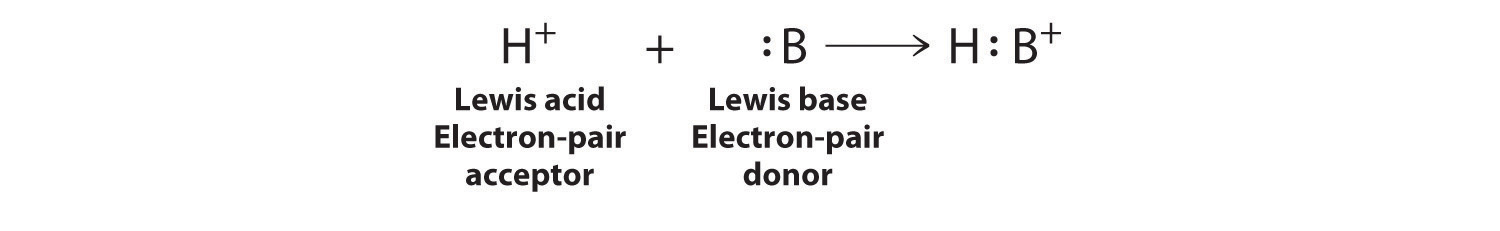
El protón (H +), que no tiene electrones de valencia, es un ácido de Lewis porque acepta un par solitario de electrones en la base para formar un enlace. El protón, sin embargo, es solo una de las muchas especies deficientes en electrones que se sabe que reaccionan con bases. Por ejemplo, los compuestos neutros de boro, aluminio, y los otros elementos del Grupo 13, que poseen solo seis electrones de valencia, tienen una tendencia muy fuerte a ganar un par de electrones adicional. Tales compuestos son, por lo tanto, potentes ácidos de Lewis que reaccionan con un donante de pares de electrones como el amoníaco para formar un aducto ácido-base, un nuevo enlace covalente, como se muestra aquí para el trifluoruro de boro (BF 3):
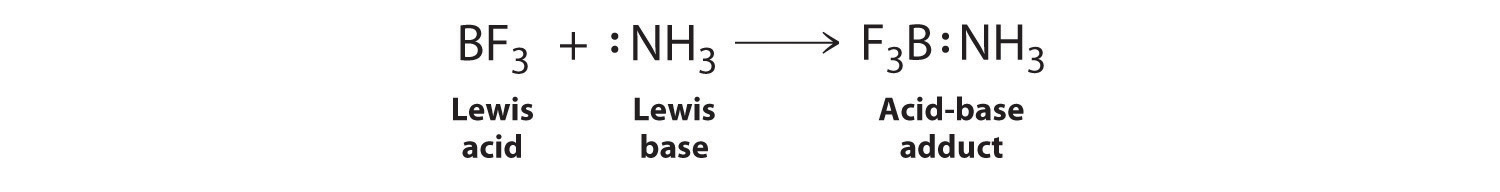
El enlace formado entre un ácido de Lewis y una base de Lewis es un enlace covalente coordinado porque ambos electrones son proporcionados por solo uno de los átomos (N, en el caso de F 3 B:NH 3). Después de formarse, sin embargo, un enlace covalente coordinado se comporta como cualquier otro enlace sencillo covalente.
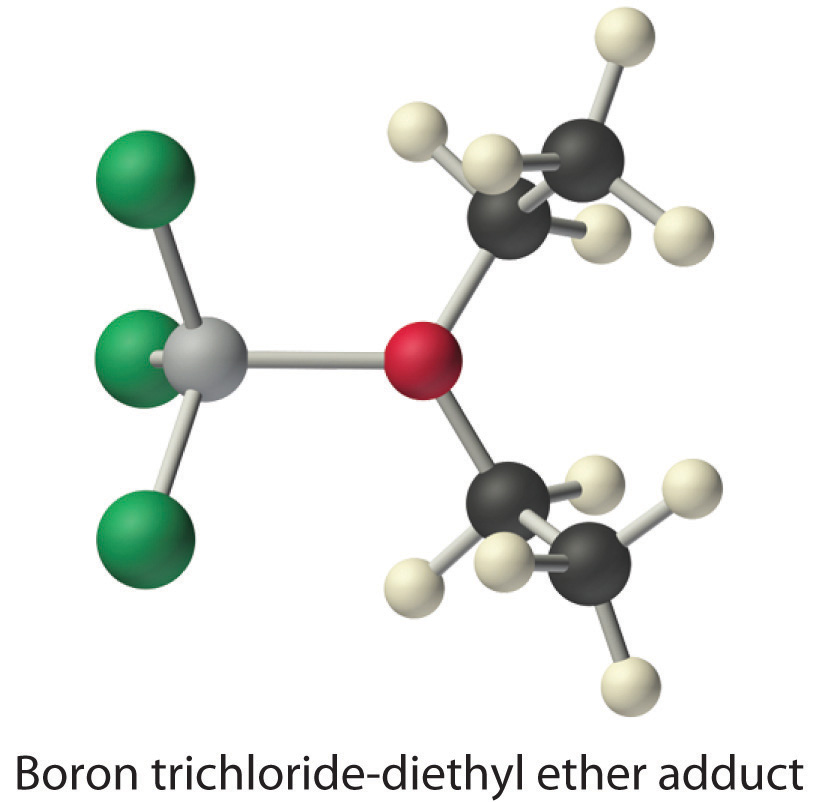
Las especies que son bases Brønsted-Lowry muy débiles pueden ser bases de Lewis relativamente fuertes. Por ejemplo, muchos de los trihaluros del grupo 13 son altamente solubles en éteres (R—O-R′) porque el átomo de oxígeno en el éter contiene dos pares solitarios de electrones, al igual que en H 2 O. De ahí que la especie predominante en soluciones de trihaluros deficientes en electrones en disolventes de éter es un aducto ácido-base de Lewis. Una reacción de este tipo se muestra en la Figura 8.7.1 para tricloruro de boro y éter dietílico:
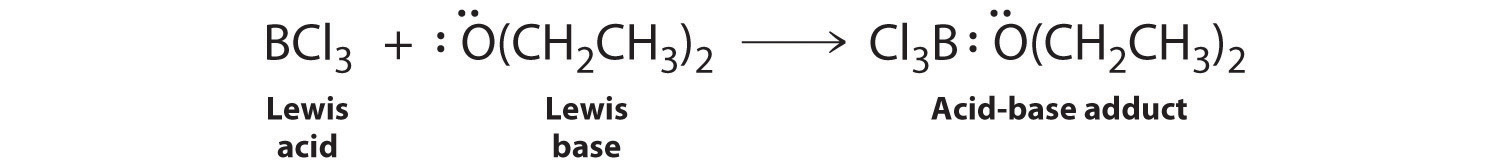
Muchas moléculas con múltiples enlaces pueden actuar como ácidos de Lewis. En estos casos, la base de Lewis dona típicamente un par de electrones para formar un enlace al átomo central de la molécula, mientras que un par de electrones desplazados del enlace múltiple se convierte en un par solitario en un átomo terminal.
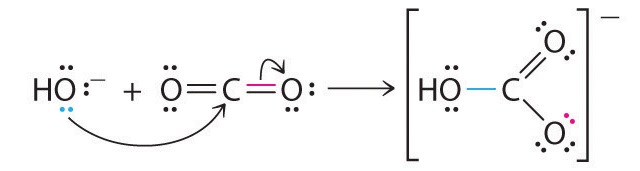
Un ejemplo típico es la reacción del ión hidróxido con dióxido de carbono para dar el ion bicarbonato, como se muestra en la Figura 8.7.2. Los átomos de oxígeno altamente electronegativos alejan la densidad electrónica del carbono, por lo que el átomo de carbono actúa como un ácido de Lewis. Las flechas indican la dirección del flujo de electrones.
Identificar el ácido y la base en cada reacción ácido-base de Lewis.
- BH 3 + (CH 3) 2 S → H 3 B:S (CH 3) 2
- CaO + CO 2 → CaCo 3
- BeCl 2 + 2 Cl − → BeCl 4 2−
Dado: reactivos y productos
Preguntado por: identidad del ácido de Lewis y la base de Lewis
Estrategia:
En cada ecuación, identificar el reactivo que es deficiente en electrones y el reactivo que es un donante de pares de electrones. El compuesto deficiente en electrones es el ácido de Lewis, mientras que el otro es la base de Lewis.
Solución:
- En BH 3, el boro tiene sólo seis electrones de valencia. Por lo tanto, es deficiente en electrones y puede aceptar un par solitario. Al igual que el oxígeno, el átomo de azufre en (CH 3) 2 S tiene dos pares solitarios. Así, (CH 3) 2 S dona un par de electrones sobre azufre al átomo de boro de BH 3. La base de Lewis es (CH 3) 2 S, y el ácido de Lewis es BH 3.
- Como en la reacción mostrada en la Ecuación 8.21, el CO 2 acepta un par de electrones del ion O2- en CaO para formar el ion carbonato. El oxígeno en CaO es un donante de pares de electrones, por lo que CaO es la base de Lewis. El carbono acepta un par de electrones, por lo que el CO 2 es el ácido de Lewis.
- El ion cloruro contiene cuatro pares solitarios. En esta reacción, cada ion cloruro dona un par solitario a BeCl 2, que solo tiene cuatro electrones alrededor de Be. Así, los iones cloruro son bases de Lewis, y BeCl 2 es el ácido de Lewis.
Identificar el ácido y la base en cada reacción ácido-base de Lewis.
- (CH 3) 2 O + BF 3 → (CH 3) 2 O:BF 3
- H 2 O + SO 3 → H 2 SO 4
Responder
- Base de Lewis: (CH 3) 2 O; Ácido de Lewis: BF 3
- Base de Lewis: H 2 O; Ácido de Lewis: SO 3
- Las moléculas deficientes en electrones (aquellas con menos de un octeto de electrones) son ácidos de Lewis.
- El comportamiento ácido-base de muchos compuestos puede explicarse por sus estructuras de electrones de Lewis.


