11.7: Diagramas de fases
- Page ID
- 78343
- Comprender las características generales de un diagrama de fases.
El estado exhibido por una muestra dada de materia depende de la identidad, temperatura y presión de la muestra. Un diagrama de fases Un resumen gráfico del estado físico de una sustancia en función de la temperatura y la presión en un sistema cerrado. es un resumen gráfico del estado físico de una sustancia en función de la temperatura y la presión en un sistema cerrado.
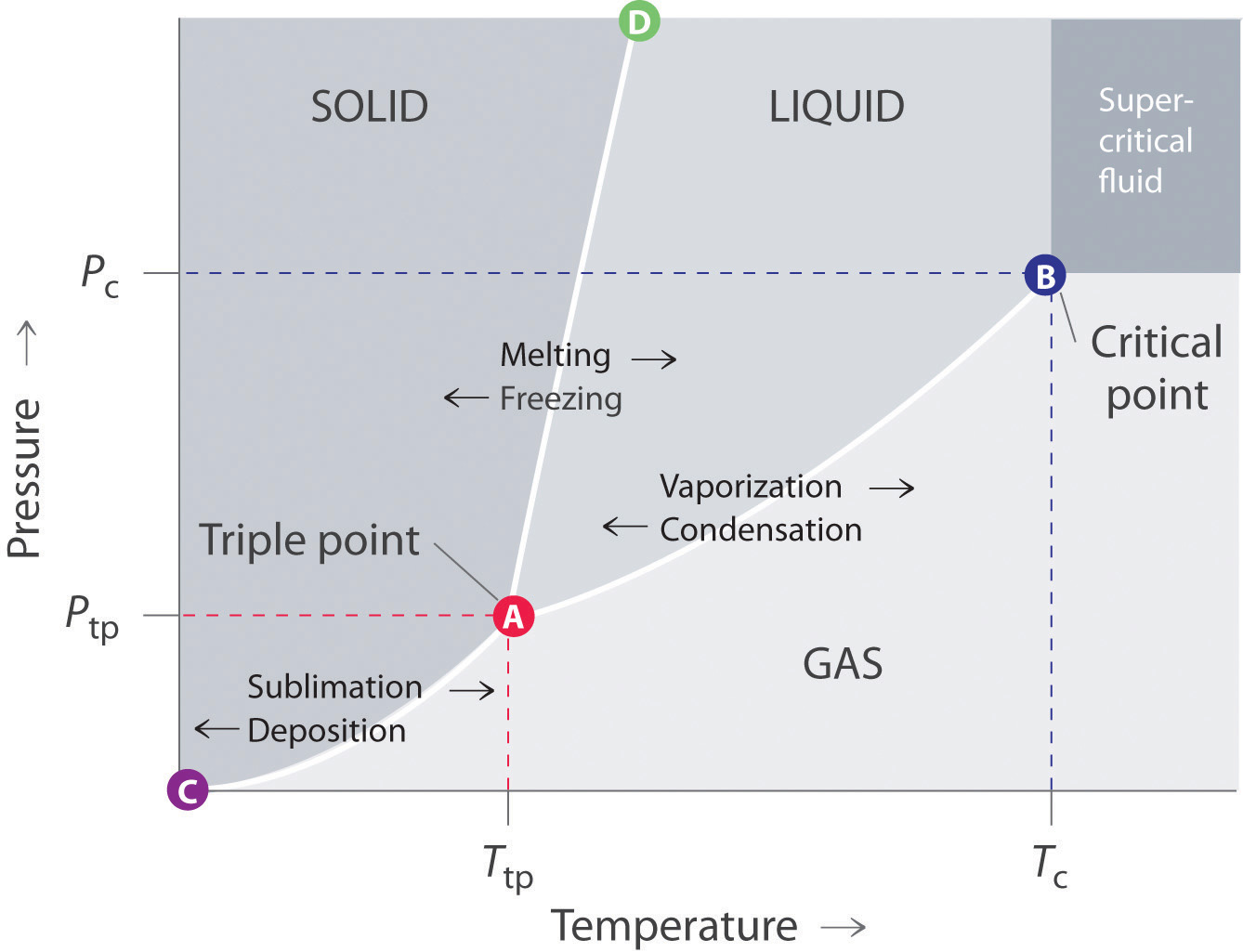
Un diagrama de fases típico consiste en regiones discretas que representan las diferentes fases exhibidas por una sustancia (Figura 11.7.1). Cada región corresponde al rango de combinaciones de temperatura y presión sobre las cuales esa fase es estable. La combinación de alta presión y baja temperatura (superior izquierda de la Figura 11.7.1) corresponde a la fase sólida, mientras que la fase gaseosa se favorece a alta temperatura y baja presión (inferior derecha). La combinación de alta temperatura y alta presión (superior derecha) corresponde a un fluido supercrítico.
Figura 11.7.1 Un diagrama de fases típico para una sustancia que exhibe tres fases (sólida, líquida y gaseosa) y una región supercrítica
Tenga en cuenta el patrón
La fase sólida se favorece a baja temperatura y alta presión; la fase gaseosa se favorece a alta temperatura y baja presión.
Características generales de un diagrama de fases
Las líneas en un diagrama de fases corresponden a las combinaciones de temperatura y presión a las que dos fases pueden coexistir en equilibrio. En la Figura 11.7.1 la línea que conecta los puntos A y D separa las fases sólida y líquida y muestra cómo el punto de fusión de un sólido varía con la presión. Las fases sólida y líquida están en equilibrio a lo largo de esta línea; cruzar la línea horizontalmente corresponde a fusión o congelación. La línea que conecta los puntos A y B es la curva de presión de vapor del líquido, que discutimos en la Sección 11.4. Termina en el punto crítico, más allá del cual la sustancia existe como un fluido supercrítico. La línea que conecta los puntos A y C es la curva de presión de vapor de la fase sólida. A lo largo de esta línea, el sólido se encuentra en equilibrio con la fase de vapor a través de sublimación y deposición. Finalmente, el punto A, donde se cruzan las líneas sólido/líquido, líquido/gas y sólido/gas, es el punto triple El punto en un diagrama de fases donde se cruzan las líneas sólido/líquido, líquido/gas y sólido/gas; representa la única combinación de temperatura y presión en la que las tres fases están en equilibrio y, por lo tanto, pueden existir simultáneamente. ; es la única combinación de temperatura y presión en la que las tres fases (sólida, líquida y gaseosa) están en equilibrio y, por lo tanto, pueden existir simultáneamente. Debido a que no pueden coexistir más de tres fases, un diagrama de fases nunca puede tener más de tres líneas que se cruzan en un solo punto.
Recuerde que un diagrama de fases, como el de la Figura 11.7.1, es para una sola sustancia pura en un sistema cerrado, no para un líquido en un vaso de precipitados abierto en contacto con el aire a una presión de 1 atm. En la práctica, sin embargo, las conclusiones alcanzadas sobre el comportamiento de una sustancia en un sistema cerrado suelen extrapolarse a un sistema abierto sin mucho error.
El diagrama de fases del agua
La Figura 11.7.2 muestra el diagrama de fases del agua e ilustra que el punto triple del agua ocurre a 0.01°C y 0.00604 atm (4.59 mmHg). Mucho más reproducible que el punto de fusión del hielo, que depende de la cantidad de aire disuelto y de la presión atmosférica, se utiliza el punto triple (273.16 K) para definir la escala de temperatura absoluta (Kelvin). El punto triple también representa la presión más baja a la que puede existir una fase líquida en equilibrio con el sólido o vapor. A presiones inferiores a 0.00604 atm, por lo tanto, el hielo no se derrite a un líquido a medida que aumenta la temperatura; el sólido se sublima directamente al vapor de agua. La sublimación de agua a baja temperatura y presión se puede utilizar para “liofilizar” alimentos y bebidas. El alimento o bebida se enfría primero a temperaturas bajo cero y se coloca en un recipiente en el que la presión se mantiene por debajo de 0.00604 atm. Entonces, a medida que aumenta la temperatura, el agua se sublima, dejando los alimentos deshidratados (como el que usan los mochileros o astronautas) o la bebida en polvo (como ocurre con el café liofilizado).
El diagrama de fases para el agua ilustrado en la parte (b) en la Figura 11.7.2 muestra el límite entre el hielo y el agua a escala expandida. La curva de fusión del hielo se inclinó hacia arriba y ligeramente hacia la izquierda en lugar de hacia arriba y hacia la derecha como en la Figura 11.7.1; es decir, el punto de fusión del hielo disminuye con el aumento de la presión; a 100 MPa (987 atm), el hielo se funde a -9°C. El agua se comporta de esta manera porque es una de las pocas conocidas sustancias para las que el sólido cristalino es menos denso que el líquido (otros incluyen antimonio y bismuto). El aumento de la presión del hielo que está en equilibrio con el agua a 0°C y 1 atm tiende a empujar algunas de las moléculas más cerca entre sí, disminuyendo así el volumen de la muestra. La disminución de volumen (y el correspondiente incremento de densidad) es menor para un sólido o un líquido que para un gas, pero es suficiente para fundir parte del hielo.
Figura 11.7.2 Dos Versiones del Diagrama de Fase del Agua (a) En esta gráfica con ejes lineales de temperatura y presión, el límite entre el hielo y el agua líquida es casi vertical. (b) Esta gráfica con escala expandida ilustra la disminución del punto de fusión con el aumento de la presión. (Las letras hacen referencia a los puntos tratados en el Ejemplo 10.)
En la parte (b) de la Figura 11.7.2, el punto A se ubica en P = 1 atm y T = −1.0°C, dentro de la región sólida (hielo) del diagrama de fases. A medida que la presión aumenta a 150 atm mientras la temperatura permanece igual, la línea desde el punto A cruza el límite hielo/agua hasta el punto B, que se encuentra en la región de agua líquida. En consecuencia, aplicar una presión de 150 atm derretirá el hielo a −1.0°C. Ya hemos indicado que la dependencia de la presión del punto de fusión del agua es de vital importancia. Si el límite sólido/líquido en el diagrama de fases del agua se inclinara hacia arriba y hacia la derecha en lugar de hacia la izquierda, el hielo sería más denso que el agua, los cubitos de hielo se hundirían, las tuberías de agua no estallarían cuando se congelaran, y el anticongelante sería innecesario en los motores de los automóviles.
El diagrama de fases del dióxido de carbono
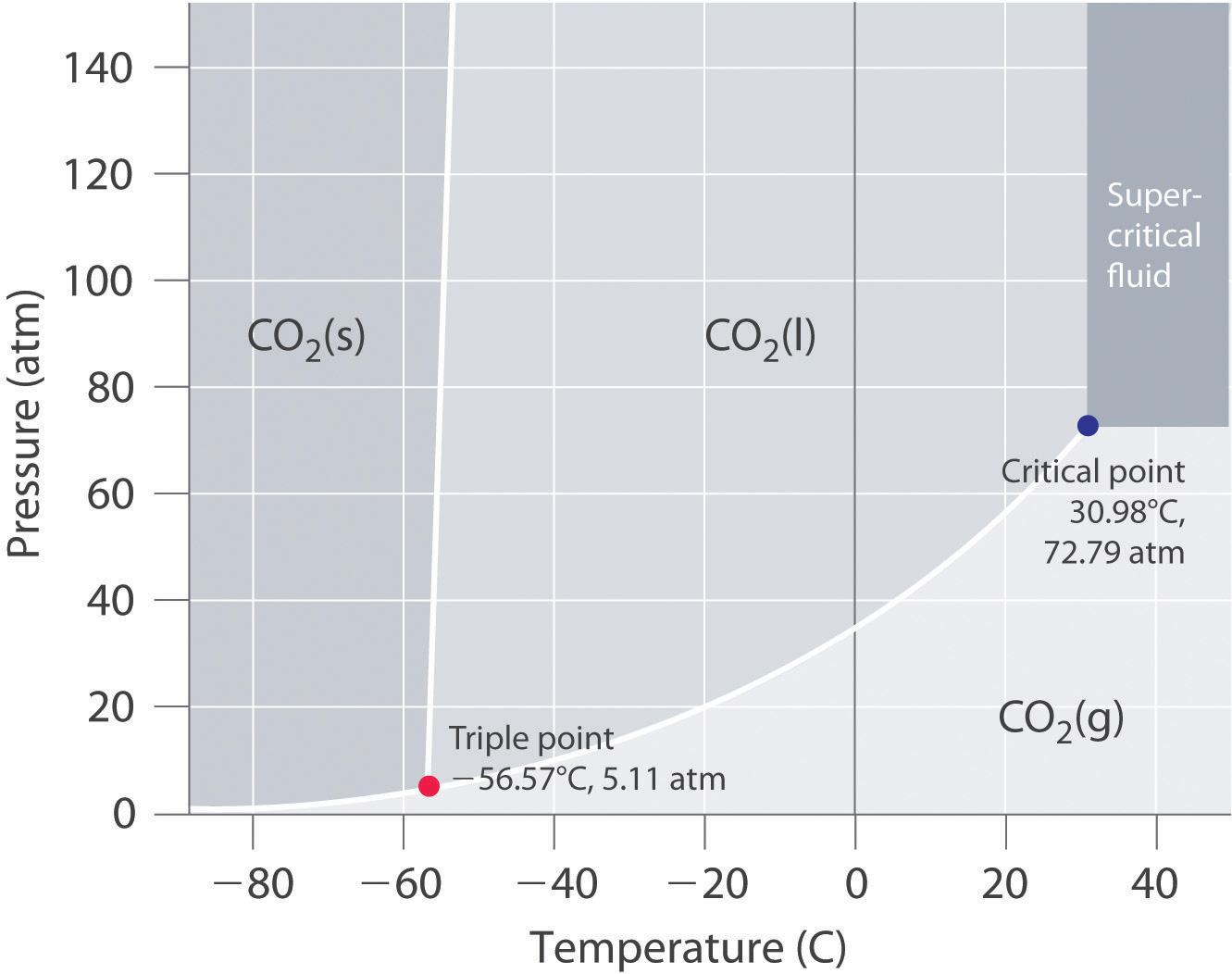
En contraste con el diagrama de fases del agua, el diagrama de fases del CO 2 (Figura 11.7.3) presenta una curva de fusión más típica, inclinada hacia arriba y hacia la derecha. El punto triple es −56.6°C y 5.11 atm, lo que significa que el CO 2 líquido no puede existir a presiones inferiores a 5.11 atm. A 1 atm, por lo tanto, el CO 2 sólido se sublima directamente al vapor mientras se mantiene una temperatura de −78.5°C, la temperatura de sublimación normal. El CO 2 sólido se conoce generalmente como hielo seco porque es un sólido frío sin fase líquida observada cuando se calienta. También observe el punto crítico a 30.98°C y 72.79 atm. Además de los usos discutidos en la Sección 11.6, el dióxido de carbono supercrítico está emergiendo como un refrigerante natural, convirtiéndolo en una solución baja en carbono (y por lo tanto más amigable con el medio ambiente) para las bombas de calor domésticas.
Figura 11.7.3 El Diagrama de Fase del Dióxido de Carbono Obsérvese el punto crítico, el punto triple, y la temperatura normal de sublimación en este diagrama.
Ejemplo 11.7.1
Refiriéndose al diagrama de fases del agua en la Figura 11.7.2,
- predecir la forma física de una muestra de agua a 400°C y 150 atm.
- describir los cambios que ocurren a medida que la muestra en la parte (a) se deja enfriar lentamente a -50°C a una presión constante de 150 atm.
Dado: diagrama de fases, temperatura y presión
Preguntado por: forma física y cambios físicos
Estrategia:
A Identificar la región del diagrama de fases correspondiente a las condiciones iniciales e identificar la fase que existe en esta región.
B Dibuje una línea correspondiente a la presión dada. Muévase a lo largo de esa línea en la dirección apropiada (en este caso enfriando) y describa los cambios de fase.
Solución:
- A Localice el punto de partida en el diagrama de fases en la parte (a) de la Figura 11.7.2. Las condiciones iniciales corresponden al punto A, que se encuentra en la región del diagrama de fases que representa el vapor de agua. Así, el agua a T = 400°C y P = 150 atm es un gas.
- B Enfriar la muestra a presión constante corresponde a moverse a la izquierda a lo largo de la línea horizontal en la parte (a) en la Figura 11.7.2. A aproximadamente 340°C (punto B), cruzamos la curva de presión de vapor, punto en el que el vapor de agua comenzará a condensarse y la muestra consistirá en una mezcla de vapor y líquido. Cuando todo el vapor se ha condensado, la temperatura desciende aún más, y entramos en la región correspondiente al agua líquida (indicada por el punto C). El enfriamiento adicional nos lleva a la curva de fusión, la línea que separa las fases líquida y sólida a un poco por debajo de 0°C (punto D), momento en el que la muestra consistirá en una mezcla de agua líquida y sólida (hielo). Cuando toda el agua se ha congelado, el enfriamiento de la muestra a -50°C nos lleva a lo largo de la línea horizontal hasta el punto E, que se encuentra dentro de la región correspondiente al agua sólida. A P = 150 atm y T = −50°C, por lo tanto, la muestra es hielo sólido.
Ejercicio
Haciendo referencia al diagrama de fases del agua en la Figura 11.7.2, predecir la forma física de una muestra de agua a -0.0050°C a medida que la presión se incrementa gradualmente de 1.0 mmHg a 218 atm.
Respuesta: La muestra es inicialmente un gas, se condensa a un sólido a medida que aumenta la presión, y luego se funde cuando la presión se incrementa más para dar un líquido.
Resumen
Los estados de la materia que exhibe una sustancia bajo diferentes temperaturas y presiones pueden resumirse gráficamente en un diagrama de fases, que es una gráfica de presión versus temperatura. Los diagramas de fases contienen regiones discretas correspondientes a las fases sólida, líquida y gaseosa. Las regiones sólida y líquida están separadas por la curva de fusión de la sustancia, y las regiones de líquido y gas están separadas por su curva de presión de vapor, que termina en el punto crítico. Dentro de una región dada, solo una sola fase es estable, pero a lo largo de las líneas que separan las regiones, dos fases están en equilibrio a una temperatura y presión dadas. Las líneas que separan las tres fases se cruzan en un solo punto, el punto triple, que es la única combinación de temperatura y presión a la que las tres fases pueden coexistir en equilibrio. El agua tiene un diagrama de fases inusual: su punto de fusión disminuye al aumentar la presión debido a que el hielo es menos denso que el agua líquida. El diagrama de fases del dióxido de carbono muestra que el dióxido de carbono líquido no puede existir a presión atmosférica. En consecuencia, el dióxido de carbono sólido se sublima directamente a un gas.
Llave para llevar
- Un diagrama de fases es un resumen gráfico del estado físico de una sustancia en función de la temperatura y la presión en un sistema cerrado. Muestra el punto triple, el punto crítico y cuatro regiones: sólida, líquida, gaseosa y una región supercrítica.
Problemas conceptuales
-
Un diagrama de fases es una representación gráfica de la fase estable de una sustancia a cualquier combinación de temperatura y presión. ¿Qué indican las líneas que separan diferentes regiones en un diagrama de fases? ¿Qué información transmite la pendiente de una línea en un diagrama de fases sobre las propiedades físicas de las fases que separa? ¿Puede un diagrama de fases tener más de un punto donde se cruzan tres líneas?
-
Si la pendiente de la línea correspondiente al límite sólido/líquido en el diagrama de fases del agua fuera positiva más que negativa, ¿cuál sería el efecto sobre la vida acuática durante periodos de temperaturas bajo cero? Explica tu respuesta.
Contestar
-
Las líneas en un diagrama de fases representan límites entre diferentes fases; a cualquier combinación de temperatura y presión que se encuentre en una línea, dos fases están en equilibrio. Es físicamente imposible que más de tres fases coexistan a cualquier combinación de temperatura y presión, pero en principio puede haber más de un punto triple en un diagrama de fases. La pendiente de la línea que separa dos fases depende de sus densidades relativas. Por ejemplo, si la línea sólido-líquido está inclinada hacia arriba y hacia la derecha, el líquido es menos denso que el sólido, mientras que si se incline hacia arriba y hacia la izquierda, el líquido es más denso que el sólido.
Problemas numéricos
-
La naftalina (C 10 H 8) es el ingrediente clave en las bolas de naftalina. Tiene puntos normales de fusión y ebullición de 81°C y 218°C, respectivamente. El punto triple de naftaleno es de 80°C a 1000 Pa. Utilice estos datos para construir un diagrama de fases para naftaleno y etiquetar todas las regiones de su diagrama.
-
El argón es un gas inerte utilizado en la soldadura. Tiene puntos normales de ebullición y congelación de 87.3 K y 83.8 K, respectivamente. El triple punto de argón es 83.8 K a 0.68 atm. Utilice estos datos para construir un diagrama de fases para argón y etiquetar todas las regiones de su diagrama.
Colaboradores
- Anonymous