12.1: Sólidos cristalinos y amorfos
- Page ID
- 78074
- Comprender la diferencia entre un sólido cristalino y un sólido amorfo
Los sólidos cristalinos tienen matrices ordenadas regulares de componentes mantenidos unidos por fuerzas intermoleculares uniformes, mientras que los componentes de los sólidos amorfos no están dispuestos en matrices regulares. El objetivo de aprendizaje de este módulo es conocer las propiedades características de los sólidos cristalinos y amorfos.
Introducción
Con pocas excepciones, las partículas que componen un material sólido, ya sea iónico, molecular, covalente o metálico, se mantienen en su lugar por fuertes fuerzas de atracción entre ellas. Cuando discutimos sólidos, por lo tanto, consideramos las posiciones de los átomos, moléculas o iones, que están esencialmente fijos en el espacio, en lugar de sus movimientos (que son más importantes en líquidos y gases). Los constituyentes de un sólido pueden disponerse de dos maneras generales: pueden formar una estructura tridimensional repetitiva regular llamada celosía cristalina, produciendo así un sólido cristalino, o pueden agregarse sin ningún orden particular, en cuyo caso forman un sólido amorfo (del griego ámorphos, que significa “sin forma”).
(izquierda) Caras cristalinas. Las caras de los cristales pueden cruzarse en ángulos rectos, como en galena (PbS) y pirita (FeS 2), o en otros ángulos, como en cuarzo. (Derecha) Superficies de escisión de un sólido amorfo. La obsidiana, un vidrio volcánico con la misma composición química que el granito (típicamente KalSi 3 O 8), tiende a tener superficies curvas e irregulares cuando se escinde.
Los sólidos cristalinos, o cristales, tienen estructuras internas distintivas que a su vez conducen a superficies planas o caras distintivas. Las caras se cruzan en ángulos que son característicos de la sustancia. Cuando se expone a rayos X, cada estructura también produce un patrón distintivo que se puede utilizar para identificar el material. Los ángulos característicos no dependen del tamaño del cristal; reflejan la disposición repetitiva regular de los átomos componentes, moléculas o iones en el espacio. Cuando se escinde un cristal iónico (Figura 12.1), por ejemplo, las interacciones repulsivas hacen que se rompa a lo largo de planos fijos para producir nuevas caras que se cruzan en los mismos ángulos que las del cristal original. En un sólido covalente como un diamante tallado, los ángulos en los que se encuentran las caras tampoco son arbitrarios sino que están determinados por la disposición de los átomos de carbono en el cristal.

Figura 12.1: Escindiendo un Cristal de un Compuesto Iónico a lo largo de un Plano de Iones. La deformación del cristal iónico provoca que un plano de átomos se deslice a lo largo de otro. Las interacciones repulsivas resultantes entre iones con cargas similares hacen que las capas se separen.
Los cristales tienden a tener puntos de fusión relativamente agudos y bien definidos porque todos los átomos componentes, moléculas o iones están a la misma distancia del mismo número y tipo de vecinos; es decir, la regularidad de la red cristalina crea ambientes locales que son los mismos. Así, las fuerzas intermoleculares que mantienen unido al sólido son uniformes, y se necesita la misma cantidad de energía térmica para romper cada interacción simultáneamente.
Los sólidos amorfos tienen dos propiedades características. Cuando se escinden o rompen, producen fragmentos con superficies irregulares, a menudo curvas; y tienen patrones poco definidos cuando se exponen a rayos X debido a que sus componentes no están dispuestos en una matriz regular. Un sólido amorfo y translúcido se llama vidrio. Casi cualquier sustancia puede solidificarse en forma amorfa si la fase líquida se enfría lo suficientemente rápido. Algunos sólidos, sin embargo, son intrínsecamente amorfos, ya que o bien sus componentes no pueden encajar lo suficientemente bien como para formar una red cristalina estable o contienen impurezas que alteran la red. Por ejemplo, aunque la composición química y las unidades estructurales básicas de un cristal de cuarzo y un vidrio de cuarzo son las mismas, ambas son SiO 2 y ambas consisten en tetraedros de SiO 4 unidos, las disposiciones de los átomos en el espacio no lo son. El cuarzo cristalino contiene una disposición altamente ordenada de átomos de silicio y oxígeno, pero en el vidrio de cuarzo los átomos están dispuestos casi al azar. Cuando el SiO 2 fundido se enfría rápidamente (4 K/min), forma vidrio de cuarzo, mientras que los grandes y perfectos cristales de cuarzo que se venden en las tiendas de minerales han tenido tiempos de enfriamiento de miles de años. En contraste, el aluminio cristaliza mucho más rápidamente. El aluminio amorfo se forma solo cuando el líquido se enfría a una velocidad extraordinaria de 4 × 10 13 K/s, lo que evita que los átomos se dispongan en una matriz regular.
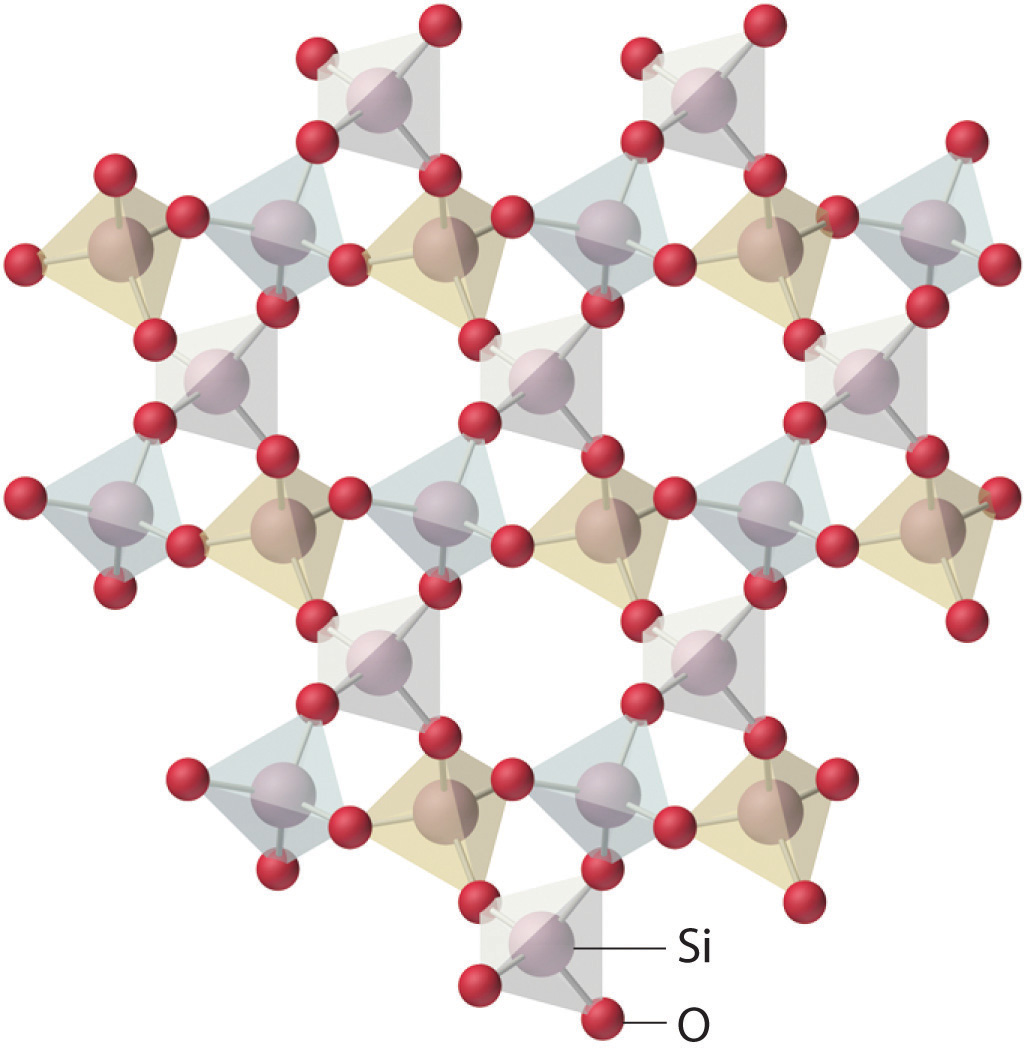
La celosía del cuarzo cristalino (SiO 2). Los átomos forman una disposición regular en una estructura que consiste en tetraedros enlazados.
En un sólido amorfo, el ambiente local, incluyendo tanto las distancias a las unidades vecinas como el número de vecinos, varía a lo largo del material. Se necesitan diferentes cantidades de energía térmica para superar estas diferentes interacciones. En consecuencia, los sólidos amorfos tienden a ablandarse lentamente en un amplio rango de temperatura en lugar de tener un punto de fusión bien definido como un sólido cristalino. Si un sólido amorfo se mantiene a una temperatura justo por debajo de su punto de fusión durante largos períodos de tiempo, las moléculas componentes, átomos o iones pueden reorganizarse gradualmente en una forma cristalina más ordenada.
| Nota |
|---|
| Los cristales tienen puntos de fusión afilados y bien definidos; los sólidos amorfos no. |
Resumen
Los sólidos se caracterizan por una disposición tridimensional extendida de átomos, iones o moléculas en la que los componentes generalmente están bloqueados en sus posiciones. Los componentes pueden disponerse en una matriz tridimensional repetitiva regular (una red cristalina), lo que da como resultado un sólido cristalino, o más o menos aleatoriamente para producir un sólido amorfo. Los sólidos cristalinos tienen bordes y caras bien definidos, difractan rayos X y tienden a tener puntos de fusión nítidos. Por el contrario, los sólidos amorfos tienen superficies irregulares o curvas, no dan patrones de difracción de rayos X bien resueltos y se funden en un amplio rango de temperaturas.
Problemas conceptuales
1. Comparar los estados sólido y líquido en términos de
a. rigidez de la estructura.
b. orden de largo alcance.
c. orden de corto alcance.
2. ¿Cómo difieren los sólidos amorfos de los sólidos cristalinos en cada característica? ¿Cuál de los dos tipos de sólidos es más similar a un líquido?
a. rigidez de la estructura
b. orden de largo alcance
c. orden de corto alcance
3. ¿Por qué la disposición de los átomos o moléculas constituyentes es más importante para determinar las propiedades de un sólido que un líquido o un gas?
4. ¿Por qué las estructuras de los sólidos se describen generalmente en términos de las posiciones de los átomos constituyentes en lugar de su movimiento?
5. ¿Qué características físicas distinguen a un sólido cristalino de un sólido amorfo? Describir al menos dos formas de determinar experimentalmente si un material es cristalino o amorfo.
6. Explicar por qué cada característica favorecería o no la formación de un sólido amorfo.
a. enfriamiento lento del material fundido puro
b. impurezas en el líquido a partir del cual se forma el sólido
c. fuerzas de atracción intermoleculares débiles
7. Un estudiante obtuvo un producto sólido en una síntesis de laboratorio. Para verificar la identidad del sólido, midió su punto de fusión y encontró que el material se fundió en un rango de 12°C. Después de que se había enfriado, volvió a medir el punto de fusión de la misma muestra y encontró que esta vez el sólido tenía un punto de fusión agudo a la temperatura que es característica del producto deseado. ¿Por qué fueron diferentes los dos puntos de fusión? ¿Cuál fue el responsable del cambio en el punto de fusión?
Respuestas conceptuales
3. La disposición de los átomos o moléculas es más importante para determinar las propiedades de un sólido debido al mayor orden persistente de sólidos de largo alcance. Los gases y líquidos no pueden describirse fácilmente por la disposición espacial de sus componentes porque el rápido movimiento molecular y el reordenamiento definen muchas de las propiedades de los líquidos y gases.
7. El sólido inicial contenía el compuesto deseado en estado amorfo, como lo indica el amplio rango de temperatura sobre el cual se produjo la fusión. El enfriamiento lento del líquido provocó que se cristalizara, como lo demuestra el agudo segundo punto de fusión observado a la temperatura esperada.




