13.1: Factores que afectan la formación de soluciones
- Page ID
- 77910
- para entender cómo los cambios de entalpía y entropía afectan la formación de la solución.
En todas las soluciones, ya sean gaseosas, líquidas o sólidas, la sustancia presente en mayor cantidad es el disolvente, y la sustancia o sustancias presentes en cantidades menores son los solutos. El soluto no tiene que estar en el mismo estado físico que el disolvente, pero el estado físico del disolvente suele determinar el estado de la solución. Siempre que el soluto y el disolvente se combinen para dar una solución homogénea, se dice que el soluto es soluble en el disolvente. En el Cuadro 13.1 se enumeran algunos ejemplos comunes de soluciones gaseosas, líquidas y sólidas e identifica los estados físicos del soluto y disolvente en cada una.
Cuadro 13.1: Tipos de soluciones
| Solución | Soluto | Solvente | Ejemplos |
|---|---|---|---|
| gas | gas | gas | aire, gas natural |
| líquido | gas | líquido | agua seltzer (\(CO_2\)gas en agua) |
| líquido | líquido | líquido | bebida alcohólica (etanol en agua), gasolina |
| líquido | sólido | líquido | té, agua salada |
| sólido | gas | sólido | \(H_2\)en Pd (usado para\(H_2\) almacenamiento) |
| sólido | sólido | líquido | mercurio en plata u oro (amalgama de uso frecuente en odontología) |
Formando una solución
La formación de una solución a partir de un soluto y un disolvente es un proceso físico, no químico. Es decir, tanto el soluto como el disolvente pueden recuperarse en formas químicamente inalteradas usando métodos de separación apropiados. Por ejemplo, el nitrato de zinc sólido se disuelve en agua para formar una solución acuosa de nitrato de zinc:
\[Zn(NO_3)_{2(s)} + H_2O(l) \rightarrow Zn^{2+}_{(aq)}+2NO^-_{3(aq)} \tag{13.1}\]
Debido a que se\(Zn(NO_3)_2\) puede recuperar fácilmente evaporando el agua, este es un proceso físico. En contraste, el zinc metálico parece disolverse en ácido clorhídrico acuoso. De hecho, las dos sustancias experimentan una reacción química para formar una solución acuosa de cloruro de zinc con desprendimiento de gas hidrógeno:
\[ Zn_{(s)} + 2H^+_{(aq)} + 2Cl^-_{(aq)} \rightarrow Zn^{2+}_{(aq)} + 2Cl^-_{(aq)} + H_{2(g)} \tag{13.2}\]
| Nota |
|---|
| La disolución de un soluto en un disolvente para formar una solución no implica una transformación química. |
Cuando la solución se evapora, no recuperamos zinc metálico, por lo que no podemos decir que el zinc metálico sea soluble en ácido clorhídrico acuoso porque se transforma químicamente cuando se disuelve. La disolución de un soluto en un disolvente para formar una solución no implica una transformación química.
Se dice que las sustancias que forman una sola fase homogénea en todas las proporciones son completamente miscibles entre sí. El etanol y el agua son miscibles, así como mezclas de gases son miscibles. Si dos sustancias son esencialmente insolubles entre sí, como el aceite y el agua, son inmiscibles. Ejemplos de soluciones gaseosas que ya hemos discutido incluyen la atmósfera terrestre.
El papel de la entalpía en la formación de soluciones
Se requiere energía para superar las interacciones intermoleculares en un soluto, la cual solo puede ser suministrada por las nuevas interacciones que ocurren en la solución, cuando cada partícula de soluto está rodeada por partículas del solvente en un proceso llamado solvatación, o hidratación cuando el solvente es agua. Por lo tanto, todas las interacciones soluto-soluto y muchas de las interacciones disolvente-disolvente deben interrumpirse para que se forme una solución. En esta sección, describimos el papel de la entalpía en este proceso.
Debido a que la entalpía es una función de estado, podemos usar un ciclo termoquímico para analizar la energía de la formación de la solución. El proceso ocurre en tres etapas discretas, indicadas por ΔH 1, ΔH 2 y ΔH 3 en la Figura 13.1. El cambio global de entalpía en la formación de la solución (\( \Delta H_{soln}\)) es la suma de los cambios de entalpía en los tres pasos:
\[ \Delta H_{soln} = \Delta H_1 + \Delta H_2 + \Delta H_3 \tag{13.3}\]
Cuando se agrega un solvente a una solución, las etapas 1 y 2 son ambas endotérmicas porque se requiere energía para superar las interacciones intermoleculares en el solvente (\(\Delta H_1\)) y el soluto (\(\Delta H_2\)). Debido a que\(ΔH\) es positivo para ambos pasos 1 y 2, las interacciones soluto-disolvente (\(\Delta H_3\)) deben ser más fuertes que las interacciones soluto-soluto y disolvente-disolvente que reemplazan para que el proceso de disolución sea exotérmico (\(\Delta H_{soln} < 0\)). Cuando el soluto es un sólido iónico, ΔH2 corresponde a la energía reticular que se debe superar para formar una solución. Cuanto mayor sea la carga de los iones en un sólido iónico, mayor será la energía reticular. En consecuencia, los sólidos que tienen energías de red muy altas, como\(MgO\) (−3791 kJ/mol), son generalmente insolubles en todos los disolventes.

Figura 13.1: Cambios en la entalpía que acompañan a la formación de una solución. La solvatación puede ser un proceso exotérmico o endotérmico dependiendo de la naturaleza del soluto y del disolvente. En ambos casos, la etapa 1, separación de las partículas de disolvente, es energéticamente cuesta arriba (ΔH 1 > 0), al igual que la etapa 2, separación de las partículas de soluto (ΔH 2 > 0). En contraste, la energía se libera en la etapa 3 (ΔH 3 < 0) debido a las interacciones entre el soluto y el disolvente. (a) Cuando ΔH 3 es mayor en magnitud que la suma de ΔH 1 y ΔH 2, el proceso global es exotérmico (ΔH soln < 0), como se muestra en el ciclo termoquímico. (b) Cuando ΔH 3 es menor en magnitud que la suma de ΔH 1 y ΔH 2, el proceso general es endotérmico (ΔHSoln > 0).
Un valor positivo para\(ΔH_{soln}\) no significa que no se forme una solución. Si un proceso dado, incluyendo la formación de una solución, ocurre espontáneamente depende de si la energía total del sistema se reduce como resultado. La entalpía es solo uno de los factores contribuyentes. Un subidón\(ΔH_{soln}\) suele ser un indicio de que la sustancia no es muy soluble. Las bolsas frías instantáneas utilizadas para tratar lesiones atléticas, por ejemplo, aprovechan el gran positivo\(ΔH_{soln}\) del nitrato de amonio durante la disolución (+25.7 kJ/mol), lo que produce temperaturas inferiores a 0°C (Figura 13.2).

Figura 13.2: Envases Fríos Comerciales para el Tratamiento de Lesiones. Estos paquetes contienen sólidos\(NH_4NO_3\) y agua en compartimentos separados. Cuando se rompe el sello entre los compartimentos, el\(NH_4NO_3\) se disuelve en el agua. Debido a que\(ΔH_{soln}\) para\(NH_4NO_3\) es mucho mayor que cero, el calor es absorbido por el paquete frío durante el proceso de disolución, produciendo temperaturas locales menores a 0°C.
Entropía y formación de soluciones
El cambio de entalpía que acompaña a un proceso es importante porque los procesos que liberan cantidades sustanciales de energía tienden a ocurrir espontáneamente. Una segunda propiedad de cualquier sistema, su entropía, también es importante para ayudarnos a determinar si un proceso dado ocurre espontáneamente. Discutiremos la entropía con más detalle, pero por ahora podemos afirmar que la entropía (S) es una propiedad termodinámica de todas las sustancias que es proporcional a su grado de trastorno. A un cristal perfecto a 0 K, cuyos átomos se disponen regularmente en una celosía perfecta y están inmóviles, se le asigna arbitrariamente una entropía de cero. En contraste, los gases tienen grandes entropías positivas debido a que sus moléculas están altamente desordenadas y en constante movimiento a altas velocidades.
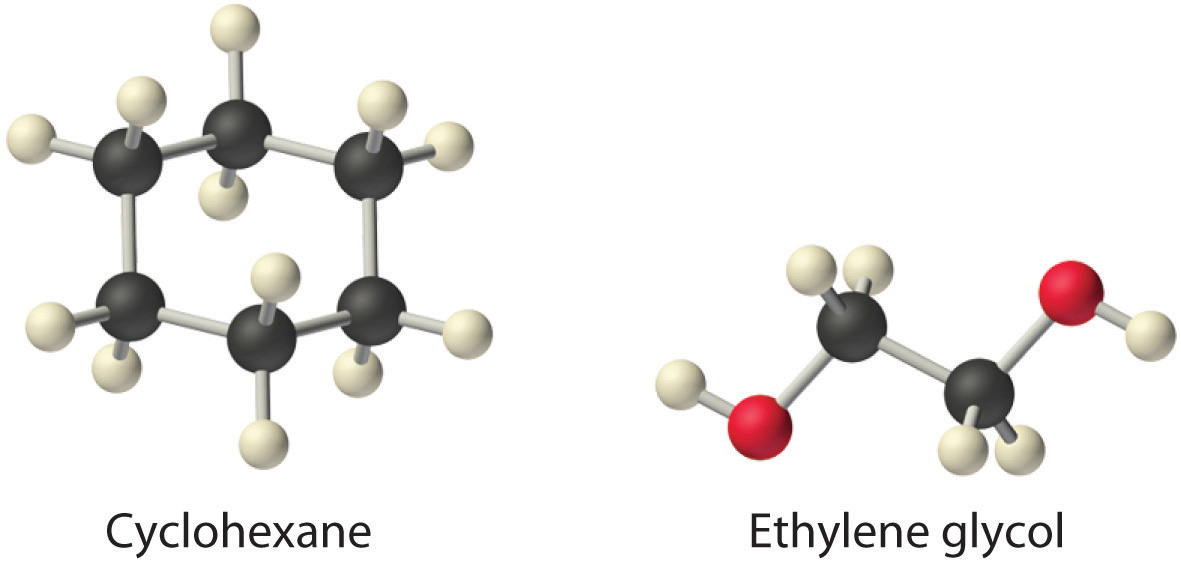
La formación de una solución dispersa moléculas, átomos o iones de un tipo a lo largo de una segunda sustancia, lo que generalmente aumenta el trastorno y da como resultado un aumento en la entropía del sistema. Así, los factores entrópicos casi siempre favorecen la formación de una solución. Por el contrario, un cambio en la entalpía puede favorecer o no la formación de la solución. Las fuerzas de dispersión de Londres que mantienen unidos el ciclohexano y el n-hexano en líquidos puros, por ejemplo, son similares en naturaleza y resistencia. En consecuencia, δHSoln debe ser aproximadamente cero, como se observa experimentalmente. La mezcla de cantidades iguales de los dos líquidos, sin embargo, produce una solución en la que las moléculas de n-hexano y ciclohexano se distribuyen uniformemente sobre aproximadamente el doble del volumen inicial. En este caso, la fuerza impulsora para la formación de la solución no es negativa\(ΔH_{soln}\) sino el aumento de la entropía debido al aumento del desorden en la mezcla. Todos los procesos espontáneos con\(ΔH \ge 0\) se caracterizan por un aumento en la entropía. En otros casos, como mezclar aceite con agua, sal con gasolina o azúcar con hexano, la entalpía de la solución es grande y positiva, y el aumento de la entropía resultante de la formación de la solución no es suficiente para superarla. Así, en estos casos no se forma una solución.
| Nota |
|---|
| Todos los procesos espontáneos con ΔH ≥ 0 se caracterizan por un incremento en la entropía. |
El Cuadro 13.2 resume cómo los factores entálpicos afectan la formación de soluciones para cuatro casos generales. La columna del extremo derecho utiliza las magnitudes relativas de las contribuciones entálpicas para predecir si se formará una solución a partir de cada una de las cuatro. Tenga en cuenta que en cada caso la entropía favorece la formación de soluciones. En dos de los casos se espera que la entalpía de la solución sea relativamente pequeña y pueda ser positiva o negativa. Así domina la contribución entrópica, y esperamos que se forme fácilmente una solución. En los otros dos casos se espera que la entalpía de la solución sea grande y positiva. El aporte entrópico, aunque favorable, suele ser demasiado pequeño para superar el término de entalpía desfavorable. De ahí que esperamos que una solución no se forme fácilmente.
Cuadro 13.2: Cambios relativos en entalpías para diferentes combinaciones soluto-disolventes*
| ΔH 1 (separación de moléculas de disolvente) | ΔH 2 (separación de partículas de soluto) | ΔH 3 (interacciones soluto—disolvente) | ΔH soln (ΔH 1 + ΔH 2 +ΔH 3) | Resultado de Mezclar Soluto y Solvente † |
|---|---|---|---|---|
| *ΔH 1, ΔH 2 y ΔH 3 se refieren a los procesos indicados en el ciclo termoquímico mostrado en la Figura 13.1. | ||||
| † En los cuatro casos, la entropía aumenta. | ||||
| grande; positivo | grande; positivo | grande; negativo | pequeño; positivo o negativo | la solución generalmente formará |
| pequeño; positivo | grande; positivo | pequeño; negativo | grande; positivo | solución no formará |
| grande; positivo | pequeño; positivo | pequeño; negativo | grande; positivo | solución no formará |
| pequeño; positivo | pequeño; positivo | pequeño; negativo | pequeño; positivo o negativo | la solución generalmente formará |
A diferencia de las soluciones líquidas, las interacciones intermoleculares en los gases son débiles (se consideran inexistentes en los gases ideales). De ahí que la mezcla de gases suele ser un proceso térmicamente neutro (ΔH soln ≈ 0), y el factor entrópico debido al incremento del trastorno es dominante (Figura 13.3). En consecuencia, todos los gases se disuelven fácilmente entre sí en todas las proporciones para formar soluciones. Volveremos a una discusión de entalpía y entropía en el Capítulo 18, donde tratamos su relación cuantitativamente.
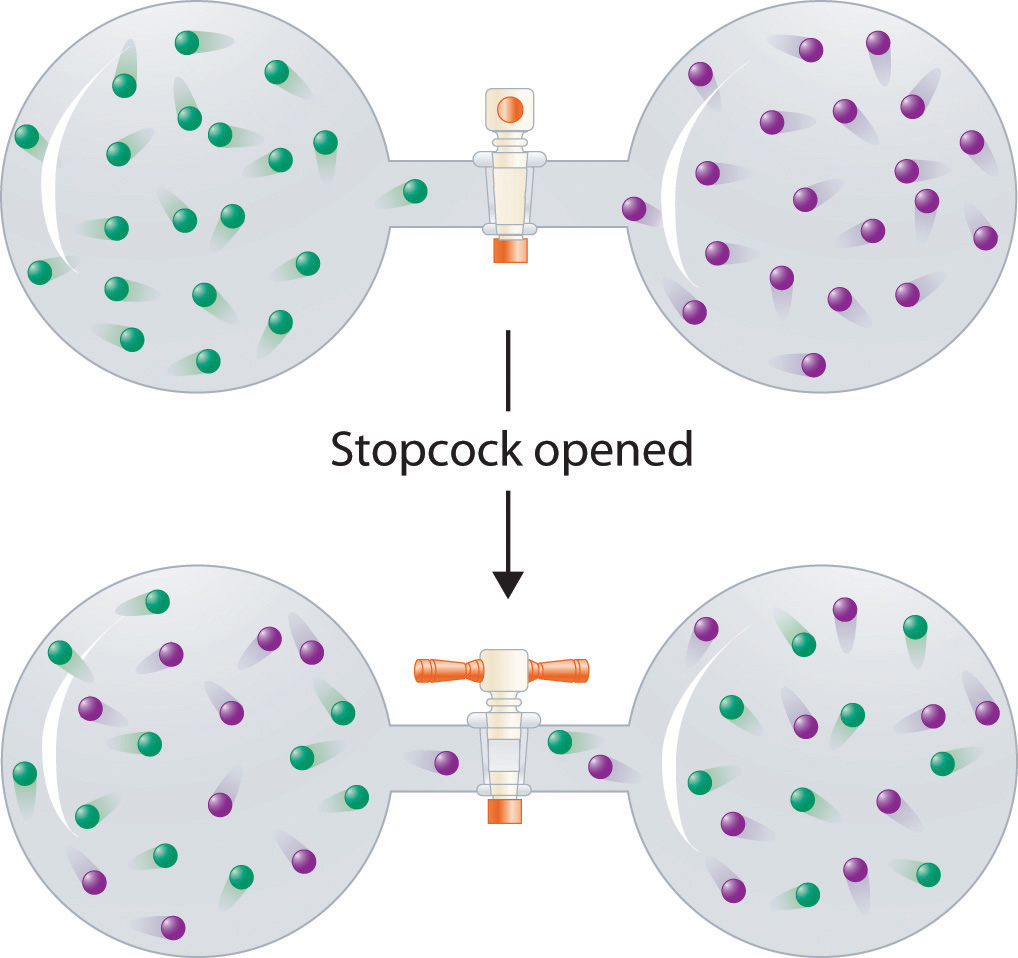
Figura 13.3 Formación de una Solución de Dos Gases. (arriba) Muestras puras de dos gases diferentes están en bulbos separados. (abajo) Cuando se abre la llave de paso de conexión, la difusión hace que los dos gases se mezclen y formen una solución. Aunque ΔhSoln es cero para el proceso, el aumento de la entropía de la solución (el aumento del trastorno) frente a la de los gases separados favorece la formación de la solución.
| Ejemplo 13.1 |
|---|
|
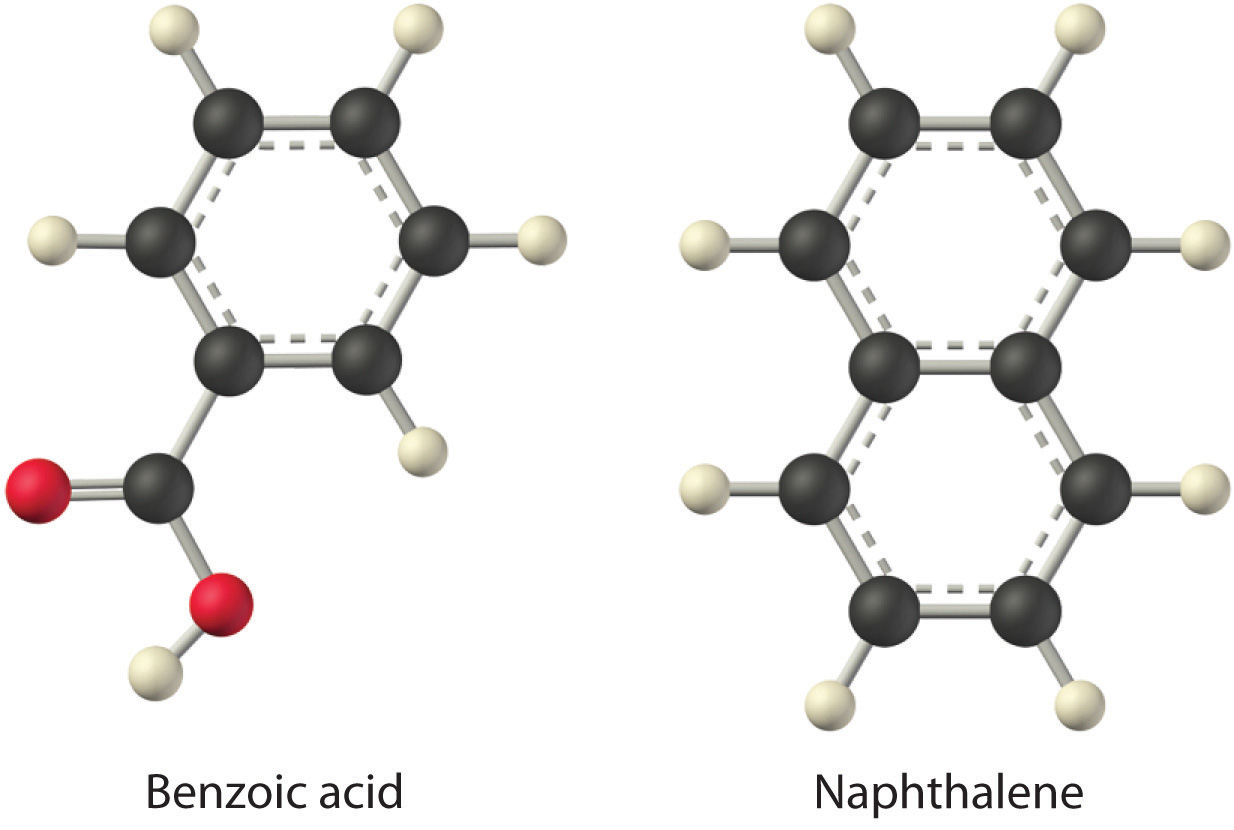
Considerando LiCl, ácido benzoico (C 6 H 5 CO 2 H), y naftaleno, ¿cuáles serán los más solubles y cuáles serán los menos solubles en agua? Dado: tres compuestos Preguntado por: solubilidades relativas en agua Estrategia: Evaluar la magnitud relativa del cambio de entalpía para cada paso del proceso mostrado en la Figura 13.1. Después utilice el Cuadro 13.2 para predecir la solubilidad de cada compuesto en agua y disponerlos en orden de solubilidad decreciente. Solución: La primera sustancia, LiCl, es un compuesto iónico, por lo que se requiere una gran cantidad de energía para separar sus aniones y cationes y superar la energía reticular (ΔH 2 es mucho mayor que cero en la Ecuación 13.3). Debido a que el agua es una sustancia polar, las interacciones entre los iones Li + y Cl − y el agua deben ser favorables y fuertes. Por lo tanto, esperamos que ΔH 3 sea mucho menor que cero, haciendo que el LiCl sea soluble en agua. En contraste, el naftaleno es un compuesto no polar, con solo las fuerzas de dispersión de Londres que mantienen unidas las moléculas en estado sólido. Por lo tanto, esperamos que ΔH 2 sea pequeño y positivo. También esperamos que la interacción entre las moléculas polares de agua y las moléculas de naftaleno no polares sea débil ΔH 3 ≈ 0. De ahí que no esperamos que el naftaleno sea muy soluble en agua, si es que lo hace. El ácido benzoico tiene un grupo ácido carboxílico polar y un anillo aromático no polar. Por lo tanto, esperamos que la energía requerida para separar las moléculas de soluto (ΔH 2) sea mayor que para el naftaleno y menor que para el LiCl. La fuerza de la interacción del ácido benzoico con el agua también debe ser intermedia entre las del LiCl y el naftaleno. Por lo tanto, se espera que el ácido benzoico sea más soluble en agua que el naftaleno pero menos soluble que el LiCl. Predecimos que el LiCl es el más soluble en agua y el naftaleno el menos soluble. Ejercicio |
| Ejercicio 13.1 |
|---|
|
Considerando el cloruro amónico, ciclohexano y etilenglicol (HOCH 2 CH 2 OH), ¿cuáles serán los más solubles y los menos solubles en benceno? Solución El más soluble es el ciclohexano; el menos soluble es el cloruro amónico. |
Resumen
Las soluciones son mezclas homogéneas de dos o más sustancias cuyos componentes se distribuyen uniformemente a escala microscópica. El componente presente en mayor cantidad es el disolvente, y los componentes presentes en cantidades menores son el soluto (s). La formación de una solución a partir de un soluto y un disolvente es un proceso físico, no químico. Las sustancias que son miscibles, como los gases, forman una sola fase en todas las proporciones cuando se mezclan. Las sustancias que forman fases separadas son inmiscibles. La solvatación es el proceso en el que las partículas de soluto están rodeadas por moléculas de disolvente. Cuando el solvente es agua, el proceso se llama hidratación. El cambio global de entalpía que acompaña a la formación de una solución, ΔH soln, es la suma del cambio de entalpía para romper las interacciones intermoleculares tanto en el disolvente como en el soluto y el cambio de entalpía para la formación de nuevas interacciones soluto-disolvente. Los procesos exotérmicos (ΔH soln < 0) favorecen la formación de soluciones. Además, se debe considerar el cambio en la entropía, el grado de desorden del sistema, a la hora de predecir si se formará una solución. Un incremento en la entropía (una disminución en el orden) favorece la disolución.
Llave para llevar
La magnitud de los cambios tanto en la entalpía como en la entropía debe considerarse al predecir si una combinación dada soluto-disolvente formará espontáneamente una solución.
Problemas conceptuales
1. Clasificar cada uno de los siguientes como una mezcla heterogénea o mezcla homogénea. Explica tu justificación en cada caso.
a. amoníaco acuoso
b. descongestionante líquido
c. vinagre
d. agua de mar
e. gasolina
f. niebla
2. Las soluciones y mezclas heterogéneas se encuentran en los extremos de la escala de solubilidad. Nombra un tipo de mezcla que sea intermedia en esta escala. ¿En qué se diferencian las propiedades de la mezcla que has elegido de las de una solución o de una mezcla heterogénea?
3. Clasificar cada proceso como disolución simple o una reacción química.
a. una bola de naftaleno que se disuelve en benceno
b. una muestra de un limpiador de drenaje común que tiene una mezcla de cristales de NaOH y trozos de Al que se disuelven en agua para dar gas H2 y una solución acuosa de iones Na +, OH − y Al 3 +
c. un ancla de barco de hierro que se disuelve lentamente en agua de mar
d. metal de sodio que se disuelve en amoníaco líquido
4. Clasificar cada proceso como disolución simple o una reacción química.
a. un cubo de azúcar que se disuelve en una taza de té caliente
b. Gas SO 3 que se disuelve en agua para producir ácido sulfúrico
c. óxido de calcio que se disuelve en agua para producir una solución básica
d. oro metálico que se disuelve en una pequeña cantidad de mercurio líquido
5. Te das cuenta de que un gas se evoluciona a medida que estás disolviendo un sólido en un líquido. ¿Podrás recuperar tu sólido original por evaporación? ¿Por qué o por qué no?
6. ¿Por qué se desprende calor cuando los pellets de hidróxido de sodio se disuelven en agua? ¿Este proceso corresponde a una disolución simple o a una reacción química? Justifica tu respuesta.
7. ¿Qué proceso (es) es la simple formación de una solución y qué proceso (es) implica (n) una reacción química?
a. mezclar una solución acuosa de NaOH con una solución acuosa de HCl
b. burbujear gas HCl a través del agua
c. adición de cristales de yodo a CCl 4
d. adición de metal de sodio a etanol para producir etóxido de sodio (C 2 H 5 O − Na +) y gas hidrógeno
8. Usando argumentos termoquímicos, explique por qué algunas sustancias que no forman una solución a temperatura ambiente formarán una solución cuando se calientan. Explique por qué se puede formar una solución incluso cuando ΔH soln es positivo.
9. Si quisieras formular un nuevo compuesto que pudiera usarse en un paquete frío instantáneo, ¿seleccionaría un compuesto con un valor positivo o negativo de ΔH soln en agua? Justifica tu respuesta.
10. ¿Por qué la entropía es el factor dominante en la formación de soluciones de dos o más gases? ¿Es posible que dos gases sean inmiscibles? ¿Por qué o por qué no?
RESPUESTAS
- Mezclas homogéneas: amoníaco acuoso, descongestionante líquido, vinagre y gasolina. Mezclas heterogéneas: agua de mar y niebla.
- Todas son reacciones químicas excepto disolver cristales de yodo en CCl 4.