13.2: Solubilidad y Estructura Molecular
- Page ID
- 77921
- Comprender la relación entre solubilidad y estructura molecular.
Cuando un soluto se disuelve, sus átomos, moléculas o iones individuales interactúan con el disolvente, se solvatan y son capaces de difundirse independientemente por toda la solución (parte (a) en la Figura 13.4). Esto no es, sin embargo, un proceso unidireccional. Si la molécula o ion choca con la superficie de una partícula del soluto no disuelto, puede adherirse a la partícula en un proceso llamado cristalización. La disolución y cristalización continúan mientras esté presente un exceso de sólido, dando como resultado un equilibrio dinámico análogo al equilibrio que mantiene la presión de vapor de un líquido. Podemos representar estos procesos opuestos de la siguiente manera:
\[ \text{solute} + \text{solvent} \ce{<=>[\ce{crystallization}][\ce{dissolution}]} \text{solution} \tag{13.4} \]
Aunque los términos precipitación y cristalización se utilizan ambos para describir la separación del soluto sólido de una solución, la cristalización se refiere a la formación de un sólido con una estructura cristalina bien definida, mientras que la precipitación se refiere a la formación de cualquier fase sólida, a menudo una con muy pequeña partículas.
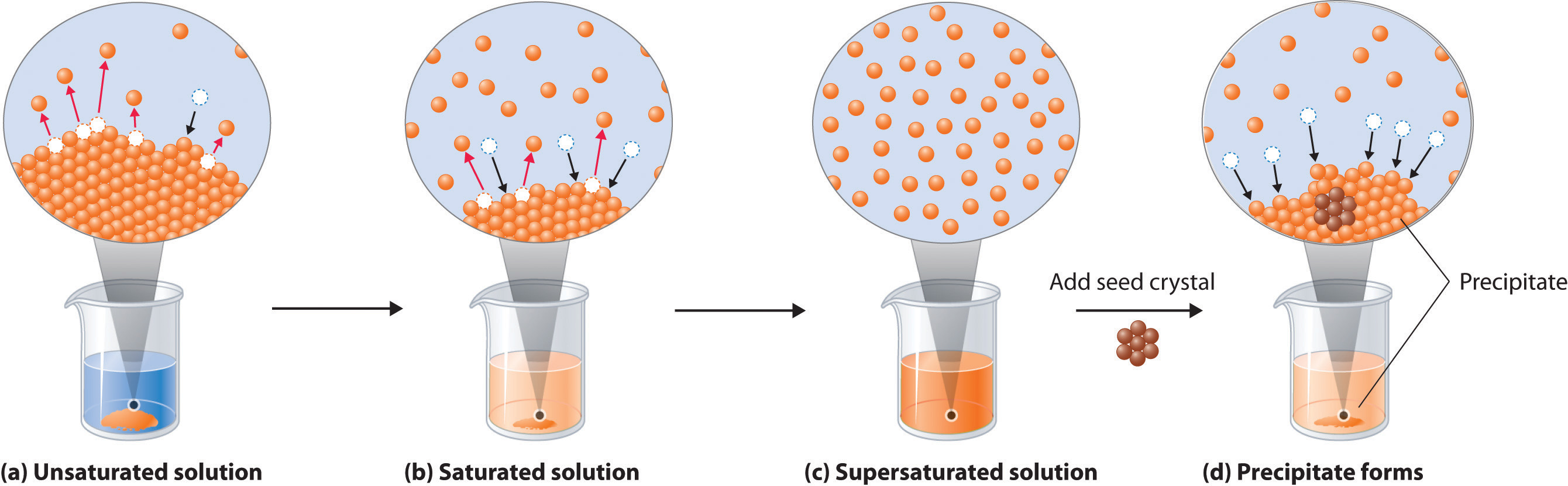
Figura 13.4 Disolución y precipitación. (a) Cuando se agrega un sólido a un solvente en el que es soluble, las partículas de soluto abandonan la superficie del sólido y se solvatan por el solvente, formando inicialmente una solución insaturada. b) Cuando se haya disuelto la cantidad máxima posible de soluto, la solución se satura. Si el exceso de soluto está presente, la velocidad a la que las partículas de soluto abandonan la superficie del sólido es igual a la velocidad a la que regresan a la superficie del sólido. (c) Por lo general, se puede formar una solución sobresaturada a partir de una solución saturada filtrando el exceso de soluto y bajando la temperatura. (d) Cuando se agrega un cristal semilla del soluto a una solución sobresaturada, las partículas de soluto abandonan la solución y forman un precipitado cristalino.
Colaboradores y Atribuciones
- Anonymous


