14.3: Tasas de reacción y leyes de velocidad
- Page ID
- 78255
- Determinar la velocidad de reacción.
- Comprender el significado de una ley tarifaria.
Los factores discutidos en la Sección 14.1 afectan la velocidad de reacción de una reacción química, lo que puede determinar si se forma un producto deseado. En esta sección, te mostraremos cómo determinar cuantitativamente la velocidad de reacción.
Tasas de Reacción
Las velocidades de reacción generalmente se expresan como la concentración de reactivo consumido o la concentración de producto formado por unidad de tiempo. Las unidades son así moles por litro por unidad de tiempo, escritos como M/s, M/min o M/h. Para medir las velocidades de reacción, los químicos inician la reacción, miden la concentración del reactivo o producto en diferentes momentos a medida que avanza la reacción, tal vez graficar la concentración en función del tiempo en una gráfica, y luego calcular el cambio en la concentración por unidad de tiempo.
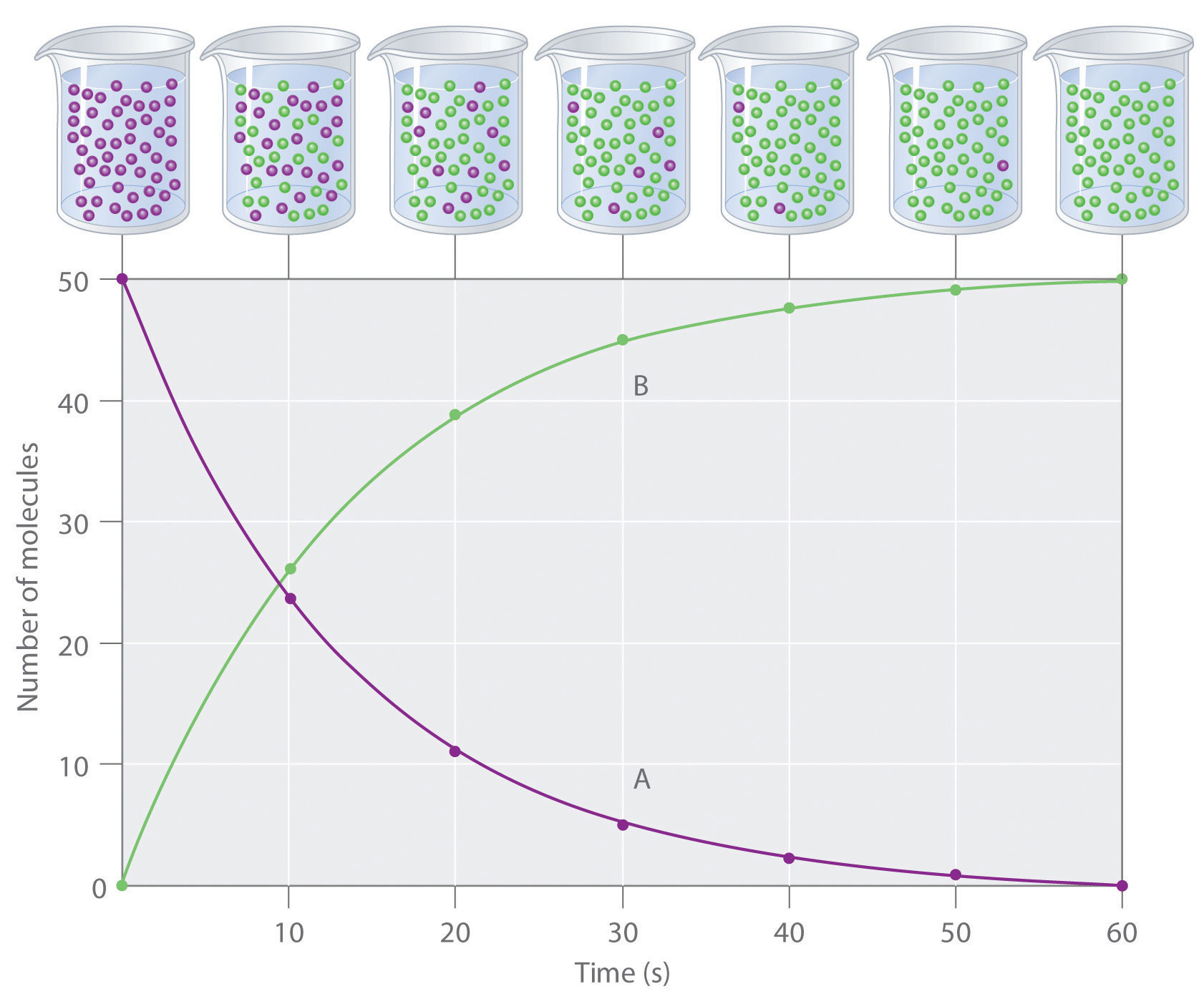
El progreso de una reacción simple (A → B) se muestra en la Figura 14.2.1 donde los vasos de precipitados son instantáneas de la composición de la solución a intervalos de 10 s. El número de moléculas de reactivo (A) y producto (B) se representan gráficamente en función del tiempo en la gráfica. Cada punto de la gráfica corresponde a un vaso de precipitados en la Figura 14.2.1. La velocidad de reacción es el cambio en la concentración del reactivo o del producto a lo largo de un periodo de tiempo. La concentración de A disminuye con el tiempo, mientras que la concentración de B aumenta con el tiempo.
Figura 14.2.1 El Progreso de una Reacción Simple (A → B) La mezcla inicialmente contiene solo moléculas A (púrpura). Al aumentar el tiempo, el número de moléculas A disminuye y se forman más moléculas B (verdes) (arriba). La gráfica muestra el cambio en el número de moléculas A y B en la reacción en función del tiempo a lo largo de un periodo de 1 min (abajo).
\( rate=\dfrac{\Delta \left [ B \right ]}{\Delta t}=-\dfrac{\Delta \left [ A \right ]}{\Delta t} \tag{14.2.1} \)
Los corchetes indican concentraciones molares, y el delta griego mayúscula (Δ) significa “cambio en”. Debido a que los químicos siguen la convención de expresar todas las velocidades de reacción como números positivos, sin embargo, se inserta un signo negativo frente a Δ [A] /Δ t para convertir esa expresión en un número positivo. La velocidad de reacción que calcularíamos para la reacción A → B usando la Ecuación 14.2.1 sería diferente para cada intervalo. (Esto no es cierto para cada reacción, como verás más adelante.) Un cambio mucho mayor ocurre en [A] y [B] durante el primer intervalo de 10 s, por ejemplo, que durante el último, lo que significa que la velocidad de reacción es más rápida al principio. Esto concuerda con los efectos de concentración descritos en la Sección 14.1 porque la concentración de A es mayor al inicio de la reacción.
Tenga en cuenta el patrón
Las velocidades de reacción generalmente disminuyen con el tiempo a medida que disminuyen las concentraciones de reactivos.
Determinación de la velocidad de reacción de hidrólisis de aspirina
Podemos usar la Ecuación 14.2.1 para determinar la velocidad de reacción de hidrólisis de la aspirina, probablemente la droga más utilizada en el mundo. (Más de 25,000,000 kg se producen anualmente en todo el mundo.) La aspirina (ácido acetilsalicílico) reacciona con el agua (como el agua en los fluidos corporales) para dar ácido salicílico y ácido acético.
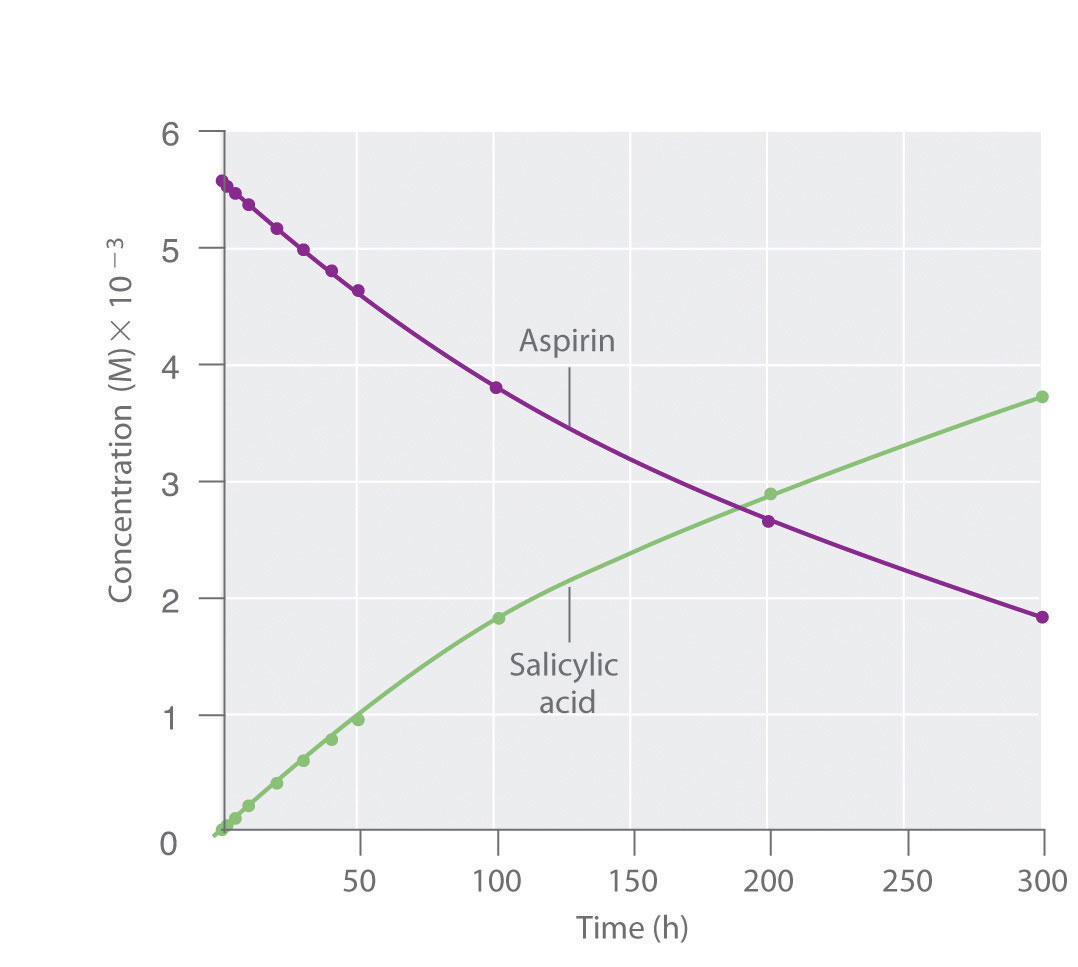
Figura 14.2.2 Debido a que el ácido salicílico es la sustancia real que alivia el dolor y reduce la fiebre y la inflamación, una gran cantidad de investigaciones se han centrado en comprender esta reacción y los factores que afectan su tasa. Los datos para la hidrólisis de una muestra de aspirina se encuentran en el Cuadro 14.2.1 y se muestran en la gráfica de la Figura 14.2.3. Estos datos se obtuvieron retirando muestras de la mezcla de reacción en los tiempos indicados y analizándolas para determinar las concentraciones del reactivo (aspirina) y uno de los productos (ácido salicílico).
Cuadro 14.2.1 Datos para la hidrólisis de aspirina en solución acuosa a pH 7.0 y 37°C*
| Tiempo (h) | [Aspirina] (M) | [Ácido Salicílico] (M) |
|---|---|---|
| 0 | 5.55 × 10 −3 | 0 |
| 2.0 | 5.51 × 10 −3 | 0.040 × 10 −3 |
| 5.0 | 5.45 × 10 −3 | 0.10 × 10 −3 |
| 10 | 5.35 × 10 −3 | 0.20 × 10 −3 |
| 20 | 5.15 × 10 −3 | 0.40 × 10 −3 |
| 30 | 4.96 × 10 −3 | 0.59 × 10 −3 |
| 40 | 4.78 × 10 −3 | 0.77 × 10 −3 |
| 50 | 4.61 × 10 −3 | 0.94 × 10 −3 |
| 100 | 3.83 × 10 −3 | 1.72 × 10 −3 |
| 200 | 2.64 × 10 −3 | 2.91 × 10 −3 |
| 300 | 1.82 × 10 −3 | 3.73 × 10 −3 |
| *La reacción a pH 7.0 es muy lenta. Es mucho más rápido bajo condiciones ácidas, como las que se encuentran en el estómago. | ||
Figura 14.2.3 La hidrólisis de aspirina Esta gráfica muestra las concentraciones de aspirina y ácido salicílico en función del tiempo, con base en los datos de hidrólisis del Cuadro 14.2.1. No se muestra la dependencia temporal de la concentración del otro producto, acetato, pero con base en la estequiometría de la reacción, es idéntica a los datos del ácido salicílico.
Podemos calcular la velocidad de reacción promedio La velocidad de reacción calculada para un intervalo de tiempo dado a partir de las concentraciones del reactivo o de uno de los productos al comienzo del intervalo de tiempo
\( rate_{\left ( t=0-2.0\;h \right )}=\dfrac{\left [ salicylic\;acid \right ]_{2}-\left [ salicylic\;acid \right ]_{0}}{2.0\;h-0.0\;h} \)
\( =\dfrac{0.040\times 10^{-3}\;M-0.000\;M}{2.0\;h-0.0\;h}=2\times 10^{-5}\;M/h \)
También podemos calcular la velocidad de reacción a partir de las concentraciones de aspirina al inicio y al final del mismo intervalo, recordando insertar un signo negativo, porque su concentración disminuye:
\( rate_{\left ( t=0-2.0\;h \right )}=\dfrac{\left [ aspirin \right ]_{2}-\left [ aspirin \right ]_{0}}{2.0\;h-0.0\;h} \)
\( rate_{\left ( t=0-2.0\;h \right )}=\dfrac{5.51\times 10^{-3}\;M-5.55\times 10^{-3}\;M}{2.0\;h-0.0\;h}=2.0\times 10^{-5}\;M/h \)\; h}\)
Si ahora calculamos la velocidad de reacción durante el último intervalo dado en la Tabla 14.2.1 (el intervalo entre 200 h y 300 h después del inicio de la reacción), encontramos que la velocidad de reacción es significativamente más lenta que durante el primer intervalo (t = 0—2.0 h):
\( rate_{\left ( t=200-300\;h \right )}=\dfrac{\left [ salicylic\;acid \right ]_{300}-\left [ salicylic\;acid \right ]_{200}}{300\;h-200\;h} \)
\( =\dfrac{3.73\times 10^{-3}\;M-2.91\times 10^{-3}\;M}{100;h}=8.2\times 10^{-6}\;M/h \)
(Debe verificar a partir de los datos de la Tabla 14.2.1 que obtiene la misma tasa utilizando las concentraciones de aspirina medidas a las 200 h y 300 h.)
Cálculo de la velocidad de reacción de fermentación de sacarosa
En el ejemplo anterior, los coeficientes estequiométricos en la ecuación química equilibrada son los mismos para todos los reactivos y productos; es decir, los reactivos y productos tienen todos el coeficiente 1. Veamos una reacción en la que los coeficientes no son todos iguales: la fermentación de sacarosa a etanol y dióxido de carbono, que encontramos en el Capítulo 8
\( \underset{sucrose}{C_{12}H_{22}O_{11}\left ( aq \right )}+H_{2}O\left ( l \right )\rightarrow 4C_{2}H_{5}OH \left ( aq \right ) + CO_{2}\left ( g \right ) \tag{14.2.2}\)
Los coeficientes nos muestran que la reacción produce cuatro moléculas de etanol y cuatro moléculas de dióxido de carbono por cada molécula de sacarosa consumida. Como antes, podemos encontrar la velocidad de reacción observando el cambio en la concentración de cualquier reactivo o producto. En este caso particular, sin embargo, un químico probablemente usaría la concentración de sacarosa o etanol porque los gases suelen medirse como volúmenes y, como aprendió en el Capítulo 10, el volumen de gas CO 2 formado dependerá del volumen total de la solución que se esté estudiando y la solubilidad del gas en la solución, no solo la concentración de sacarosa. Los coeficientes en la ecuación química equilibrada nos dicen que la velocidad de reacción a la que se forma el etanol es siempre cuatro veces más rápida que la velocidad de reacción a la que se consume la sacarosa:
\( rate=\dfrac{\Delta \left [ C_{2}H_{5}OH \right ]}{\Delta t}=-\dfrac{4 \Delta \left [ sucrose ] \right )}{\Delta t} \tag{14.2.3} \)
La concentración del reactivo —en este caso sacarosa— disminuye con el incremento del tiempo, por lo que el valor de Δ [sacarosa] es negativo. En consecuencia, se inserta un signo menos frente a Δ [sacarosa] en la Ecuación 14.2 .3 de manera que la tasa de cambio de la concentración de sacarosa se exprese como un valor positivo. Por el contrario, la concentración de etanol aumenta con el aumento del tiempo, por lo que su tasa de cambio se expresa automáticamente como un valor positivo.
A menudo, la velocidad de reacción se expresa en términos del reactivo o producto que tiene el coeficiente más pequeño en la ecuación química equilibrada. El coeficiente más pequeño en la reacción de fermentación de sacarosa (Ecuación 14.2.2) corresponde a sacarosa, por lo que la velocidad de reacción se define generalmente de la siguiente manera:
\( rate=-\dfrac{\Delta \left [ sucrose \right ]}{\Delta t}=\dfrac{1}{4}\left (\dfrac{\Delta \left [ C_{2}H_{5}OH \right ]}{\Delta t} \right ) \tag{14.2.4} \)
Ejemplo 14.2.1
Considere la descomposición térmica de N 2 O 5 gaseosos a NO 2 y O 2 a través de la siguiente ecuación:
\( 2N_{2}O_{5}\left ( g \right )\overset{\Delta }{\rightarrow} 4NO_{2}\left ( g \right )+O_{2}\left ( g \right ) \)
Escribir expresiones para la velocidad de reacción en términos de las velocidades de cambio en las concentraciones del reactivo y cada producto con el tiempo.
Dado: ecuación química equilibrada
Preguntado por: expresiones de velocidad de reacción
Estrategia:
A Elija la especie en la ecuación que tenga el coeficiente más pequeño. Después escribe una expresión para la tasa de cambio de esa especie con el tiempo.
B Para las especies restantes en la ecuación, use relaciones molares para obtener expresiones equivalentes para la velocidad de reacción.
Solución:
A Debido a que O 2 tiene el coeficiente más pequeño en la ecuación química equilibrada para la reacción, definimos la velocidad de reacción como la velocidad de cambio en la concentración de O 2 y escribimos esa expresión.
B Sabemos por la ecuación química equilibrada que 2 mol de N 2 O 5 deben descomponerse por cada 1 mol de O 2 producido y que se producen 4 moles de NO 2 por cada 1 mol de O 2 producido. Las relaciones molares de O 2 a N 2 O 5 y a NO 2 son así 1:2 y 1:4, respectivamente. Esto significa que dividimos la velocidad de cambio de [N 2 O 5] y [NO 2] por su coeficiente estequiométrico para obtener expresiones equivalentes para la velocidad de reacción. Por ejemplo, debido a que el NO 2 se produce a cuatro veces la tasa de O 2, debemos dividir la tasa de producción de NO 2 por 4. Las expresiones de velocidad de reacción son las siguientes:
\( rate=\dfrac{\Delta \left [ O_{2} \right ]}{\Delta t} = \dfrac{\Delta \left [ NO_{2} \right ]}{4\Delta t}= -\dfrac{\Delta \left [ N_{2}O_{5} \right ]}{2\Delta t} \)
Ejercicio
El paso clave en la producción industrial de ácido sulfúrico es la reacción de SO 2 con O 2 para producir SO 3.
\( 2SO_{2}\left ( g \right )+ O_{2}\left ( g \right ) \rightarrow 2SO_{3}\left ( g \right ) \)
Escribir expresiones para la velocidad de reacción en términos de la velocidad de cambio de la concentración de cada especie.
Contestar
\( rate=-\dfrac{\Delta \left [ O_{2} \right ]}{\Delta t} = -\dfrac{\Delta \left [ SO_{2} \right ]}{\Delta t}=\dfrac{\Delta \left [ SO_{3} \right ]}{2\Delta t} \)
Ejemplo 14.2.2
Usando la reacción mostrada en el Ejemplo 1, se calcula la velocidad de reacción a partir de los siguientes datos tomados a 56°C:
| 2N 2 O 5 (g) → 4NO 2 (g) + O 2 (g) | |||
|---|---|---|---|
| Tiempo (s) | [N 2 O 5] (M) | [NO 2] (M) | [O 2] (M) |
| 240 | 0.0388 | 0.0314 | 0.00792 |
| 600 | 0.0197 | 0.0699 | 0.0175 |
Dado: ecuación química equilibrada y concentraciones en momentos específicos
Preguntado por: velocidad de reacción
Estrategia:
A Usando las ecuaciones del Ejemplo 1, restar la concentración inicial de una especie de su concentración final y sustituir ese valor en la ecuación para esa especie.
B Sustituir el valor del intervalo de tiempo en la ecuación. Asegúrate de que tus unidades sean consistentes.
Solución:
A Se nos pide calcular la velocidad de reacción en el intervalo entre t 1 = 240 s y t 2 = 600 s. Del Ejemplo 1, vemos que podemos evaluar la velocidad de reacción usando cualquiera de tres expresiones:
\( rate=\dfrac{\Delta \left [ O_{2} \right ]}{\Delta t} = \dfrac{\Delta \left [ NO_{2}\right ]}{4\Delta t}= -\dfrac{\Delta \left [ N_{2}O_{5} \right ]}{2\Delta t} \)
restando la concentración inicial de la concentración final de N 2 O 5 e insertando el intervalo de tiempo correspondiente en la expresión de velocidad para N 2 O 5,
\( rate= -\dfrac{\Delta \left [ N_{2}O_{5} \right ]}{2\Delta t} =-\dfrac{\left [ N_{2}O_{5} \right ]_{600}-\left [ N_{2}O_{5} \right ]_{240}}{2\left ( 600\;s-240\;s \right )} \)
B Sustituir valores reales en la expresión,
\( rate=-\dfrac{0.197\;M-0.0388\;M}{2\left (360 \;s \right )} \)
Del mismo modo, podemos usar NO 2 para calcular la velocidad de reacción:
\( rate= -\dfrac{\Delta \left [ NO_{2} \right] }{4\Delta t} =-\dfrac{\left [ NO_{2} \right ]_{600}-\left [ NO_{2} \right ]_{240}}{4\left ( 600\;s-240\;s \right )} =\dfrac{0.0699\;M-0.0314\;M}{4\left ( 360 \right )}=2.67\times 10^{-5}\;M/s \)
Si permitimos el error experimental, esta es la misma tasa que obtuvimos usando los datos para N 2 O 5, ya que debería ser porque la velocidad de reacción debe ser la misma sin importar qué concentración se use. También podemos usar los datos para O 2:
\( rate= -\dfrac{\Delta \left [ O_{2} \right] }{\Delta t} =-\dfrac{\left [ O_{2} \right ]_{600}-\left [ O_{2} \right ]_{240}}{\left ( 600\;s-240\;s \right )} =\dfrac{0.0175\;M-0.00792\;M}{360\;s}=2.66\times 10^{-5}\;M/s \)
Nuevamente, este es el mismo valor que obtuvimos de los datos N 2 O 5 y NO 2. Así, la velocidad de reacción no depende de qué reactivo o producto se utilice para medirlo.
Ejercicio
Utilizando los datos de la siguiente tabla, calcular la velocidad de reacción de SO 2 (g) con O 2 (g) para dar SO 3 (g).
| 2SO 2 (g) + O 2 (g) → 2SO 3 (g) | |||
|---|---|---|---|
| Tiempo (s) | [SO 2] (M) | [O 2] (M) | [SO 3] (M) |
| 300 | 0.0270 | 0.0500 | 0.0072 |
| 720 | 0.0194 | 0.0462 | 0.0148 |
Respuesta: 9.0 × 10 −6 m/s
Tasas de Reacción Instantáneas
Hasta ahora, hemos determinado las velocidades de reacción promedio en intervalos de tiempo particulares. También podemos determinar la velocidad instantánea La velocidad de reacción de una reacción química en cualquier momento dado. de una reacción, que es la velocidad de reacción en cualquier momento dado. A medida que el período de tiempo utilizado para calcular una velocidad promedio de una reacción se vuelve cada vez más corto, la velocidad promedio se acerca a la velocidad instantánea. Si ha estudiado el cálculo, puede reconocer que la velocidad instantánea de una reacción en un momento dado corresponde a la pendiente de una línea tangente a la curva de concentración frente al tiempo en ese punto, es decir, la derivada de la concentración con respecto al tiempo.
Piense en la distinción entre las tasas instantáneas y medias de una reacción como similar a la distinción entre la velocidad real de un automóvil en un momento dado de un viaje y la velocidad promedio del automóvil durante todo el viaje. Aunque puede viajar durante mucho tiempo a 65 mph en una carretera interestatal durante un viaje largo, puede haber ocasiones en las que viaje solo 25 mph en zonas de construcción o 0 mph si se detiene para comer o gasolina. Por lo tanto, su velocidad promedio en el viaje puede ser de solo 50 mph, mientras que su velocidad instantánea en la interestatal en un momento dado puede ser de 65 mph. Si eres capaz de detener el auto a tiempo para evitar un accidente depende de tu velocidad instantánea, no de tu velocidad promedio. Sin embargo, existen diferencias importantes entre la velocidad de un automóvil durante un viaje y la velocidad de una reacción química. La velocidad de un automóvil puede variar de manera impredecible a lo largo de un viaje, y la parte inicial de un viaje suele ser una de las más lentas. En una reacción química, el intervalo inicial normalmente tiene la velocidad más rápida (aunque esto no siempre es el caso), y la velocidad de reacción generalmente cambia suavemente con el tiempo.
En cinética química, generalmente nos enfocamos en una velocidad instantánea particular, que es la velocidad de reacción inicial, t = 0. Las velocidades iniciales se determinan midiendo la velocidad de reacción en varios momentos y luego extrapolando una gráfica de velocidad versus tiempo a t = 0.
Leyes de tarifas
En la Sección 14.1, aprendió que las velocidades de reacción generalmente disminuyen con el tiempo porque las concentraciones de reactivos disminuyen a medida que los reactivos se convierten en productos. También aprendió que las velocidades de reacción generalmente aumentan cuando se incrementan las concentraciones de reactivos. Ahora examinamos las expresiones matemáticas llamadas leyes de velocidad Expresiones matemáticas que describen las relaciones entre las velocidades de reactivos y las concentraciones de reactivos en una reacción química. , que describen las relaciones entre las velocidades de reactivos y las concentraciones de reactivos. Las leyes de tarifas son leyes tal como se definen en el Capítulo 1; es decir, son descripciones matemáticas de datos verificables experimentalmente.
Las leyes de tarifas pueden escribirse desde cualquiera de dos perspectivas diferentes pero relacionadas. Una ley de velocidad diferencial Una ley de velocidad que expresa la velocidad de reacción en términos de cambios en la concentración de uno o más reactivos (Δ [R]) durante un intervalo de tiempo específico (Δt) expresa la velocidad de reacción en términos de cambios en la concentración de uno o más reactivos (Δ [R]) durante un intervalo de tiempo específico (Δ t). Por el contrario, una ley de velocidad integrada Una ley de velocidad que expresa la velocidad de reacción en términos de la concentración inicial [R] 0 y la concentración medida de uno o más reactivos ([R]) después de una cantidad de tiempo dada (t) describe la reacción tasa en términos de la concentración inicial ([R] 0) y la concentración medida de uno o más reactivos ([R]) después de un período de tiempo determinado (t); discutiremos las leyes de tasas integradas en la Sección 14.3. La ley de tasas integradas se puede encontrar mediante el uso del cálculo para integrar la ley de tasa diferencial, aunque el método para hacerlo está fuera del alcance de este texto. Ya sea que utilice una ley de tasa diferencial o una ley de tasa integrada, asegúrese siempre de que la ley de velocidad le dé las unidades adecuadas para la velocidad de reacción, generalmente moles por litro por segundo (M/s).
Órdenes de Reacción
Para una reacción con la ecuación general
\( aA+bB\rightarrow cC+dD \tag{14.2.5} \)
la ley de tarifas determinada experimentalmente suele tener la siguiente forma:
\( rate=k\left [ A \right ]^{m}\left [ B \right ]^{n} \tag{14.2.6} \)
La constante de proporcionalidad (k) se denomina constante de velocidad Una constante de proporcionalidad cuyo valor es característico de la reacción y las condiciones de reacción y cuyo valor numérico no cambia a medida que la reacción progresa bajo un conjunto dado de condiciones. , y su valor es característico de la reacción y las condiciones de reacción. Una reacción dada tiene un valor particular de la constante de velocidad bajo un conjunto dado de condiciones, tales como temperatura, presión y disolvente; variando la temperatura o el disolvente generalmente cambia el valor de la constante de velocidad. El valor numérico de k, sin embargo, no cambia a medida que avanza la reacción bajo un conjunto dado de condiciones.
Así, la velocidad de reacción depende de la constante de velocidad para el conjunto dado de condiciones de reacción y la concentración de A y B elevada a las potencias m y n, respectivamente. Los valores de m y n se derivan de mediciones experimentales de los cambios en las concentraciones de reactivos a lo largo del tiempo e indican el orden de reacción Números que indican el grado en que la velocidad de reacción depende de la concentración de cada reactivo. , el grado en que la velocidad de reacción depende de la concentración de cada reactivo; m y n no necesitan ser números enteros. Por ejemplo, la Ecuación 14.2.6 nos dice que la Ecuación 14.2.5 es de orden m en el reactivo A y orden n en el reactivo B. Es importante recordar que n y m no están relacionados con los coeficientes estequiométricos a y b en la ecuación química equilibrada y debe determinarse experimentalmente. El orden general de reacción es la suma de todos los exponentes en la ley de velocidad: m + n.
Tenga en cuenta el patrón
Bajo un conjunto dado de condiciones, el valor de la constante de velocidad no cambia a medida que avanza la reacción.
Aunque las leyes de velocidad diferencial se utilizan generalmente para describir lo que ocurre a nivel molecular durante una reacción, las leyes de velocidad integradas se utilizan para determinar el orden de reacción y el valor de la constante de velocidad a partir de mediciones experimentales. (Presentamos formularios generales para leyes de tarifas integradas en la Sección 14.3.) Para ilustrar cómo los químicos interpretan una ley de tasa diferencial, recurrimos a la ley de tasa derivada experimentalmente para la hidrólisis de bromuro de t-butilo en acetona acuosa al 70%. Esta reacción produce t-butanol de acuerdo con la siguiente ecuación:
\( \left ( CH_{3} \right )_{3}CBr \left ( soln \right )+H_{2}O\left ( soln \right )\rightarrow \left ( CH_{3} \right )_{3}COH \left( soln \right )+HBr\left ( soln \right ) \tag{14.7.7} \)
Combinar la expresión de tasa en la Ecuación 14.4 y la Ecuación 14.9 nos da una expresión general para la ley de tasa diferencial:
\( rate=-\dfrac{\Delta \left [A \right ]}{\Delta t}= k\left [ A \right ]^{m}\left [ B \right ]^{n} \tag{14.2.8} \)
La inserción de las identidades de los reactivos en la Ecuación 14.2.8 da la siguiente expresión para la ley de velocidad diferencial para la reacción:
\( rate=-\dfrac{ \Delta \left [\left (CH_{3} \right )_{3}CBr \right ]}{\Delta t}= k\left [ \left (CH_{3} \right )_{3}CBr \right ]^{m}\left [ H_{2}O \right ]^{n} \tag{14.2.9} \)
Los experimentos realizados para determinar la ley de velocidad para la hidrólisis del bromuro de t-butilo muestran que la velocidad de reacción es directamente proporcional a la concentración de (CH 3) 3 cBr pero es independiente de la concentración de agua. Así, m y n en la Ecuación 14.12 son 1 y 0, respectivamente, y
\( rate= k\left [ \left (CH_{3} \right )_{3}CBr \right ]^{1}\left [ H_{2}O \right ]^{0}=k\left [ \left (CH_{3} \right )_{3}CBr \right ] \tag{14.2.10} \)
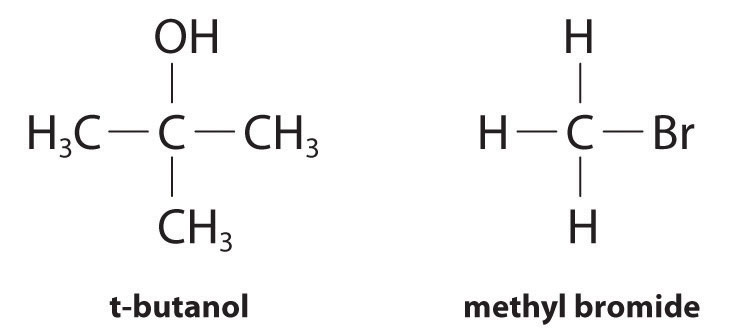
Debido a que el exponente para el reactivo es 1, la reacción es de primer orden en (CH 3) 3 cBr. Es orden cero en agua porque el exponente para [H 2 O] es 0. (Recordemos que cualquier cosa elevada a la potencia cero equivale a 1.) Por lo tanto, el orden general de reacción es 1 + 0 = 1. Lo que los órdenes de reacción nos dicen en términos prácticos es que duplicar la concentración de (CH 3) 3 CbR duplica la velocidad de reacción de la reacción de hidrólisis, al reducir a la mitad la concentración de (CH 3) 3 CbR reduce a la mitad la velocidad de reacción, y así sucesivamente. Por el contrario, aumentar o disminuir la concentración de agua no tiene ningún efecto sobre la velocidad de reacción. (Nuevamente, cuando se trabaja con leyes de tarifas, no hay una correlación simple entre la estequiometría de la reacción y la ley de velocidad. Los valores de k, m y n en la ley de tasas deben determinarse experimentalmente). Los datos experimentales muestran que k tiene el valor 5.15 × 10 −4 s −1 a 25°C; la constante de velocidad tiene unidades de segundos recíprocos (s −1) porque la velocidad de reacción se define en unidades de concentración por unidad de tiempo (m/S). Las unidades de una constante de velocidad dependen de la ley de velocidad para una reacción en particular.
En condiciones idénticas a las de la reacción de bromuro de t-butilo, la ley de velocidad diferencial derivada experimentalmente para la hidrólisis del bromuro de metilo (CH 3 Br) es la siguiente:
\( rate=-\dfrac{ \Delta \left [CH_{3} Br \right ]}{\Delta t}= k'\left [ CH_{3} Br \right ] \tag{14.2.11} \)
Esta reacción también tiene un orden general de reacción de 1, pero la constante de velocidad en la Ecuación 14.2 .11 es aproximadamente 10 6 veces menor que la del bromuro de t-butilo. Así, el bromuro de metilo se hidroliza aproximadamente 1 millón de veces más lentamente que el bromuro de t-butilo, y esta información le dice a los químicos cómo difieren las reacciones a nivel molecular.
Frecuentemente, los cambios en las condiciones de reacción también producen cambios en una ley de velocidad. De hecho, los químicos suelen cambiar las condiciones de reacción para obtener pistas sobre lo que ocurre durante una reacción. Por ejemplo, cuando el bromuro de t-butilo se hidroliza en una solución acuosa de acetona que contiene iones OH − en lugar de en acetona acuosa sola, la ley de velocidad diferencial para la reacción de hidrólisis no cambia. Para el bromuro de metilo, en contraste, la ley de velocidad diferencial se convierte en velocidad = k ″ [CH 3 Br] [OH −], con un orden de reacción general de 2. Aunque las dos reacciones proceden de manera similar en solución neutra, proceden de manera muy diferente en presencia de una base, lo que de nuevo proporciona pistas sobre cómo difieren las reacciones a nivel molecular.
Tenga en cuenta el patrón
Las leyes de velocidad diferencial se utilizan generalmente para describir lo que ocurre a nivel molecular durante una reacción, mientras que las leyes de velocidad integradas se utilizan para determinar el orden de reacción y el valor de la constante de velocidad a partir de mediciones experimentales.
Ejemplo 14.2.3
Presentamos tres reacciones y sus leyes de tasas diferenciales determinadas experimentalmente. Para cada reacción, dar las unidades de la constante de velocidad, dar el orden de reacción con respecto a cada reactivo, dar el orden de reacción general, y predecir qué sucede con la velocidad de reacción cuando se duplica la concentración de la primera especie en cada ecuación química.
- \( 2HI\left ( g \right )\overset{Pt}{\rightarrow} H_{2}\left ( g \right )+I_{2}\left ( g \right ) \)\( rate= -\dfrac{1}{2} \dfrac{\Delta \left [HI \right ]}{\Delta t}=k\left [ HI \right ]^{2} \)
- \( 2N_{2}O\left ( g \right )\overset{\Delta}{\rightarrow} 2N_{2}\left ( g \right )+O_{2}\left ( g \right ) \)
\( rate= \dfrac{1}{2} \dfrac{\Delta \left [ N_{2}O \right ]}{\Delta t}=k \) - \( cyclopropane\left ( g \right )\overset{\Delta}{\rightarrow} propane\left ( g \right ) \)
\( rate= \dfrac{1}{2} \dfrac{\Delta \left [ cyclopropance \right ]}{\Delta t}=k\left [ cyclopropane \right ] \)
Dado: ecuaciones químicas balanceadas y leyes de tasa diferencial
Preguntado por: unidades de constante de velocidad, órdenes de reacción y efecto de duplicar la concentración de reactivos
Estrategia:
A Expresar la velocidad de reacción en moles por litro por segundo [mol/ (L·s), o M/s]. Después determinar las unidades de cada especie química en la ley de tasas. Divida las unidades para la velocidad de reacción entre las unidades para todas las especies en la ley de velocidad para obtener las unidades para la constante de velocidad.
B Identificar el exponente de cada especie en la ley de velocidad para determinar el orden de reacción con respecto a esa especie. Suma todos los exponentes para obtener el orden general de reacción.
C Utilizar las relaciones matemáticas expresadas en la ley de velocidad para determinar el efecto de duplicar la concentración de una sola especie sobre la velocidad de reacción.
Solución:
- Un [HI] 2 dará unidades de (moles por litro) 2. Para que la velocidad de reacción tenga unidades de moles por litro por segundo, la constante de velocidad debe tener unidades recíprocas [1/ (M·s)]:
\( \dfrac{M}{s} = kM^{2} \Rightarrow k = \dfrac{M/s}{M^{2}} = \dfrac{1}{M\cdot s} =M^{-1}s^{-1} \)
B El exponente en la ley de velocidad es 2, por lo que la reacción es de segundo orden en HI. Debido a que el HI es el único reactivo y la única especie que aparece en la ley de velocidad, la reacción también es de segundo orden general.
C Si se duplica la concentración de HI, la velocidad de reacción aumentará de k [HI] 0 2 a k (2 [HI]) 0 2 = 4 k [HI] 0 2. Por tanto, la velocidad de reacción se cuadruplic
- A Debido a que no aparece ningún término de concentración en la ley de velocidad, la constante de velocidad debe tener M/s unidades para que la velocidad de reacción tenga M/s unidades.
B La ley de velocidad nos dice que la velocidad de reacción es constante e independiente de la concentración de N 2 O. Es decir, la reacción es de orden cero en N 2 O y orden cero en general.
C Debido a que la velocidad de reacción es independiente de la concentración de N 2 O, duplicar la concentración no tendrá ningún efecto sobre la velocidad de reacción.
- A La ley de tarifas contiene sólo un término de concentración elevado a la primera potencia. De ahí que la constante de velocidad debe tener unidades de segundos recíprocos (s −1) para tener unidades de moles por litro por segundo para la velocidad de reacción: M·s −1 = M/s.
B La única concentración en la ley de velocidad es la del ciclopropano, y su exponente es 1. Esto significa que la reacción es de primer orden en ciclopropano. El ciclopropano es la única especie que aparece en la ley de velocidad, por lo que la reacción también es de primer orden general.
C Duplicar la concentración inicial de ciclopropano aumentará la velocidad de reacción de k [ciclopropano] 0 a 2 k [ciclopropano] 0. Esto duplica la velocidad de reacción.
Ejercicio
Dadas las siguientes dos reacciones y sus leyes de velocidad diferencial determinadas experimentalmente: determinar las unidades de la constante de velocidad si el tiempo es en segundos, determinar el orden de reacción con respecto a cada reactivo, dar el orden general de reacción y predecir qué suceden a la velocidad de reacción cuando se duplica la concentración de la primera especie en cada ecuación.
- \( CH_{3}N=CH_{3}N\left ( g \right )\rightarrow C_{2}H_{6}\left ( g \right )+N_{2}\left ( g \right ) \)
\( rate=-\dfrac{\Delta \left [CH_{3}N=CH_{3}N \right]}{\Delta t}=k \left [ CH_{3}N=CH_{3}N \right ] \) - \( 2NO_{2}\left ( g \right )+F_{2}\left ( g \right ) \rightarrow 2NO_{2}F\left ( g \right ) \)
\( rate=-\dfrac{\Delta \left [F_{2} \right]}{\Delta t}=-\dfrac{1}{2}\dfrac{\Delta \left [NO_{2} \right]}{\Delta t}=k \left [ NO_{2} \right ]\left [ F_{2} \right ] \)
Contestar
- s −1; primer orden en CH 3 N=NCH 3; primer orden global; duplicar [CH 3 N=NCH 3] duplicará la velocidad de reacción.
- M −1 ·s −1; primer orden en NO 2, primer orden en F 2; segundo orden general; duplicar [NO 2] duplicará la velocidad de reacción.
Resumen
Las velocidades de reacción se reportan ya sea como la velocidad promedio a lo largo de un período de tiempo o como la velocidad instantánea en un solo tiempo.
La ley de velocidad para una reacción es una relación matemática entre la velocidad de reacción y las concentraciones de especies en solución. Las leyes de tasa pueden expresarse como una ley de tasa diferencial, describiendo el cambio en las concentraciones de reactivos o productos en función del tiempo, o como una ley de tasa integrada, describiendo las concentraciones reales de reactivos o productos en función del tiempo.
La constante de velocidad (k) de una ley de velocidad es una constante de proporcionalidad entre la velocidad de reacción y la concentración de reactivo. La potencia a la que se eleva una concentración en una ley de velocidad indica el orden de reacción, el grado en que la velocidad de reacción depende de la concentración de un reactivo particular.
Claves para llevar
- Las velocidades de reacción se pueden determinar a lo largo de intervalos de tiempo particulares o en un punto dado en el tiempo.
- Una ley de velocidad describe la relación entre las velocidades de reactivos y las concentraciones de reactivos.
Ecuaciones Clave
definición general de tasa para A → B
Ecuación 14.2.1:\( rate=\dfrac{\Delta \left [ B \right ]}{\Delta t}=-\dfrac{\Delta \left [ A \right ]}{\Delta t} \)
forma general de ley de velocidad cuando A y B son reactivos
Ecuación 14.2.6:\( rate=k\left [ A \right ]^{m}\left [ B \right ]^{n} \tag{14.2.6} \)
Problemas conceptuales
-
Explicar por qué la velocidad de reacción es generalmente más rápida a intervalos de tiempo tempranos. Para el segundo orden A + B → C, ¿cómo sería la trama de la concentración de C versus tiempo durante el transcurso de la reacción?
-
Explicar las diferencias entre una ley de tasa diferencial y una ley de tasa integrada. ¿Qué dos componentes tienen en común? ¿Qué forma se prefiere para obtener un orden de reacción y una constante de velocidad? ¿Por qué?
-
Las reacciones controladas por difusión tienen velocidades que están determinadas solo por la velocidad de reacción a la que dos moléculas reaccionantes pueden difundirse juntas. Estas reacciones son rápidas, con constantes de velocidad de segundo orden típicamente del orden de 10 10 L/ (mol·s). ¿Esperaría que las reacciones fueran más rápidas o más lentas en disolventes que tienen una viscosidad baja? ¿Por qué? Considera las reacciones H 3 O + OH − → 2H 2 O y H 3 O + N (CH 3) 3 → H 2 O + HN (CH 3) 3 + en solución acuosa. ¿Cuál tendría la constante de tasa más alta? ¿Por qué?
-
¿Qué información se puede obtener de la orden de reacción? ¿Qué correlación tiene el orden de reacción con la estequiometría de la ecuación general?
-
Durante la reacción de hidrólisis A + H 2 O → B + C, la concentración de A disminuye mucho más rápidamente en un disolvente polar que en un disolvente no polar. ¿Cómo espera que este efecto se refleje en el orden general de reacción?
RESPUESTAS
-
Las concentraciones de reactivos son más altas al inicio de una reacción. La gráfica de [C] versus t es una curva con una pendiente que se vuelve constantemente menos positiva.
-
Más rápido en un disolvente menos viscoso porque la velocidad de difusión es mayor; la reacción de H 3 O + /OH − es más rápida debido a la disminución del tamaño relativo de los reactivos y la mayor atracción electrostática entre los reactivos.
Problemas numéricos
-
La velocidad de reacción de una reacción particular en la que A y B reaccionan para hacer C es como sigue:
\( rate=-\dfrac{\Delta \left [ A \right ]}{\Delta t}=\dfrac{1}{2}\dfrac{\Delta \left [ C \right ]}{\Delta t} \)Escribir una ecuación de reacción que sea consistente con esta ley de velocidad. ¿Cuál es la expresión de velocidad con respecto al tiempo si 2A se convierten a 3C?
-
Mientras viajaba al trabajo, una persona condujo durante 12 min a 35 mph, luego se detuvo en una intersección durante 2 min, continuó el viaje a 50 mph durante 28 min, condujo lentamente a través del tráfico a 38 mph durante 18 min, y luego pasó 1 min entrando en un espacio de estacionamiento a 3 mph. ¿Cuál fue la tasa promedio del viaje? ¿Cuál fue la tasa instantánea a los 13 min? a 28 min?
-
¿Por qué la mayoría de los estudios de reacciones químicas utilizan las velocidades iniciales de reacción para generar una ley de velocidad? ¿Cómo se determina esta tasa inicial? Dados los siguientes datos, ¿cuál es el orden de reacción? Estimar.
Tiempo (s) [A] (M) 120 0.158 240 0.089 360 0.062 -
Predecir cómo se verá afectada la velocidad de reacción duplicando la concentración de la primera especie en cada ecuación.
- C 2 H 5 I → C 2 H 4 + HI: tasa = k [C 2 H 5 I]
- SO + O 2 → SO 2 + O: tasa = k [SO] [O 2]
- 2CH 3 → C 2 H 6: tasa = k [CH 3] 2
- CloO → Cl + O 2: tasa = k
-
La escisión de C 2 H 6 para producir dos radicales CH 3 · es una reacción en fase gaseosa que ocurre a 700°C; esta reacción es de primer orden, con k = 5.46 × 10 −4 s −1. ¿Cuánto tiempo tardará la reacción en llegar al 15% de finalización? al 50% de finalización?
-
Tres procesos químicos ocurren a una altitud de aproximadamente 100 km en la atmósfera terrestre.
\( N_{2}^{+}+O_{2}\overset{k_{1}}{\rightarrow} N_{2}+O_{2}^{+}\)
\( O_{2}^{+}+O\overset{k_{2}}{\rightarrow} O_{2}+O^{+}\)
\( O^{+}+N_{2}\overset{k_{3}}{\rightarrow} N+NO^{+} \)
Escribe una ley de tarifas para cada reacción elemental. Si se encontrara que la ley de velocidad para la reacción global era la velocidad = k [N 2 +] [O 2], ¿cuál de los pasos es limitante de la velocidad?
-
La oxidación del yoduro acuoso por ácido arsénico para dar I 3 − y el ácido arsénico procede a través de la siguiente reacción:
\( H_{3}AsO_{4}\left ( aq \right )+3I^{-}\left ( aq \right )+2H^{+}\left ( aq \right ) \overset{k_{f}}{\rightleftharpoons} H_{3}AsO_{3}\left ( aq \right )+I_{3}^{-}\left ( aq \right ) +H_{2}O\left ( l \right ) \)Escriba una expresión para la tasa inicial de disminución de [I 3 −], Δ [I 3 −] /Δ t. Cuando la velocidad de reacción de la reacción directa es igual a la de la reacción inversa: k f/k r = [H 3 AsO 3] [I 3 −]/[H 3 AsO 4] [I −] 3 [H + ] 2. Con base en esta información, ¿qué se puede decir sobre la naturaleza de los pasos determinantes de la tasa para las reacciones hacia atrás y hacia adelante?
Contestar
-
298 s; 1270 s
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern