14.4: Métodos para determinar el orden de reacción
- Page ID
- 78265
- Saber determinar el orden de reacción a partir de datos experimentales.
En los ejemplos de este texto, los exponentes en la ley de tasas son casi siempre los enteros positivos: 1 y 2 o incluso 0. Así, las reacciones son de orden cero, primero o segundo en cada reactivo. Los patrones comunes utilizados para identificar el orden de reacción se describen en esta sección, donde nos enfocamos en tipos característicos de leyes de velocidad diferencial e integrada y cómo determinar el orden de reacción a partir de datos experimentales.
Reacciones de orden cero
Una reacción de orden cero Una reacción cuya velocidad es independiente de la concentración. es aquella cuya tasa es independiente de la concentración; su ley de tasa diferencial es tasa = k. Nos referimos a estas reacciones como orden cero porque también podríamos escribir su tasa en una forma tal que el exponente del reactivo en la ley de tasa sea 0:
\( rate=-\dfrac{\Delta \left [ A \right ]}{\Delta t}=-k\left [ reactant \right ]^{0}=k(1)=k \tag{14.3.1} \)
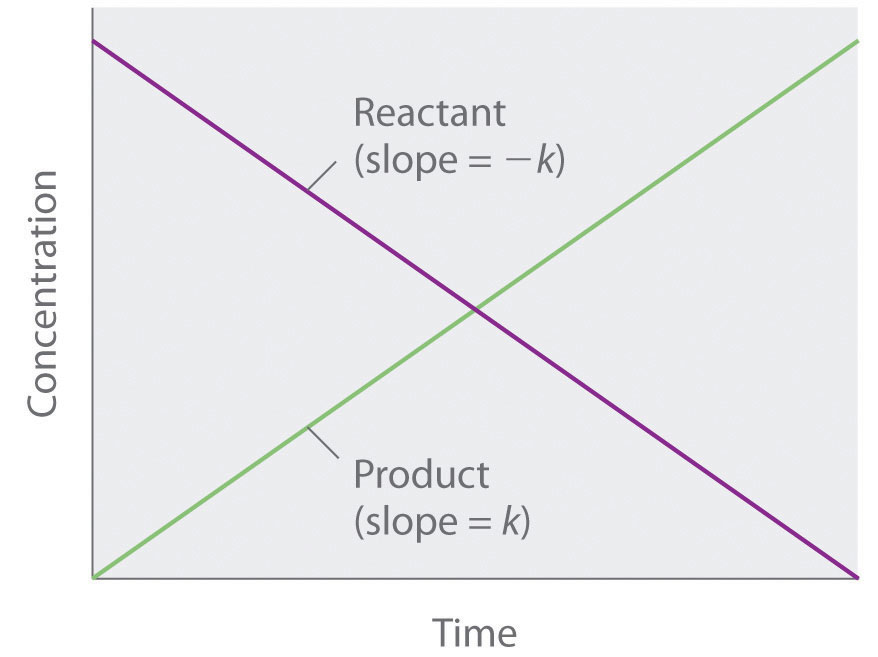
Debido a que la velocidad es independiente de la concentración de reactivos, un gráfico de la concentración de cualquier reactivo en función del tiempo es una línea recta con una pendiente de − k. El valor de k es negativo porque la concentración del reactivo disminuye con el tiempo. Por el contrario, una gráfica de la concentración de cualquier producto en función del tiempo es una línea recta con una pendiente de k, un valor positivo.
La gráfica de una reacción de orden cero. El cambio en la concentración de reactivo y producto con el tiempo produce una línea recta.
La ley de velocidad integrada para una reacción de orden cero también produce una línea recta y tiene la forma general
\( \left [ A \right ]=\left [ A_{0} \right ]-kt \tag{14.3.2} \)
donde [A] 0 es la concentración inicial del reactivo A. (Ecuación 14.3 .2 tiene la forma de la ecuación algebraica para una línea recta, y = mx + b, con y = [A], mx = − kt y b = [A] 0.) En una reacción de orden cero, la constante de velocidad debe tener las mismas unidades que la velocidad de reacción, típicamente moles por litro por segundo.
Aunque puede parecer contradictorio que la velocidad de reacción sea independiente de la (s) concentración (es) de reactante, tales reacciones son bastante comunes. Ocurren con mayor frecuencia cuando la velocidad de reacción está determinada por el área de superficie disponible. Un ejemplo es la descomposición de N 2 O sobre una superficie de platino (Pt) para producir N 2 y O 2, que se produce a temperaturas que van de 200°C a 400°C:
\( 2N_{2}O \left ( g \right )\overset{Pt}{\rightarrow} 2N_{2} \left ( g \right ) + O_{2} \left ( g \right ) \tag{14.3.3} \)
Sin una superficie de platino, la reacción requiere temperaturas mayores a 700°C, pero entre 200°C y 400°C, el único factor que determina la rapidez con la que se descompone el N 2 O es la cantidad de superficie de Pt disponible (no la cantidad de Pt). Siempre y cuando haya suficiente N 2 O para reaccionar con toda la superficie de Pt, duplicar o cuadruplicar la concentración de N 2 O no tendrá ningún efecto sobre la velocidad de reacción. A concentraciones muy bajas de N 2 O, donde no hay suficientes moléculas presentes para ocupar toda la superficie disponible de Pt, la velocidad de reacción depende de la concentración de N 2 O. La velocidad de reacción es la siguiente:
\( rate =-\dfrac{1}{2}\left (\dfrac{\Delta \left [N_{2}O \right ]}{\Delta t} \right )=\dfrac{1}{2}\left ( \dfrac{\Delta \left [N_{2} \right ]}{\Delta t} \right )=\dfrac{\Delta \left [O_{2} \right ]}{\Delta t} k\left [N_{2}O \right ]^{0}=k \tag{14.3.4} \)
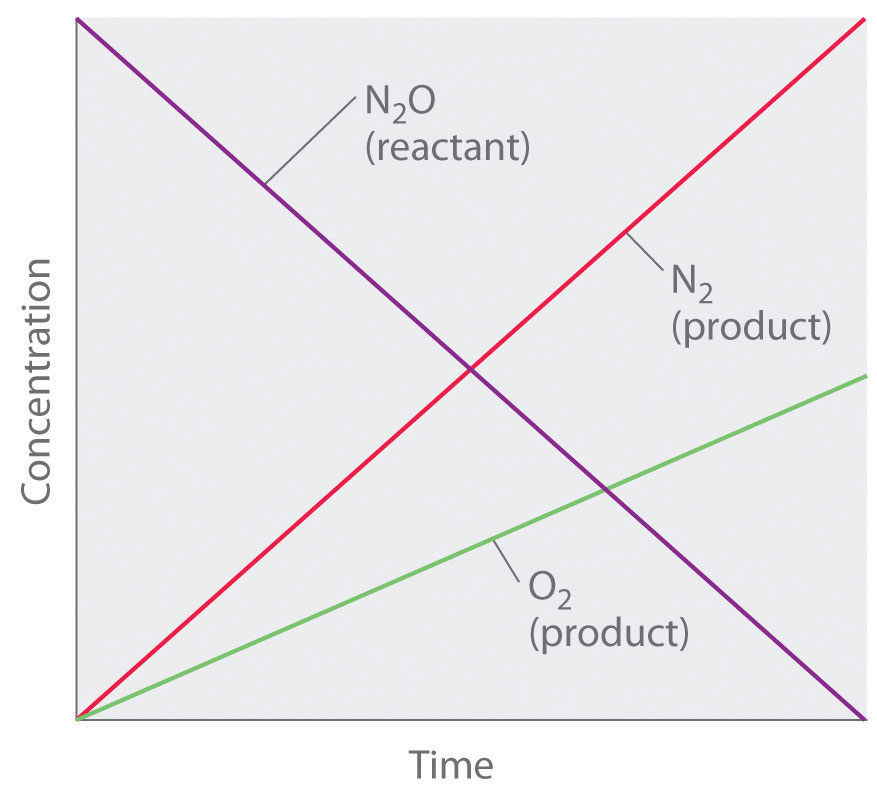
Así, la velocidad a la que se consume N 2 O y las velocidades a las que se producen N 2 y O 2 son independientes de la concentración. Como se muestra en la Figura 14.3.2, el cambio en las concentraciones de todas las especies con el tiempo es lineal. Lo más importante es que el exponente (0) correspondiente a la concentración de N 2 O en la ley de tasa derivada experimentalmente no es lo mismo que el coeficiente estequiométrico del reactivo en la ecuación química equilibrada (2). Para esta reacción, como para todas las demás, la ley tarifaria debe determinarse experimentalmente.
Figura 14.3.2 Una reacción de orden cero Esta gráfica muestra las concentraciones de reactivos y productos frente al tiempo para la descomposición catalizada de orden cero de N 2 O a N 2 y O 2 en una superficie de Pt. El cambio en las concentraciones de todas las especies con el tiempo es lineal.
Tenga en cuenta el patrón
Si una gráfica de la concentración del reactivo frente al tiempo es lineal, entonces la reacción es de orden cero en ese reactivo.
Una reacción de orden cero que tiene lugar en el hígado humano es la oxidación del etanol (de bebidas alcohólicas) al acetaldehído, catalizada por la enzima A catalizador que se produce de forma natural en los organismos vivos y cataliza reacciones biológicas. alcohol deshidrogenasa. A altas concentraciones de etanol, esta reacción también es una reacción de orden cero. La ecuación general de reacción es
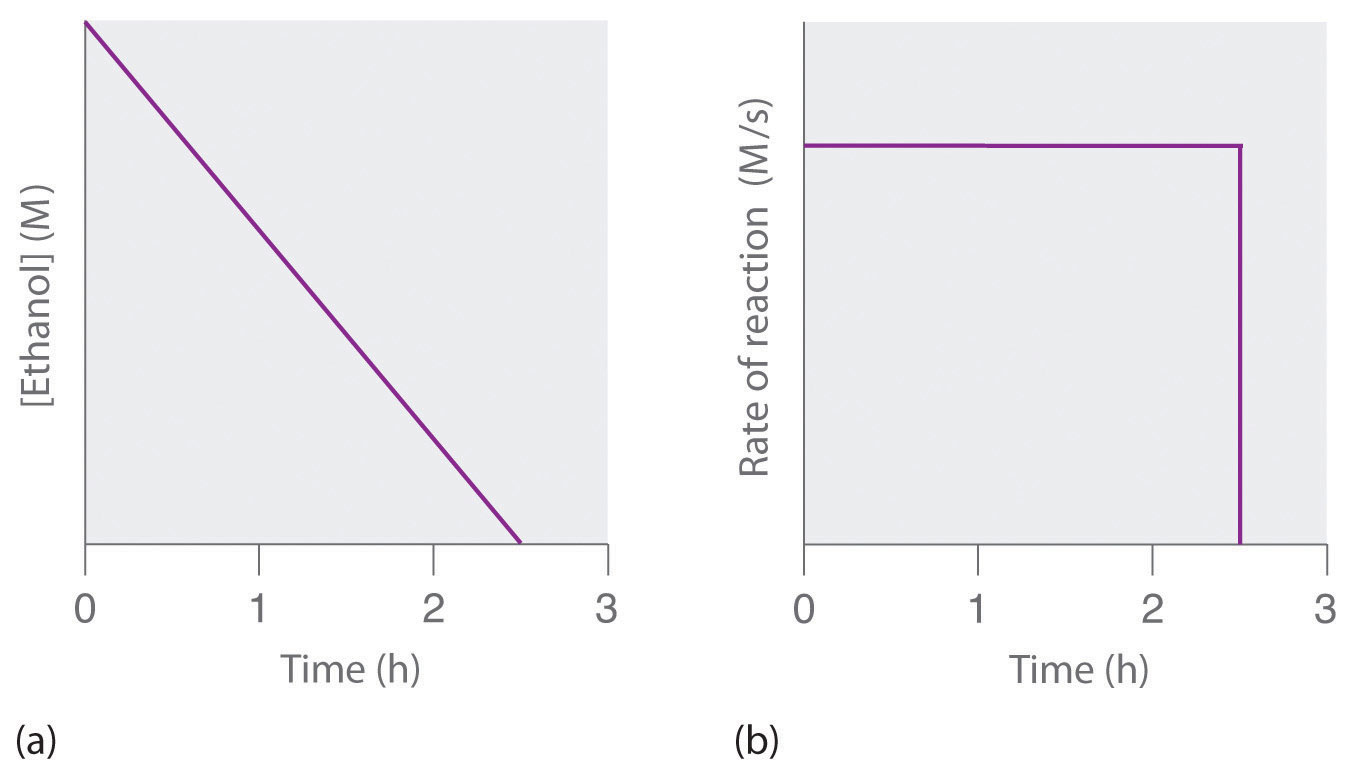
donde NAD + (nicotinamida adenina dinucleótido) y NADH (nicotinamida adenina dinucleótido reducido) son las formas oxidadas y reducidas, respectivamente, de una especie utilizada por todos los organismos para transportar electrones. Cuando se consume una bebida alcohólica, el etanol se absorbe rápidamente en la sangre. Su concentración luego disminuye a una velocidad constante hasta llegar a cero (parte (a) en la Figura 14.3.3). Una persona promedio de 70 kg suele tardar aproximadamente 2.5 h en oxidar los 15 mL de etanol contenidos en una sola lata de cerveza de 12 oz, una copa de vino de 5 oz o un trago de licores destilados (como whisky o brandy). La tasa real, sin embargo, varía mucho de persona a persona, dependiendo del tamaño corporal y la cantidad de alcohol deshidrogenasa en el hígado. La velocidad de reacción no aumenta si se consume una mayor cantidad de alcohol durante el mismo periodo de tiempo debido a que la velocidad de reacción está determinada únicamente por la cantidad de enzima presente en el hígado. Contrariamente a la creencia popular, la cafeína en el café es ineficaz para catalizar la oxidación del etanol. Cuando el etanol se ha oxidado completamente y su concentración desciende a esencialmente cero, la tasa de oxidación también disminuye rápidamente (parte (b) en la Figura 14.3.3).
Figura 14.3.3 La Oxidación Catalizada de Etanol (a) La concentración de etanol en sangre humana disminuye linealmente con el tiempo, lo que es típico de una reacción de orden cero. (b) La velocidad a la que se oxida el etanol es constante hasta que la concentración de etanol alcanza esencialmente cero, momento en el que la velocidad de reacción desciende a cero.
Estos ejemplos ilustran dos puntos importantes:
- En una reacción de orden cero, la velocidad de reacción no depende de la concentración del reactivo.
- Un cambio lineal en la concentración con el tiempo es una clara indicación de una reacción de orden cero.
Reacciones de primer orden
En una reacción de primer orden Una reacción cuya velocidad es directamente proporcional a la concentración de un reactivo. , la velocidad de reacción es directamente proporcional a la concentración de uno de los reactivos. Las reacciones de primer orden suelen tener la forma general A → productos. La velocidad diferencial para una reacción de primer orden es la siguiente:
\( rate=-\dfrac{\Delta \left [ A \right ]}{\Delta t}=k\left [ A \right ]^{1}=k\left [ A \right ] \tag{14.3.5} \)
Si se duplica la concentración de A, la velocidad de reacción se duplica; si la concentración de A se incrementa en un factor de 10, la velocidad de reacción aumenta en un factor de 10, y así sucesivamente. Debido a que las unidades de la velocidad de reacción son siempre moles por litro por segundo, las unidades de una constante de velocidad de primer orden son segundos recíprocos (s −1).
La ley de tasa integrada para una reacción de primer orden se puede escribir de dos maneras diferentes: una usando exponentes y otra usando logaritmos. La forma exponencial es la siguiente:
\( rate= \left [ A \right ]= \left [ A_{0} \right ] e^{-kt} \tag{14.3.6} \)
donde [A] 0 es la concentración inicial del reactivo A a t = 0; k es la constante de velocidad; y e es la base de los logaritmos naturales, que tiene el valor 2.718 a tres decimales. (Habilidades Esenciales 6 en la Sección 11.9, discute logaritmos naturales.) Recordemos que una ley de tasa integrada da la relación entre la concentración de reactivos y el tiempo. La ecuación 14.20 predice que la concentración de A disminuirá en una curva exponencial suave con el tiempo. Al tomar el logaritmo natural de cada lado de la Ecuación 14.20 y reordenarlo, obtenemos una expresión logarítmica alternativa de la relación entre la concentración de A y t:
\( rate= ln \left [ A \right ]= ln \left [ A_{0} \right ] -kt \tag{14.3.7} \)
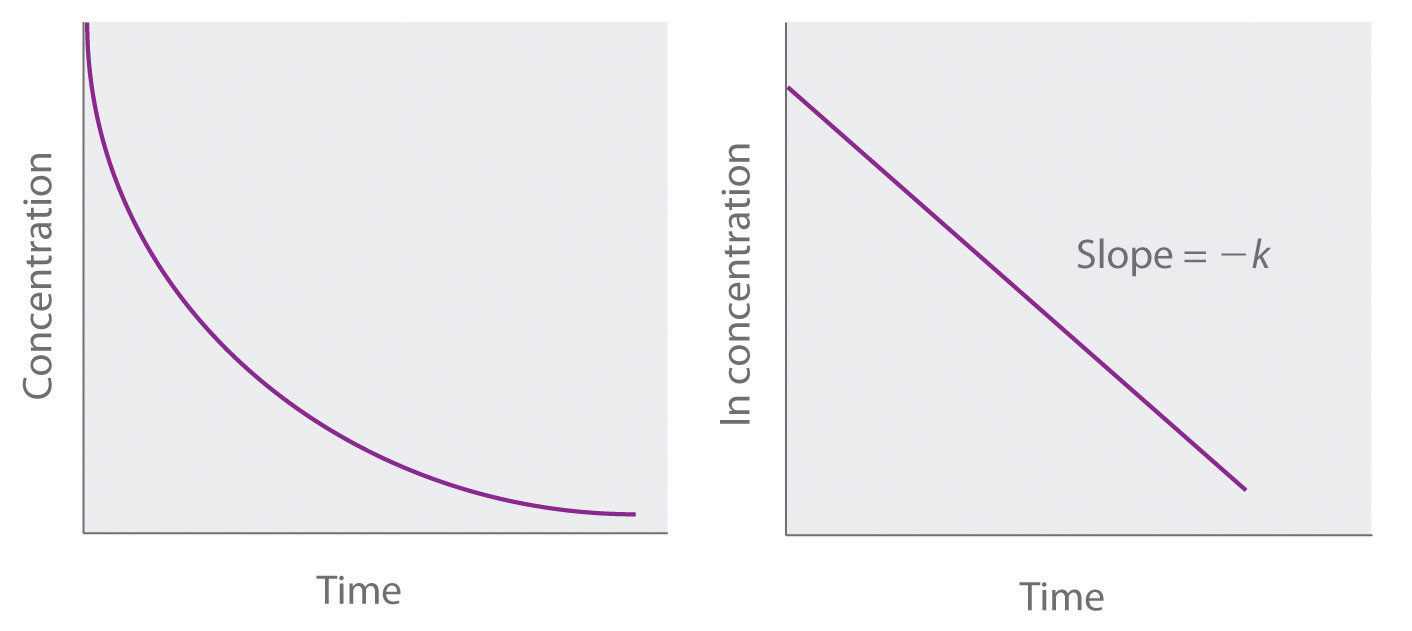
Debido a que la Ecuación 14.3.7 tiene la forma de la ecuación algebraica para una línea recta, y = mx + b, con y = ln [A] y b = ln [A] 0, una gráfica de ln [A] versus t para una reacción de primer orden debería dar una recta línea con una pendiente de − k y una intercepción de ln [A] 0. Ya sea la ley de tasa diferencial (Ecuación 14.3.5) o la ley de velocidad integrada (Ecuación 14.3 .7) se pueden utilizar para determinar si una reacción en particular es de primer orden.
Figura 14.3.4 Gráficas de una reacción de primer orden. Las formas esperadas de las curvas para las gráficas de concentración de reactivo versus tiempo (arriba) y el logaritmo natural de concentración de reactivo versus tiempo (fondo) para una reacción de primer orden.
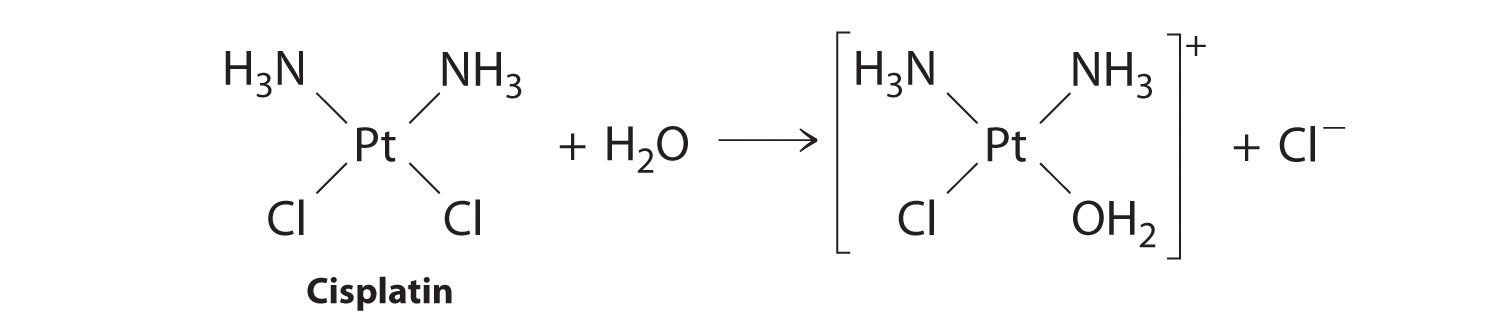
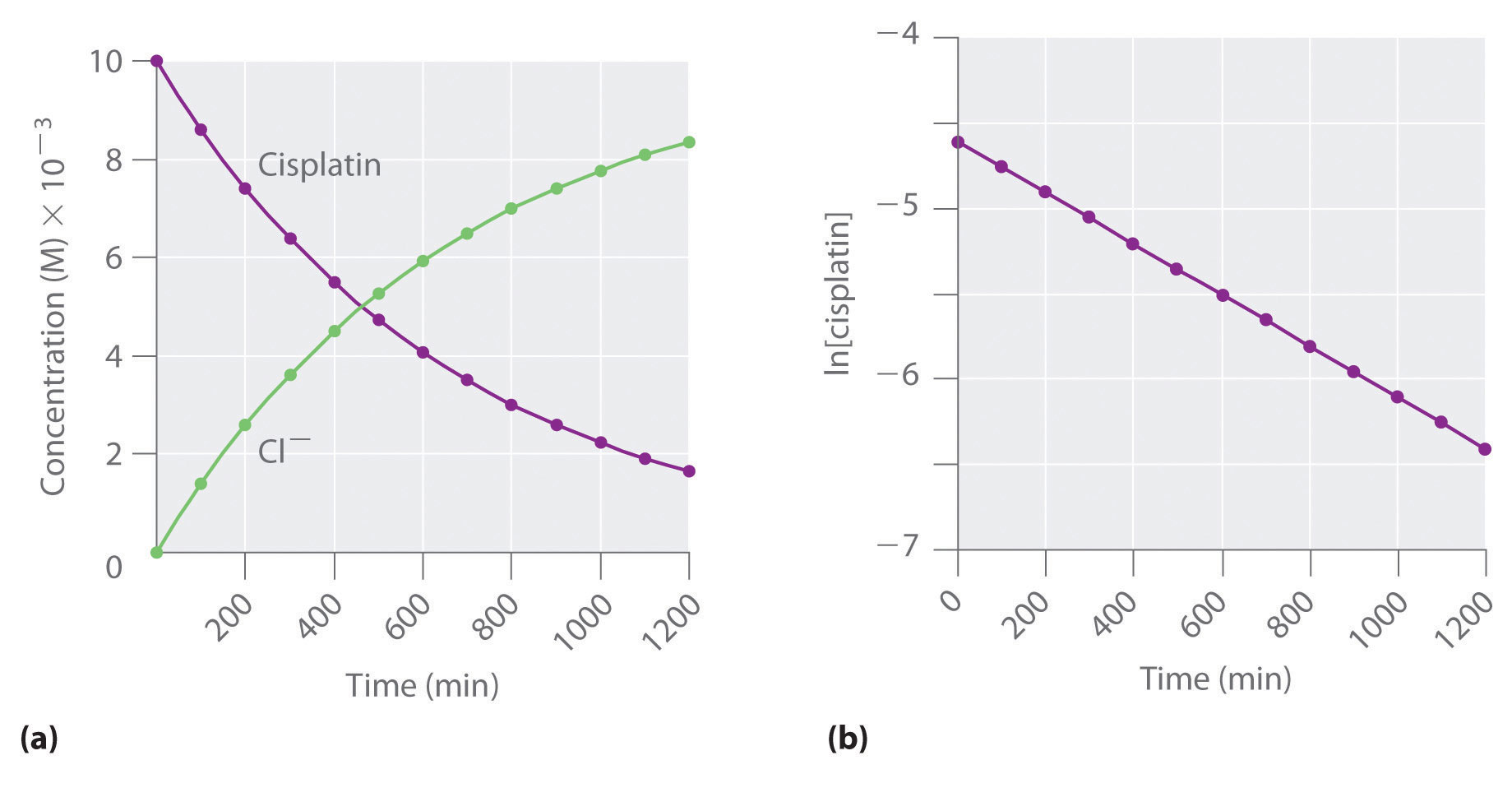
Las reacciones de primer orden son muy comunes. En este capítulo, ya hemos encontrado dos ejemplos de reacciones de primer orden: la hidrólisis de aspirina (Figura 14.2.1) y la reacción de bromuro de t-butilo con agua para dar t-butanol (Ecuación 14.7.7). Otra reacción que muestra cinética aparente de primer orden es la hidrólisis del fármaco anticancerígeno cisplatino.
El cisplatino, el primer fármaco anticancerígeno “inorgánico” que se descubre, es único en su capacidad para causar la remisión completa de los cánceres relativamente raros pero mortales de los órganos reproductivos en adultos jóvenes. Las estructuras del cisplatino y su producto de hidrólisis son las siguientes:
Ambos compuestos de platino tienen cuatro grupos dispuestos en un plano cuadrado alrededor de un ion Pt (II). La reacción mostrada en la Figura 14.11 es importante porque el cisplatino, la forma en que se administra el fármaco, no es la forma en la que el fármaco está activo. En cambio, al menos un ion cloruro debe ser reemplazado por agua para producir una especie que reaccione con el ácido desoxirribonucleico (ADN) para prevenir la división celular y el crecimiento tumoral. En consecuencia, la cinética de la reacción en la Figura 14.11 se ha estudiado extensamente para encontrar formas de maximizar la concentración de las especies activas.
Tenga en cuenta el patrón
Si una gráfica de concentración de reactivo versus tiempo no es lineal pero una gráfica del logaritmo natural de concentración de reactivo versus tiempo es lineal, entonces la reacción es de primer orden.
La ley de velocidad y el orden de reacción de la hidrólisis del cisplatino se determinan a partir de datos experimentales, como los que se muestran en la Tabla 14.3.1. La tabla enumera los datos de velocidad inicial para cuatro experimentos en los que la reacción se realizó a pH 7.0 y 25°C pero con diferentes concentraciones iniciales de cisplatino. Debido a que la velocidad de reacción aumenta con el aumento de la concentración de cisplatino, sabemos que esta no puede ser una reacción de orden cero. La comparación de los Experimentos 1 y 2 en la Tabla 14.3.1 muestra que la velocidad de reacción se duplica [(1.8 × 10 −5 m/min) ÷ (9.0 × 10 −6 m/min) = 2.0] cuando la concentración de cisplatino se duplica (de 0.0060 M a 0.012 M). De igual manera, al comparar los Experimentos 1 y 4 se observa que la velocidad de reacción aumenta en un factor de 5 [(4.5 × 10 −5 m/min) ÷ (9.0 × 10 −6 m/min) = 5.0] cuando la concentración de cisplatino se incrementa en un factor de 5 (de 0.0060 M a 0.030 M). Debido a que la velocidad de reacción es directamente proporcional a la concentración del reactivo, el exponente de la concentración de cisplatino en la ley de velocidad debe ser 1, por lo que la ley de velocidad es tasa = k [cisplatino] 1. Así la reacción es de primer orden. Sabiendo esto, podemos calcular la constante de velocidad usando la ley de tasa diferencial para una reacción de primer orden y los datos en cualquier fila del Cuadro 14.3.1. Por ejemplo, sustituyendo los valores del Experimento 3 en la Ecuación 14.19,
3.6 × 10 −5 m/min = k (0.024 M)
1.5 × 10 −3 min −1 = k
Tabla 14.3.1 Tasas de hidrólisis de cisplatino en función de la concentración a pH 7.0 y 25°C
| Experimento | [Cisplatino] 0 (M) | Tasa Inicial (m/min) |
|---|---|---|
| 1 | 0.0060 | 9.0 × 10 −6 |
| 2 | 0.012 | 1.8 × 10 −5 |
| 3 | 0.024 | 3.6 × 10 −5 |
| 4 | 0.030 | 4.5 × 10 −5 |
Conocer la constante de velocidad para la hidrólisis del cisplatino y las constantes de velocidad para reacciones posteriores que producen especies altamente tóxicas permite a los farmacéuticos hospitalarios proporcionar a los pacientes soluciones que contienen solo la forma deseada del medicamento.
Ejemplo 14.3.1
A altas temperaturas, el cloruro de etilo produce HCl y etileno mediante la siguiente reacción:
\( CH_{3}CH_{2}Cl\left ( g \right )\overset{\Delta }{\rightarrow} HCl\left ( g \right )+C_{2}H_{4}\left ( g \right ) \)
Utilizando los datos de velocidad para la reacción a 650°C presentados en la siguiente tabla, calcular el orden de reacción con respecto a la concentración de cloruro de etilo y determinar la constante de velocidad para la reacción.
| Experimento | [CH 3 CH 2 Cl] 0 (M) | Tasa Inicial (M/S) |
|---|---|---|
| 1 | 0.010 | 1.6 × 10 −8 |
| 2 | 0.015 | 2.4 × 10 −8 |
| 3 | 0.030 | 4.8 × 10 −8 |
| 4 | 0.040 | 6.4 × 10 −8 |
Dado: ecuación química equilibrada, concentraciones iniciales de reactivo y velocidades iniciales de reacción
Preguntado por: orden de reacción y constante de velocidad
Estrategia:
A Comparar los datos de dos experimentos para determinar el efecto sobre la velocidad de reacción de cambiar la concentración de una especie.
B Comparar el efecto observado con comportamientos característicos de reacciones de orden cero y primer orden para determinar el orden de reacción. Escribe la ley de tarifas para la reacción.
C Utilice las concentraciones medidas y los datos de velocidad de cualquiera de los experimentos para encontrar la constante de velocidad.
Solución:
El orden de reacción con respecto al cloruro de etilo se determina examinando el efecto de los cambios en la concentración de cloruro de etilo sobre la velocidad de reacción.
A Comparando los Experimentos 2 y 3 muestra que duplicar la concentración duplica la velocidad de reacción, por lo que la velocidad de reacción es proporcional a [CH 3 CH 2 Cl]. De igual manera, al comparar los Experimentos 1 y 4 se observa que cuadruplicar la concentración cuadruplica la velocidad de reacción, indicando nuevamente que la velocidad de reacción es directamente proporcional a [CH 3 CH 2 Cl].
B Este comportamiento es característico de una reacción de primer orden, para lo cual la ley de velocidad es tasa = k [CH 3 CH 2 Cl].
C Podemos calcular la constante de velocidad (k) usando cualquier fila de la tabla. Al seleccionar el Experimento 1 se obtiene lo siguiente:
1.60 × 10 −8 m/s = k (0.010 M) 1.6 × 10 −6 s −1 = k
Ejercicio
El cloruro de sulfurilo (SO 2 Cl 2) se descompone a SO 2 y Cl 2 mediante la siguiente reacción:
SO 2 Cl 2 (g) → SO 2 (g) + Cl 2 (g)
Los datos para la reacción a 320°C se listan en la siguiente tabla. Calcular el orden de reacción con respecto al cloruro de sulfurilo y determinar la constante de velocidad para la reacción.
| Experimento | [SO 2 Cl 2] 0 (M) | Tasa Inicial (M/S) |
|---|---|---|
| 1 | 0.0050 | 1.10 × 10 −7 |
| 2 | 0.0075 | 1.65 × 10 −7 |
| 3 | 0.0100 | 2.20 × 10 −7 |
| 4 | 0.0125 | 2.75 × 10 −7 |
Respuesta: primer orden; k = 2.2 × 10 −5 s −1
Figura 14.3.5 La hidrólisis del cisplatino, una reacción de primer orden Estas gráficas muestran la hidrólisis del cisplatino a pH 7.0 y 25°C como (a) las concentraciones determinadas experimentalmente de cisplatino e iones cloruro frente al tiempo y (b) el logaritmo natural del cisplatino concentración versus tiempo. La línea recta en (b) se espera para una reacción de primer orden.
También podemos usar la ley de velocidad integrada para determinar la velocidad de reacción para la hidrólisis del cisplatino. Para ello, se examina el cambio en la concentración del reactivo o del producto en función del tiempo a una sola concentración inicial de cisplatino. La parte (a) de la Figura 14.3.5 muestra gráficas para una solución que originalmente contenía cisplatino 0.0100 M y se mantuvo a pH 7 y 25°C, la concentración de cisplatino disminuye suavemente con el tiempo y la concentración de ion cloruro aumenta de manera similar. Cuando trazamos el logaritmo natural de la concentración de cisplatino versus tiempo, obtenemos la gráfica mostrada en la parte (b) en la Figura 14.3.5. La línea recta es consistente con el comportamiento de un sistema que obedece a una ley de primer orden. Podemos usar cualquiera de dos puntos en la línea para calcular la pendiente de la línea, lo que nos da la constante de velocidad para la reacción. Tomando así los puntos de la parte (a) de la Figura 14.3.5 para t = 100 min ([cisplatino] = 0.0086 M) y t = 1000 min ([cisplatino] = 0.0022 M),
\( slope = \dfrac{ln\left [ cisplatin \right ]_{1000}- ln \left [ cisplatin \right ]_{100}}{1000\;min-100\;min} \)
\( -k = \dfrac{ln 0.0022-ln 0.0086}{1000\;min-100\;min}=\dfrac{-6.12-\left ( -4.76 \right )}{900\; min}=-1.51\times 10^{-3} min^{-1} \)
\( k = 1.51\times 10^{-3} \; min^{-1} \)
La pendiente es negativa porque estamos calculando la tasa de desaparición del cisplatino. Además, la constante de velocidad tiene unidades de min −1 porque los tiempos trazados en los ejes horizontales en las partes (a) y (b) en la Figura 14.3.5 son en minutos en lugar de segundos.
El orden de reacción y la magnitud de la constante de velocidad que obtenemos usando la ley de tasa integrada son exactamente los mismos que calculamos anteriormente usando la ley de tasa diferencial. Esto debe ser cierto si los experimentos se llevaron a cabo en las mismas condiciones.
Ejemplo 14.3.2
Consulte de nuevo al Ejemplo 4. Si una muestra de cloruro de etilo con una concentración inicial de 0.0200 M se calienta a 650°C, ¿cuál es la concentración de cloruro de etilo después de 10 h? ¿Cuántas horas a 650°C deben transcurrir para que la concentración disminuya a 0.0050 M? (Recordemos que calculamos la constante de velocidad para esta reacción en el Ejemplo 4.)
Dado: concentración inicial, constante de velocidad e intervalo de tiempo
Preguntado por: concentración en el tiempo y tiempo especificado requerido para obtener una concentración particular
Estrategia:
A Valores de sustitución para la concentración inicial ([A] 0) y la constante de velocidad calculada para la reacción (k) en la ley de velocidad integrada para una reacción de primer orden. Calcular la concentración ([A]) en el momento dado t.
B Dada una concentración [A], resolver la ley de tasa integrada para el tiempo t.
Solución:
La forma exponencial de la ley de tasa integrada para una reacción de primer orden (Ecuación 14. 3.6) es [A] = [A] 0 e − kt.
A Habiendo sido dada la concentración inicial de cloruro de etilo ([A] 0) y habiendo calculado la constante de velocidad en el Ejemplo 4 (k = 1.6 × 10 −6 s-1), podemos usar la ley de velocidad para calcular la concentración del reactivo en un tiempo dado t . Sustituyendo los valores conocidos en la ley de tasas integradas,
\( \left [ CH_{3} CH_{2}Cl \right ]_{10\;h}=\left [ CH_{3} CH_{2}Cl \right ]_{0}e^{-kt} \)
\( =0.0200\;M \; exp \left [ \left (-1.6\times 10^{-6}\;s^{-1} \right ) \left ( 10\;h \right ) \left ( 60\;min/h \right )\left ( 60 \;s/min \right ) \right ) ] \)
\ (= 0.0189\; M
También podríamos haber utilizado la forma logarítmica de la ley de tasa integrada (Ecuación 14.3.7):
\( ln \left [ CH_{3} CH_{2}Cl \right ]_{10\;h}=ln \left [ CH_{3} CH_{2}Cl \right ]_{0} -kt \)
\( = ln 0.0200\;M - \left (-1.6\times 10^{-6}\;s^{-1} \right ) \left ( 10\;h \right ) \left ( 60\;min/h \right )\left ( 60 \;s/min \right ) \)
\( = -3.912--0.0576=-3.970 \)
\( \left [ CH_{3} CH_{2}Cl \right ]_{10\;h}=e^{-3.970}\;M \)
=0.0189\; M
B Para calcular la cantidad de tiempo requerido para alcanzar una concentración dada, debemos resolver la ley de tasa integrada para t. La ecuación 14.3.7 da lo siguiente:
\( ln \left [ CH_{3} CH_{2}Cl \right ]_{t}=ln \left [ CH_{3} CH_{2}Cl \right ]_{0} -kt \)
\( kt= ln \left [ CH_{3} CH_{2}Cl \right ]_{0} -ln \left [ CH_{3} CH_{2}Cl \right ]_{t}= ln \; \dfrac{\left [ CH_{3} CH_{2}Cl \right ]_{0}}{ \left [ CH_{3} CH_{2}Cl \right ]_{t}} \)
\( t= \dfrac{1}{k}\; ln\dfrac{\left [ CH_{3} CH_{2}Cl \right ]_{0}}{\left [ CH_{3} CH_{2}Cl \right ]_{t}} = \dfrac{1}{1.6\times 10^{-6}\;s^{-1}}\; ln\dfrac{0.0200\;M}{0.0050\;M} \)
\( t= \dfrac{ln\;4.0}{k}\; =8.7\times 10^{5}\;s=240\;h=2.4\times 10^{2}\;h \)
Ejercicio
En el ejercicio del Ejemplo 4, encontró que la descomposición del cloruro de sulfurilo (SO 2 Cl 2) es de primer orden, y calculó la constante de velocidad a 320°C. Utilice la (s) forma (s) de la ley de tasa integrada para encontrar la cantidad de SO 2 Cl 2 que queda después de las 20 h si a muestra con una concentración original de 0.123 M se calienta a 320°C. ¿Cuánto tiempo tardaría 90% del SO 2 Cl 2 en descomponerse?
Respuesta: 0,0252 M; 29 h
Reacciones de segundo orden
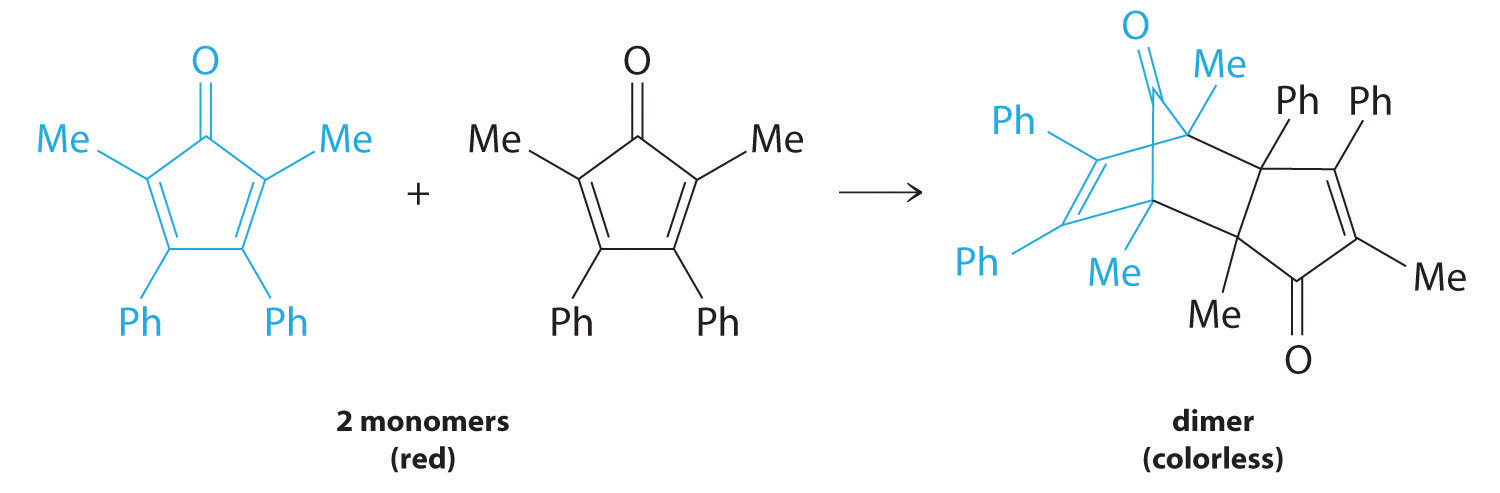
El tipo más simple de reacción de segundo orden Una reacción cuya velocidad es proporcional al cuadrado de la concentración del reactivo (para una reacción con la forma general 2A → productos) o es proporcional al producto de las concentraciones de dos reactivos (para una reacción con el general forma A + B → productos). es aquella cuya tasa es proporcional al cuadrado de la concentración de un reactivo. Estos generalmente tienen la forma 2A → productos. Un segundo tipo de reacción de segundo orden tiene una velocidad de reacción que es proporcional al producto de las concentraciones de dos reactivos. Tales reacciones generalmente tienen la forma A + B → productos. Un ejemplo de la primera es una reacción de dimerización, en la que dos moléculas más pequeñas, cada una llamada monómero, se combinan para formar una molécula más grande (un dímero).
La ley de velocidad diferencial para la reacción de segundo orden más simple en la que 2A → productos es la siguiente:
\( rate=-\dfrac{\Delta \left [ A \right ]}{2 \Delta t}=k\left [ reactant \right ]^{2} \tag{14.3.8} \)
En consecuencia, duplicar la concentración de A cuadruplica la velocidad de reacción. Para que las unidades de la velocidad de reacción sean moles por litro por segundo (m/S), las unidades de una constante de velocidad de segundo orden deben ser las inversas (M −1 ·s −1). Debido a que las unidades de molaridad se expresan como mol/L, la unidad de la constante de velocidad también se puede escribir como L (mol·s).
Para la reacción 2A → productos, la siguiente ley de velocidad integrada describe la concentración del reactivo en un momento dado:
\( \dfrac{1 }{\left [ A \right ]}= \dfrac{1 }{\left [ A_{0} \right ]} +kt \tag{14.3.9} \)
Debido a que la Ecuación 14.3.9 tiene la forma de una ecuación algebraica para una línea recta, y = mx + b, con y = 1/ [A] y b = 1/ [A] 0, una gráfica de 1/ [A] versus t para una reacción simple de segundo orden es una recta línea con una pendiente de k y una intercepción de 1/ [A] 0.
Tenga en cuenta el patrón
Las reacciones de segundo orden generalmente tienen la forma 2A → productos o A + B → productos.
Las reacciones simples de segundo orden son comunes. Además de las reacciones de dimerización, otros dos ejemplos son la descomposición de NO 2 a NO y O 2 y la descomposición de HI a I 2 y H 2. La mayoría de los ejemplos involucran moléculas inorgánicas simples, pero también hay ejemplos orgánicos. Podemos seguir el avance de la reacción descrita en el siguiente párrafo monitoreando la disminución en la intensidad del color rojo de la mezcla de reacción.
Muchos compuestos orgánicos cíclicos que contienen dos dobles enlaces carbono-carbono se someten a una reacción de dimerización para dar estructuras complejas. Un ejemplo es el siguiente:
Por simplicidad, nos referiremos a este reactivo y producto como “monómero” y “dímero”, respectivamente. El nombre sistemático del monómero es 2,5-dimetil-3,4-difenilciclopentadienona. El nombre sistemático del dímero es el nombre del monómero seguido de “dímero”. Debido a que los monómeros son los mismos, la ecuación general para esta reacción es 2A → producto. Esta reacción representa una clase importante de reacciones orgánicas utilizadas en la industria farmacéutica para preparar esqueletos de carbono complejos para la síntesis de fármacos. Al igual que las reacciones de primer orden estudiadas anteriormente, se puede analizar utilizando la ley de tasa diferencial (Ecuación 14.3.8) o la ley de tasa integrada (Ecuación 14.3.9).
Para determinar la ley de velocidad diferencial para la reacción, necesitamos datos sobre cómo varía la velocidad de reacción en función de las concentraciones de monómero, los cuales se proporcionan en la Tabla 14.3.2. A partir de los datos, vemos que la velocidad de reacción no es independiente de la concentración de monómero, por lo que esta no es una reacción de orden cero. También vemos que la velocidad de reacción no es proporcional a la concentración de monómero, por lo que la reacción no es de primer orden. La comparación de los datos en la segunda y cuarta filas muestra que la velocidad de reacción disminuye en un factor de 2.8 cuando la concentración de monómero disminuye en un factor de 1.7:
\( \dfrac{5.0\times 10^{-5}\;M/min }{1.8\times 10^{-5}\;M/mi}=2.8 \;\;and\;\;\dfrac{3.4\times 10^{-3}\;M/min }{2.0\times 10^{-3}\;M/mi}=1.7 \)Tabla 14.3.2 Tasas de reacción en función de la concentración de monómero para una concentración inicial de monómero de 0.0054 M
| Tiempo (min) | [Monómero] (M) | Tasa instantánea (m/min) |
|---|---|---|
| 10 | 0.0044 | 8.0 × 10 −5 |
| 26 | 0.0034 | 5.0 × 10 −5 |
| 44 | 0.0027 | 3.1 × 10 −5 |
| 70 | 0.0020 | 1.8 × 10 −5 |
| 120 | 0.0014 | 8.0 × 10 −6 |
Debido a que (1.7) 2 = 2.9 ≈ 2.8, la velocidad de reacción es aproximadamente proporcional al cuadrado de la concentración de monómero.
\( rate \;\;\alpha\;\;\left [ monomer \right ]^{2} \)
Esto significa que la reacción es de segundo orden en el monómero. Usando la Ecuación 14.3.8 y los datos de cualquier fila en la Tabla 14.3.2, podemos calcular la constante de velocidad. Sustituir valores en el tiempo 10 min, por ejemplo, da lo siguiente:
\( rate = k\left [ A^{2} \right ] \)
\( 8.0\times 10^{-5}\;M/min = k\left (4.4\times 10^{-3}\;M \right ) \)
\( 4.1\;min^{-1} = k \)
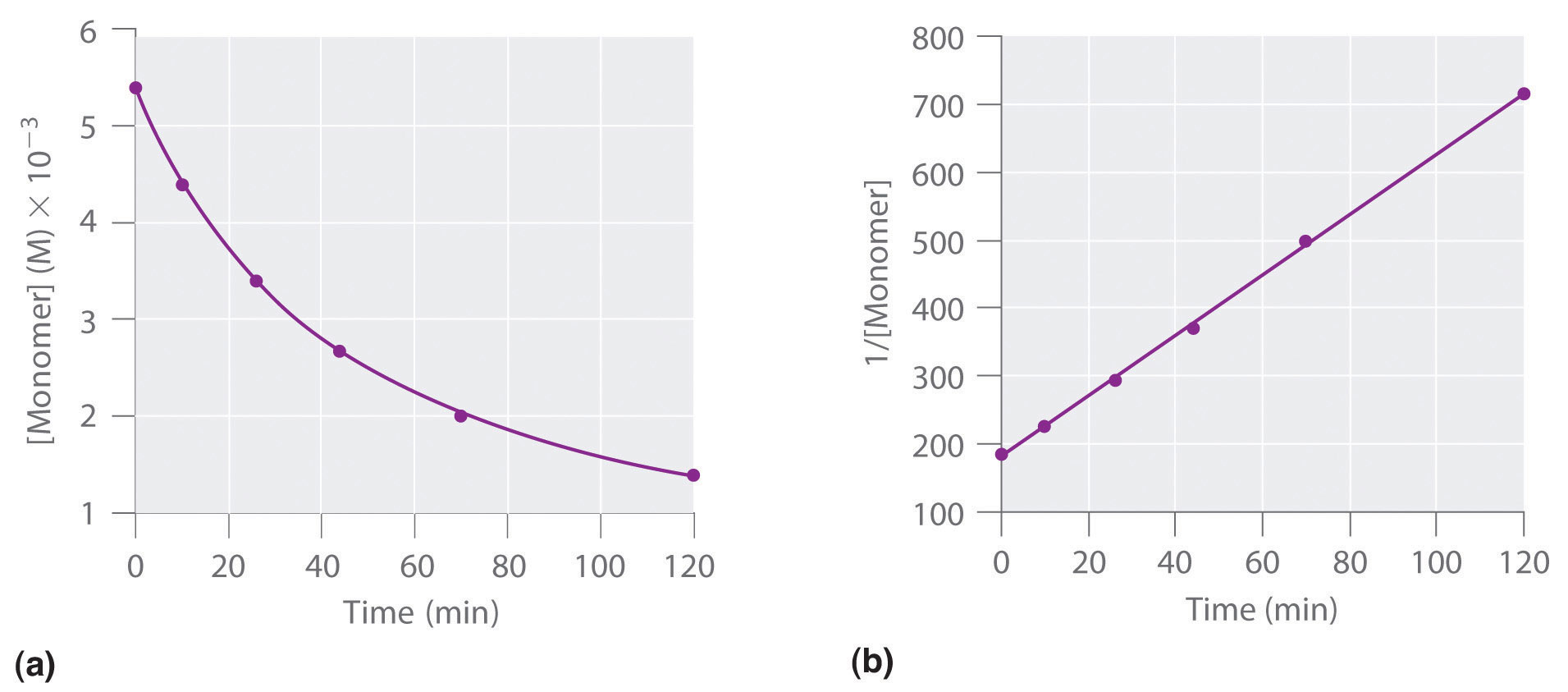
También podemos determinar el orden de reacción usando la ley de velocidad integrada. Para ello, se utiliza la disminución en la concentración del monómero en función del tiempo para una sola reacción, representada en la parte (a) en la Figura 14.3.6. Las mediciones muestran que la concentración del monómero (inicialmente 5.4 × 10 −3 M) disminuye con el aumento del tiempo. Esta gráfica también muestra que la velocidad de reacción disminuye suavemente con el aumento del tiempo. De acuerdo con la ley de velocidad integrada para una reacción de segundo orden, una gráfica de 1/ [monómero] versus t debe ser una línea recta, como se muestra en la parte (b) en la Figura 14.3.6. Cualquier par de puntos en la línea se puede utilizar para calcular la pendiente, que es la constante de velocidad de segundo orden. En este ejemplo, k = 4.1 M −1 ·min −1, lo que es consistente con el resultado obtenido usando la ecuación de tasa diferencial. Si bien en este ejemplo el coeficiente estequiométrico es el mismo que el orden de reacción, no siempre es así. El orden de reacción siempre debe determinarse experimentalmente.
Figura 14.3.6 Dimerización de un Compuesto Monomérico, una Reacción de Segundo Orden Estas gráficas corresponden a la dimerización del monómero en la Figura 14.13 como (a) la concentración determinada experimentalmente de monómero frente al tiempo y (b) 1/ [monómero] frente al tiempo. La línea recta en (b) se espera para una reacción simple de segundo orden.
Para dos o más reacciones del mismo orden, la reacción con la mayor constante de velocidad es la más rápida. Debido a que las unidades de las constantes de velocidad para las reacciones de cero, primer y segundo orden son diferentes, sin embargo, no podemos comparar las magnitudes de las constantes de velocidad para reacciones que tienen diferentes órdenes. Las leyes de tasa diferencial e integrada para reacciones de orden cero, primer y segundo orden y sus correspondientes gráficas se muestran en la Figura 14.4.2 de la Sección 14.4.
Ejemplo 14.3.3
A altas temperaturas, el dióxido de nitrógeno se descompone en óxido nítrico y oxígeno.
\( 2NO_{2}\left ( g \right )\overset{\Delta }{\rightarrow} 2NO\left ( g \right )+O_{2}\left ( g \right )\)
Los datos experimentales para la reacción a 300°C y cuatro concentraciones iniciales de NO 2 se enumeran en la siguiente tabla:
| Experimento | [NO 2] 0 (M) | Tasa Inicial (M/S) |
|---|---|---|
| 1 | 0.015 | 1.22 × 10 −4 |
| 2 | 0.010 | 5.40 × 10 −5 |
| 3 | 0.0080 | 3.46 × 10 −5 |
| 4 | 0.0050 | 1.35 × 10 −5 |
Determinar el orden de reacción y la constante de velocidad.
Dado: ecuación química equilibrada, concentraciones iniciales y tasas iniciales
Preguntado por: orden de reacción y constante de velocidad
Estrategia:
A A partir de los experimentos, compare los cambios en las velocidades de reacción iniciales con los cambios correspondientes en las concentraciones iniciales. Determinar si los cambios son característicos de reacciones de orden cero, primer o segundo orden.
B Determinar la ley de tarifas correspondiente. Usando esta ley de tasa y los datos de cualquier experimento, resuelva para la constante de velocidad (k).
Solución:
A Podemos determinar el orden de reacción con respecto al dióxido de nitrógeno comparando los cambios en las concentraciones de NO 2 con las velocidades de reacción correspondientes. Al comparar los Experimentos 2 y 4, por ejemplo, se muestra que duplicar la concentración cuadruplica la velocidad de reacción [(5.40 × 10 −5) ÷ (1.35 × 10 −5) = 4.0], lo que significa que la velocidad de reacción es proporcional a [NO 2] 2. De igual manera, al comparar los Experimentos 1 y 4 se observa que triplicar la concentración aumenta la velocidad de reacción en un factor de 9, indicando nuevamente que la velocidad de reacción es proporcional a [NO 2] 2. Este comportamiento es característico de una reacción de segundo orden.
B Tenemos tasa = k [NO 2] 2. Podemos calcular la constante de velocidad (k) utilizando datos de cualquier experimento de la tabla. Al seleccionar el Experimento 2, por ejemplo, se da lo siguiente:
\( rate = k\left [ NO_{2} \right ]^{2} \)
\( 5.40\times 10^{-5}\; M/s = k\left (0.010\;M \right )^{2} \)
\( 0.540\; M^{-1}s^{-1} = k \)
Ejercicio
Cuando la especie altamente reactiva HO 2 se forma en la atmósfera, una reacción importante que luego la elimina de la atmósfera es la siguiente:
2HO 2 (g) → H 2 O 2 (g) + O 2 (g)
La cinética de esta reacción se ha estudiado en el laboratorio, y algunos datos de velocidad inicial a 25°C se enumeran en la siguiente tabla:
| Experimento | [HO 2] 0 (M) | Tasa Inicial (M/S) |
|---|---|---|
| 1 | 1.1 × 10 −8 | 1.7 × 10 −7 |
| 2 | 2.5 × 10 −8 | 8.8 × 10 −7 |
| 3 | 3.4 × 10 −8 | 1.6 × 10 −6 |
| 4 | 5.0 × 10 −8 | 3.5 × 10 −6 |
Determinar el orden de reacción y la constante de velocidad.
Respuesta: segundo orden en HO 2; k = 1.4 × 10 9 M −1 ·s −1
Tenga en cuenta el patrón
Si una gráfica de concentración de reactante versus tiempo no es lineal pero una gráfica de 1/concentración de reacción versus tiempo es lineal, entonces la reacción es de segundo orden.
Ejemplo 14.3.4
Si un matraz que inicialmente contiene 0.056 M NO 2 se calienta a 300°C, ¿cuál será la concentración de NO 2 después de 1.0 h? ¿Cuánto tiempo tomará para que la concentración de NO 2 disminuya al 10% de la concentración inicial? Utilizar la ley de velocidad integrada para una reacción de segundo orden (Ecuación 14.3.9) y la constante de velocidad calculada en el Ejemplo 6.
Dado: ecuación química equilibrada, constante de velocidad, intervalo de tiempo y concentración inicial
Preguntado por: concentración final y tiempo requerido para alcanzar la concentración especificada
Estrategia:
A Dado k, t y [A] 0, utilizan la ley de tasa integrada para una reacción de segundo orden para calcular [A].
B Estableciendo [A] igual a 1/10 de [A] 0, usa la misma ecuación para resolver para t.
Solución:
A Conocemos k y [NO 2] 0, y se nos pide determinar [NO 2] a t = 1 h (3600 s). Sustituyendo los valores apropiados en la Ecuación 14.3.9,
\( \dfrac{1}{\left [NO_{2} \right ]_{3600}} = \dfrac{1}{\left [NO_{2} \right ]_{0}} +kt=\dfrac{1}{0.056\;M} +\left ( 0.54\;M^{-1}s^{-1} \right )\left (3600\; s \right ) \)
\( =2.0\times 10^{-3} \; M^{-1} \)
Así [NO 2] 3600 = 5.1 × 10 −4 M.
B En este caso, conocemos k y [NO 2] 0, y se nos pide calcular a qué hora [NO 2] = 0.1 [NO 2] 0 = 0.1 (0.056 M) = 0.0056 M. Para ello, resolvemos la Ecuación 14.3.9 para t, utilizando la concentraciones dadas.
\( \dfrac{\dfrac{1}{\left [NO_{2} \right ]_{3600}} - \dfrac{1}{\left [NO_{2} \right ]_{0}}}{k} =\dfrac{\left ( 1/0.0056\;M \right )-\left ( 1/0.056\;M \right )}{0.54\;M^{-1}s^{-1}}=3.0\times10^{2}\;s=5\;min \)
El NO 2 se descompone muy rápidamente; bajo estas condiciones, la reacción es 90% completa en solo 5.0 min.
Ejercicio
En el ejercicio del Ejemplo 6, calculaste la constante de velocidad para la descomposición de HO 2 como k = 1.4 × 10 9 M −1 ·s −1. Esta constante de alta velocidad significa que el HO 2 se descompone rápidamente bajo las condiciones de reacción dadas en el problema. De hecho, la molécula HO 2 es tan reactiva que es prácticamente imposible de obtener en altas concentraciones. Dada una muestra de 0.0010 M de HO 2, se calcula la concentración de HO 2 que queda después de 1.0 h a 25°C. ¿Cuánto tiempo tardará el 90% del HO 2 en descomponerse? Utilizar la ley de velocidad integrada para una reacción de segundo orden (Ecuación 14.3.9) y la constante de velocidad calculada en el ejercicio del Ejemplo 6.
Respuesta: 2.0 × 10 −13 M; 6.4 × 10 −6 s
Además de la simple reacción de segundo orden y ley de velocidad que acabamos de describir, otra reacción de segundo orden muy común tiene la forma general A + B → productos, en la que la reacción es de primer orden en A y primer orden en B. La ley de velocidad diferencial para esta reacción es la siguiente:
\( rate=-\dfrac{\Delta \left [ A \right ]}{\Delta t}=-\dfrac{\Delta \left [ B \right ]}{\Delta t}=k\left [ A \right ]\left [ B \right ] \tag{14.3.10}\)
Debido a que la reacción es de primer orden tanto en A como en B, tiene un orden de reacción general de 2. (La ley de tasa integrada para esta reacción es bastante compleja, por lo que no la describiremos). Podemos reconocer reacciones de segundo orden de este tipo porque la velocidad de reacción es proporcional a las concentraciones de cada reactivo. Presentamos un ejemplo al final de la Sección 14.2, la reacción de CH 3 Br con OH − para producir CH 3 OH.
Determinación de la Ley de Velocidad de una Reacción
El número de mecanismos fundamentalmente diferentes (conjuntos de etapas en una reacción) es en realidad bastante pequeño en comparación con el gran número de reacciones químicas que pueden ocurrir. Entendiendo así los mecanismos de reacción La secuencia de eventos que ocurren a nivel molecular durante una reacción. puede simplificar lo que podría parecer una variedad confusa de reacciones químicas. El primer paso para descubrir el mecanismo de reacción es determinar la ley de velocidad de la reacción. Esto se puede hacer diseñando experimentos que midan la (s) concentración (es) de uno o más reactivos o productos en función del tiempo. Para la reacción A + B → productos, por ejemplo, necesitamos determinar k y los exponentes m y n en la siguiente ecuación:
\( rate=k\left [ A \right ]^{m}\left [ B \right ]^{n} \tag{14.3.11} \)
Para ello, podríamos mantener constante la concentración inicial de B variando la concentración inicial de A y calculando la velocidad de reacción inicial. Esta información nos permitiría deducir el orden de reacción con respecto a A. De manera similar, podríamos determinar el orden de reacción con respecto a B estudiando la velocidad de reacción inicial cuando la concentración inicial de A se mantiene constante mientras se varía la concentración inicial de B. En ejemplos anteriores, se determinó el orden de reacción con respecto a un reactivo dado comparando las diferentes velocidades obtenidas cuando solo se cambió la concentración del reactivo en cuestión. Una forma alternativa de determinar los órdenes de reacción es establecer una proporción usando las leyes de velocidad para dos experimentos diferentes.
Los datos de velocidad para una reacción hipotética del tipo A + B → productos se dan en la Tabla 14.3.3. La ley general de velocidad para la reacción se da en la Ecuación 14.3.11. Podemos obtener m o n directamente usando una proporción de las leyes de velocidad para dos experimentos en los que la concentración de un reactivo es la misma, como los Experimentos 1 y 3 en la Tabla 14.3.3.
Cuadro 14.3.3 Datos de Velocidad para una Reacción Hipotética de la Forma A + B → Productos
| Experimento | [A] (M) | [B] (M) | Tasa Inicial (m/min) |
|---|---|---|---|
| 1 | 0.50 | 0.50 | 8.5 × 10 −3 |
| 2 | 0.75 | 0.50 | 19 × 10 −3 |
| 3 | 1.00 | 0.50 | 34 × 10 −3 |
| 4 | 0.50 | 0.75 | 8.5 × 10 −3 |
| 5 | 0.50 | 1.00 | 8.5 × 10 −3 |
\( \dfrac{rate^{1}}{rate^{3}}= \dfrac{k\left [ A^{1} \right ]^{m}\left [ B^{1} \right ]^{n}}{k\left [ A^{3} \right ]^{m}\left [ B^{3} \right ]^{n}} \)
Insertando los valores apropiados de la Tabla 14.3.3,
\( \dfrac{8.5\times10^{-3}\;\cancel{M/min}}{34.\times10^{-3}\;\cancel{M/min}}= \dfrac{k\left [ 0.50\;\cancel{M} \right ]^{m}\cancel{\left [ 05.0\;M \right ]^{n}}}{k\left [ 1.00\;\cancel{M} \right ]^{m}\cancel{\left [ 0.50\;M \right ]^{n}}} \)
Debido a que 1.00 a cualquier potencia es 1, [1.00 M] m = 1.00 M. Podemos cancelar términos similares para dar 0.25 = [0.50] m, que también se puede escribir como 1/4 = [1/2] m. Así podemos concluir que m = 2 y que la reacción es de segundo orden en A. Al seleccionar dos experimentos en los que la concentración de B es la misma, pudimos resolver para m.
Por el contrario, al seleccionar dos experimentos en los que la concentración de A es la misma (por ejemplo, los Experimentos 5 y 1), podemos resolver para n.
\( \dfrac{rate^{1}}{rate^{3}}= \dfrac{k\left [ A^{1} \right ]^{m}\left [ B^{1} \right ]^{n}}{k\left [ A^{5} \right ]^{m}\left [ B^{5} \right ]^{n}} \)
Sustituyendo los valores apropiados del Cuadro 14.3.3,
\( \dfrac{8.5\times10^{-3}\;\cancel{M/min}}{8.5\times10^{-3}\;\cancel{M/min}}= \dfrac{\cancel{k\left [ 0.50\;\cancel{M} \right ]^{m}}\left [ 05.0\;\cancel{M} \right ]^{n}}{\cancel{k\left [ 0.50\;M \right ]^{m}}\left [ 1.00\;\cancel{M} \right ]^{n}} \)
La cancelación deja 1.0 = [0.50] n, lo que da n = 0; es decir, la reacción es de orden cero en B. La ley de velocidad determinada experimentalmente es, por lo tanto
\( rate=k\left [ A \right ]^{2}\left [ B \right ]^{0} \)
Ahora podemos calcular la constante de velocidad insertando los datos de cualquier fila de la Tabla 14.3.3 en la ley de tasa determinada experimentalmente y resolviendo para k. Usando el Experimento 2, obtenemos
\( 19.\times10^-3\; M/min=k\left ( 0.75\;M \right )^{2} \)
\( 3.4\times10^-2\; M^{-1}min^{-1}=k \)
Debe verificar que el uso de datos de cualquier otra fila de la Tabla 14.3.3 da la misma constante de velocidad. Esto debe ser cierto siempre y cuando las condiciones experimentales, como la temperatura y el disolvente, sean las mismas.
Ejemplo 14.3.5
El óxido nítrico es producido en el cuerpo por varias enzimas diferentes y actúa como una señal que controla la presión arterial, la memoria a largo plazo y otras funciones críticas. La ruta principal para eliminar NO de fluidos biológicos es mediante reacción con O 2 para dar NO 2, que luego reacciona rápidamente con agua para dar ácido nitroso y ácido nítrico:
Estas reacciones son importantes para mantener niveles estables de NO. La siguiente tabla enumera los datos cinéticos para la reacción de NO con O 2 a 25°C:
2NO (g) + O 2 (g) → 2NO 2 (g)Determinar la ley de velocidad para la reacción y calcular la constante de velocidad.
| Experimento | [NO] 0 (M) | [O 2] 0 (M) | Tasa Inicial (M/S) |
|---|---|---|---|
| 1 | 0.0235 | 0.0125 | 7.98 × 10 −3 |
| 2 | 0.0235 | 0.0250 | 15.9 × 10 −3 |
| 3 | 0.0470 | 0.0125 | 32.0 × 10 −3 |
| 4 | 0.0470 | 0.0250 | 63.5 × 10 −3 |
Dado: ecuación química equilibrada, concentraciones iniciales y tasas iniciales
Preguntado por: ley de tarifas y constante de tasa
Estrategia:
A Comparar los cambios en las concentraciones iniciales con los cambios correspondientes en las velocidades de reacción para determinar el orden de reacción para cada especie. Escribe la ley de tarifas para la reacción.
B Utilizando datos de cualquier experimento, sustituya los valores apropiados en la ley de tarifas. Resolver la ecuación de tasa para k.
Solución:
A Comparando los Experimentos 1 y 2 muestra que como [O 2] se duplica a un valor constante de [NO 2], la velocidad de reacción se duplica aproximadamente. Así, la velocidad de reacción es proporcional a [O 2] 1, por lo que la reacción es de primer orden en O 2. Comparando los Experimentos 1 y 3 muestra que la velocidad de reacción esencialmente se cuadruplica cuando [NO] se duplica y [O 2] se mantiene constante. Es decir, la velocidad de reacción es proporcional al [NO] 2, lo que indica que la reacción es de segundo orden en NO. Usando estas relaciones, podemos escribir la ley de tarifas para la reacción:
\( rate =k\left [ NO \right ]^{2}\left [ O_{2} \right ] \)
B Los datos en cualquier fila se pueden utilizar para calcular la constante de velocidad. Usando el Experimento 1, por ejemplo, da
\( k=\dfrac{k}{\left [ NO \right ]^{2}\left [ O_{2} \right ]} = \dfrac{7.98\times10{-3}\;M/s}{\left ( 0.0235\;M \right )^{2}\left ( 0.0125\;M \right )}=1.16\times10{3}\;M^{-2}s^{-1} \)
El orden general de reacción (m+ n) es 3, por lo que esta es una reacción de tercer orden, una reacción cuya velocidad está determinada por tres reactivos. Las unidades de la constante de velocidad se vuelven más complejas a medida que aumenta el orden general de reacción.
Ejercicio
El ion peroxidisulfato (S 2 O 8 2−) es un potente agente oxidante que reacciona rápidamente con el ión yoduro en agua:
\( S_{2}O_{8}^{2-}\left ( aq \right )+3I^{-}\left ( aq \right ) \rightarrow 2SO_{4}^{2-}\left ( aq \right )+I_{3}^{-}\left ( aq \right ) \)
En la siguiente tabla se enumeran los datos cinéticos de esta reacción a 25°C. Determinar la ley de velocidad y calcular la constante de velocidad.
| Experimento | [S 2 O 8 2−] 0 (M) | [I −] 0 (M) | Tasa Inicial (M/S) |
|---|---|---|---|
| 1 | 0.27 | 0.38 | 2.05 |
| 2 | 0.40 | 0.38 | 3.06 |
| 3 | 0.40 | 0.22 | 1.76 |
Respuesta: tasa = k [S 2 O 8 2−] [I −]; k = 20 M −1 ·s −1
Resumen
La velocidad de reacción de una reacción de orden cero es independiente de la concentración de los reactivos. La velocidad de reacción de una reacción de primer orden es directamente proporcional a la concentración de un reactivo. La velocidad de reacción de una reacción simple de segundo orden es proporcional al cuadrado de la concentración de un reactivo. Conocer la ley de velocidad de una reacción da pistas sobre el mecanismo de reacción.
Llave para llevar
- Ya sea la ley de velocidad diferencial o la ley de velocidad integrada se pueden utilizar para determinar el orden de reacción a partir de datos experimentales.
Ecuaciones Clave
reacción de orden cero
Ecuación 14.3.1\( rate = -\dfrac{\Delta \left [ A \right ] }{\Delta t} = k \)
Ecuación 14.3.2:\( \left [ A \right ]=\left [ A_{0} \right ]-kt \)
reacción de primer orden
Ecuación 14.3.5:\( rate=-\dfrac{\Delta \left [ A \right ]}{\Delta t}=k\left [ A \right] \)
Ecuación 14.3.6:\( \left [ A \right ]= \left [ A_{0} \right ] e^{-kt} \)
Ecuación 14.3.7:\( ln \left [ A \right ]= ln \left [ A_{0} \right ] -kt \)
reacción de segundo orden
Ecuación 14.3.8:\( ln \left [ A \right ]= ln \left [ A_{0} \right ] +kt \)
Ecuación 14.3.9:\( \dfrac{1 }{\left [ A \right ]}= \dfrac{1 }{\left [ A_{0} \right ]}+kt \)
Problemas conceptuales
-
¿Cuáles son las características de una reacción de orden cero? Experimentalmente, ¿cómo determinaría si una reacción es de orden cero?
-
Predice si las siguientes reacciones son de orden cero y explica tu razonamiento.
- una reacción de sustitución de un alcohol con HCl para formar un haluro de alquilo y agua
- hidrogenación catalítica de un alqueno
- hidrólisis de un haluro de alquilo a un alcohol
- conversión enzimática de nitrato a nitrito en una bacteria del suelo
-
En una reacción de primer orden, ¿cuál es la ventaja de utilizar la ley de tasa integrada expresada en logaritmos naturales sobre la ley de tasas expresada en forma exponencial?
-
Si la velocidad de reacción es directamente proporcional a la concentración de un reactivo, ¿qué le dice esto sobre (a) el orden de reacción con respecto al reactivo y (b) el orden general de reacción?
-
Se encuentra que la reacción de NO con O 2 es de segundo orden con respecto al NO y de primer orden con respecto a O 2. ¿Cuál es el orden general de reacción? ¿Cuál es el efecto de duplicar la concentración de cada reactivo en la velocidad de reacción?
Problemas numéricos
-
El yoduro reduce el Fe (III) de acuerdo con la siguiente reacción:
2Fe 3+ (soln) + 2I − (soln) → 2Fe 2+ (soln) + I 2 (soln)Experimentalmente, se encontró que duplicar la concentración de Fe (III) duplicó la velocidad de reacción y duplicar la concentración de yoduro incrementó la velocidad de reacción en un factor de 4. ¿Cuál es el orden de reacción con respecto a cada especie? ¿Cuál es la ley general de tarifas? ¿Cuál es el orden general de reacción?
-
El peróxido de benzoilo es un medicamento utilizado para tratar el acné. Su tasa de descomposición térmica a varias concentraciones se determinó experimentalmente, y los datos se tabularon de la siguiente manera:
Experimento [Peróxido de benzoilo] 0 (M) Tasa Inicial (M/S) 1 1.00 2.22 × 10 −4 2 0.70 1.64 × 10 −4 3 0.50 1.12 × 10 −4 4 0.25 0.59 × 10 −4 ¿Cuál es el orden de reacción con respecto al peróxido de benzoílo? ¿Cuál es la ley de tarifas para esta reacción?
-
El 1-Bromopropano es un líquido incoloro que reacciona con S 2 O 3 2− de acuerdo con la siguiente reacción:
C 3 H 7 Br + S 2 O 3 2− → C 3 H 7 S 2 O 3 − + Br −La reacción es de primer orden en 1-bromopropano y de primer orden en S 2 O 3 2−, con una constante de velocidad de 8.05 × 10 −4 M −1·s −1. Si iniciaste una reacción con 40 mmol/100 mL de C 3 H 7 Br y una concentración equivalente de S 2 O 3 2−, ¿cuál sería la velocidad de reacción inicial? Si tuvieras que disminuir la concentración de cada reactivo a 20 mmol/100 mL, ¿cuál sería la velocidad de reacción inicial?
-
La ley de velocidad experimental para la reacción 3A + 2B → C + D se encontró que era Δ [C] /Δ t = k [A] 2 [B] para una reacción global de tercer orden. Debido a que el análisis gráfico es difícil más allá de las reacciones de segundo orden, explicar el procedimiento para determinar experimentalmente la ley de tarifas.
RESPUESTAS
-
Primer orden en Fe 3+; segundo orden en I −; tercer orden general; tasa = k [Fe 3+] [I −] 2.
-
1.29 × 10 −4 M/s; 3.22 × 10 −5 M/s
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern