15.1: El concepto de equilibrio químico
- Page ID
- 77950
- Entender lo que se entiende por equilibrio químico.
El equilibrio químico es un proceso dinámico que consiste en una reacción directa, en la que los reactivos se convierten en productos, y una reacción inversa, en la que los productos se convierten en reactivos. En equilibrio, las reacciones hacia adelante y hacia atrás proceden a tasas iguales. Consideremos, por ejemplo, un sistema simple que contiene solo un reactivo y un producto, la disociación reversible del tetroóxido de dinitrógeno (N 2 O 4) a dióxido de nitrógeno (NO 2). Tal vez recuerdes del Capítulo 14 que el NO 2 es responsable del color marrón que asociamos con el smog. Cuando un tubo sellado que contiene N 2 O 4 sólido (mp = −9.3°C; bp = 21.2°C) se calienta de −78.4°C a 25°C, aparece el color rojo-marrón del NO 2 (Figura 15.1.1). La reacción se puede seguir visualmente porque el producto (NO 2) está coloreado, mientras que el reactivo (N 2 O 4) es incoloro:
\[N_2O_4{(g)} colorless \rightleftharpoons 2NO_{2(g)} \; red-brown \tag{15.1.1}\]
La flecha doble indica que tanto las reacciones hacia adelante como las reacciones inversas están ocurriendo simultáneamente; se lee “está en equilibrio con”.
Figura 15.1.1 El N 2 O 4 (g) 2 NO 2 (g) Sistema a Diferentes Temperaturas (izquierda) A temperatura de hielo seco (−78.4°C), el sistema contiene esencialmente N 2 O 4 sólido puro, que es incoloro. (centro) A medida que el sistema se calienta por encima del punto de fusión de N 2 O 4 (−9.3°C), el N 2 O 4 se funde y luego se evapora, y parte del vapor se disocia a rojo-marrón NO 2. (derecha) Finalmente la muestra alcanza temperatura ambiente, y se encuentra presente una mezcla de N 2 O 4 gaseosos y NO 2. La composición de la mezcla y de ahí el color no cambian más con el tiempo: el sistema ha alcanzado el equilibrio a la nueva temperatura.
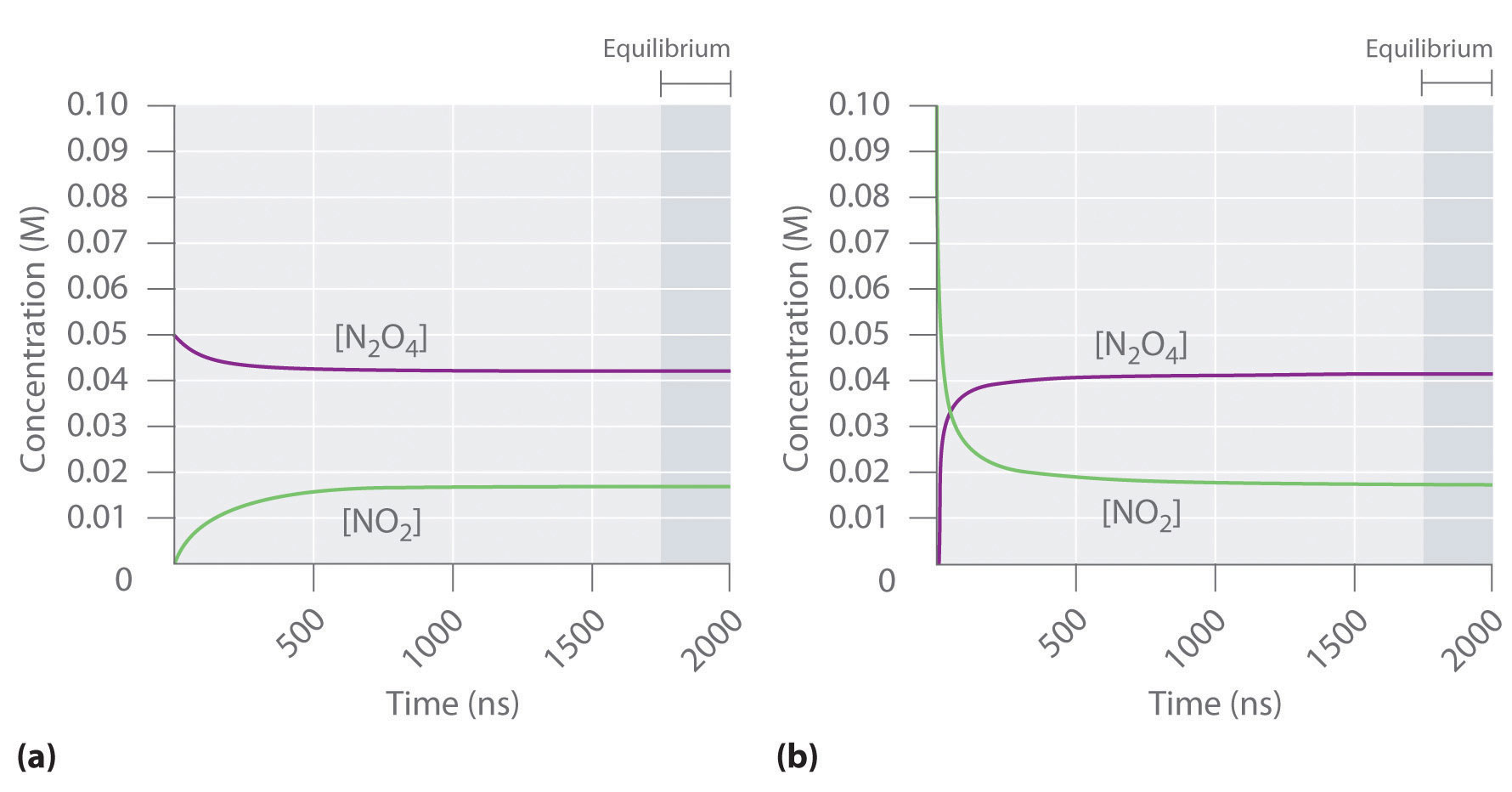
La Figura 15.1.2 muestra cómo variaría la composición de este sistema en función del tiempo a una temperatura constante. Si la concentración inicial de NO 2 fue cero, entonces aumenta a medida que disminuye la concentración de N 2 O 4. Finalmente, la composición del sistema deja de cambiar con el tiempo y se logra el equilibrio químico. Por el contrario, si comenzamos con una muestra que no contiene N 2 O 4 sino una concentración inicial de NO 2 dos veces la concentración inicial de N 2 O 4 en la parte (a) de la Figura 15.1.2, de acuerdo con la estequiometría de la reacción, alcanzamos exactamente la misma composición de equilibrio, como se muestra en la parte (b) en la Figura 15.1.2. Así, el equilibrio puede ser abordado desde cualquier dirección en una reacción química.
Figura 15.1.2 La composición de las mezclas de N 2 O 4 /NO 2 en función del tiempo a temperatura ambiente (a) Inicialmente, este sistema idealizado contiene 0.0500 M N 2 O 4 gaseoso y no gaseoso NO 2. La concentración de N 2 O 4 disminuye con el tiempo a medida que aumenta la concentración de NO 2. (b) Inicialmente, este sistema contiene 0.1000 M NO 2 y no N 2 O 4. La concentración de NO 2 disminuye con el tiempo a medida que aumenta la concentración de N 2 O 4. En ambos casos, las concentraciones finales de las sustancias son las mismas: [N 2 O 4] = 0.0422 M y [NO 2] = 0.0156 M en equilibrio.
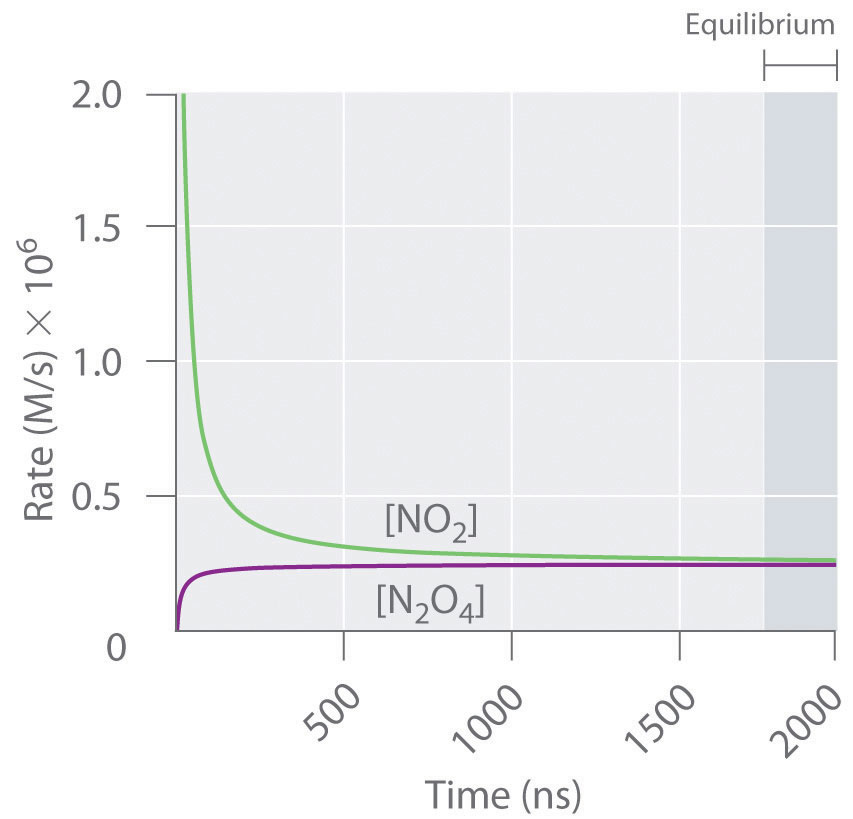
La Figura 15.1.3 muestra las velocidades de reacción directa e inversa para una muestra que inicialmente contiene NO 2 puro. Debido a que la concentración inicial de N 2 O 4 es cero, la velocidad de reacción directa (disociación de N 2 O 4) es inicialmente cero también. En contraste, la velocidad de reacción inversa (dimerización de NO 2) es inicialmente muy alta (2.0 × 10 6 m/s), pero disminuye rápidamente a medida que disminuye la concentración de NO 2. (Recordemos del Capítulo 14 que se espera que la velocidad de reacción de la reacción de dimerización disminuya rápidamente porque la reacción es de segundo orden en NO 2: velocidad = k r [NO 2] 2, donde k r es la velocidad constante para la reacción inversa mostrada en la Ecuación 15.1.1.) A medida que aumenta la concentración de N 2 O 4, la velocidad de disociación de N 2 O 4 aumenta, pero más lentamente que la dimerización de NO 2, porque la reacción es solo de primer orden en N 2 O 4 (velocidad = k f [N 2 O 4], donde k f es la constante de velocidad para la reacción directa en la Ecuación 15.1.1). Finalmente, las velocidades de reacción directa e inversa se vuelven idénticas, k F = k r, y el sistema ha alcanzado el equilibrio químico. Si las reacciones hacia adelante y hacia atrás ocurren a diferentes velocidades, entonces el sistema no está en equilibrio.
Figura 15.1.3 Las velocidades de reacción directa e inversa en función del tiempo para el N 2 O 4 (g) 2 NO 2 (g) Sistema mostrado en la Parte (b) en la Figura 15.1.2
La velocidad de dimerización del NO 2 (reacción inversa) disminuye rápidamente con el tiempo, como se esperaba para una reacción de segundo orden. Debido a que la concentración inicial de N 2 O 4 es cero, la velocidad de la reacción de disociación (reacción directa) a t = 0 también es cero. A medida que avanza la reacción de dimerización, la concentración de N 2 O 4 aumenta, y su velocidad de disociación también aumenta. Finalmente, las tasas de las dos reacciones son iguales: se ha alcanzado el equilibrio químico y las concentraciones de N 2 O 4 y NO 2 ya no cambian.
Tenga en cuenta el patrón
En equilibrio, la velocidad de reacción directa es igual a la velocidad de reacción inversa.
Ejemplo 15.1.1
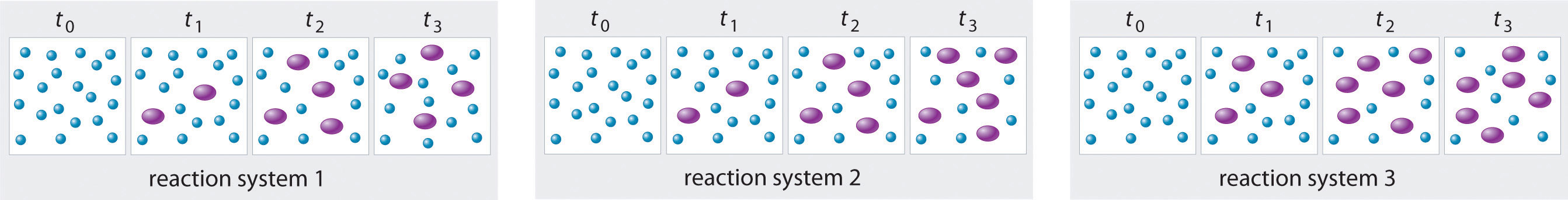
Los tres sistemas de reacción (1, 2 y 3) representados en la ilustración adjunta pueden describirse mediante la ecuación <math display="inline” xml:id="av_1.0-15_m004"> <semantics><mrow><mn>2</mn> <mtext><mo>A</mo></mtext> <mtext>B,</mtext></mrow></semantics> </math > donde los círculos azules son A y los óvalos morados son B. Cada conjunto de paneles muestra la composición cambiante de una de las tres mezclas de reacción en función del tiempo. ¿Qué sistema tardó más en alcanzar el equilibrio químico?
Dado: tres sistemas de reacción
Preguntado por: tiempo relativo para alcanzar el equilibrio químico
Estrategia:
Comparar las concentraciones de A y B en diferentes momentos. El sistema cuya composición tarda más en estabilizarse tardó más en alcanzar el equilibrio químico.
Solución:
En los sistemas 1 y 3, la concentración de A disminuye de t 0 a t 2 pero es la misma tanto en t 2 como en t 3. Así, los sistemas 1 y 3 están en equilibrio por t 3. En el sistema 2, las concentraciones de A y B siguen cambiando entre t 2 y t 3, por lo que es posible que el sistema 2 aún no haya alcanzado el equilibrio en t 3. Así, el sistema 2 tardó más en alcanzar el equilibrio químico.
Ejercicio
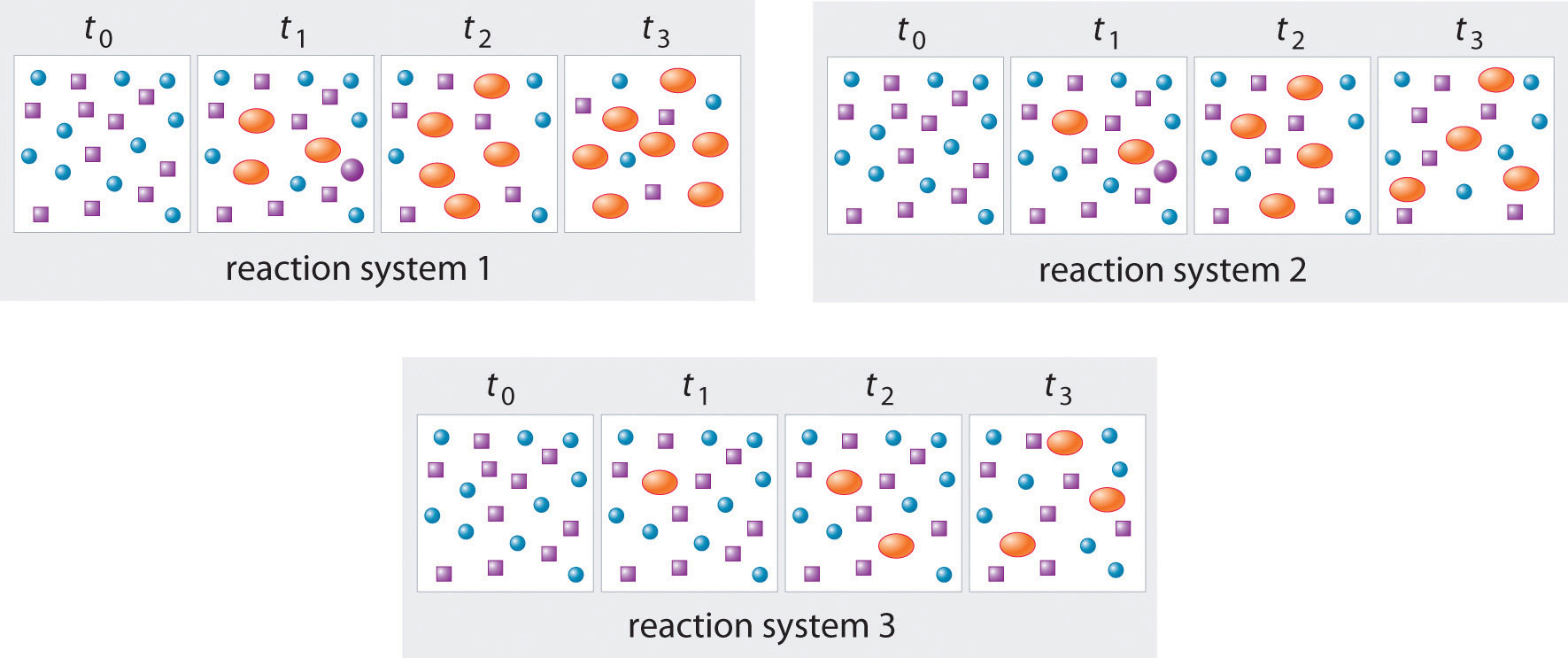
En la siguiente ilustración, A está representada por círculos azules, B por cuadrados morados y C por óvalos anaranjados; la ecuación para la reacción es A + B C. Los conjuntos de paneles representan las composiciones de tres mezclas de reacción en función del tiempo. ¿Cuál, en su caso, de los sistemas mostrados ha alcanzado el equilibrio?
Respuesta: system 2
Resumen
El equilibrio químico es un proceso dinámico que consiste en reacciones hacia adelante y hacia atrás que proceden a tasas iguales. En equilibrio, la composición del sistema ya no cambia con el tiempo. La composición de una mezcla de equilibrio es independiente de la dirección desde la que se aproxima el equilibrio.
Llave para llevar
- En equilibrio, las reacciones hacia adelante y hacia atrás de un sistema proceden a tasas iguales.
Problemas conceptuales
-
¿Qué se entiende cuando una reacción se describe como “haber alcanzado el equilibrio”? ¿Qué significa esta afirmación con respecto a las velocidades de reacción hacia adelante y hacia atrás? ¿Qué significa esta afirmación con respecto a las concentraciones o cantidades de los reactivos y los productos?
-
¿Es correcto decir que la reacción se ha “detenido” cuando ha alcanzado el equilibrio? Explica tu respuesta y apóyala con un ejemplo específico.
-
¿Por qué se describe el equilibrio químico como un proceso dinámico? Describir este proceso en el contexto de una solución saturada de NaCl en agua. ¿Qué ocurre a nivel microscópico? ¿Qué está pasando a nivel macroscópico?
-
¿Cuál de estos sistemas existe en estado de equilibrio químico?
- oxígeno y hemoglobina en el sistema circulatorio humano
- cristales de yodo en un vaso de precipitados abierto
- la combustión de la madera
- la cantidad de 14 C en un organismo en descomposición
Contestar
-
Se producen reacciones tanto hacia adelante como hacia atrás pero a la misma velocidad. Los iones Na + y Cl − dejan continuamente la superficie de un cristal de NaCl para entrar en solución, mientras que al mismo tiempo los iones Na + y Cl − en solución precipitan sobre la superficie del cristal.