15.2: La constante de equilibrio
- Page ID
- 77959
- Conocer la relación entre la constante de equilibrio y las constantes de velocidad para las reacciones hacia adelante y hacia atrás.
- Escribir una expresión constante de equilibrio para cualquier reacción.
Debido a que se logra un estado de equilibrio cuando la velocidad de reacción directa es igual a la velocidad de reacción inversa, bajo un conjunto dado de condiciones debe haber una relación entre la composición del sistema en equilibrio y la cinética de una reacción (representada por constantes de velocidad). Podemos mostrar esta relación utilizando el sistema descrito en la Ecuación 15.2.1, la descomposición de N 2 O 4 a NO 2. Tanto la reacción directa como la inversa para este sistema consisten en una única reacción elemental, por lo que las velocidades de reacción son las siguientes:
\[\text{forward rate} = k_f[N_2O_4] \tag{15.2.1}\]
y
\[\text{reverse rate} = k_r[NO_2]^2 \tag{15.2.2}\]
En equilibrio, la tasa de avance es igual a la tasa inversa:
\[ k_f[N_2O_4] = k_r[NO_2]^2 \tag{15.2.3}\]
entonces
\[\dfrac{k_f}{k_r}=\dfrac{[NO_2]^2}{[N_2O_4]} \tag{15.2.4}\]
La relación de las constantes de velocidad nos da una nueva constante, la constante de equilibrio (K) La relación de las constantes de velocidad para la reacción directa y la reacción inversa; es decir, K =k f /k r También es la constante de equilibrio calculada a partir de solución concentraciones: K = [C] c [D] d/[A] a [B] b para la reacción general a A + bB cc +dD en la que cada componente está en solución. que se define de la siguiente manera:
\[K=\dfrac{k_f}{k_r} \tag{15.2.5}\]
De ahí que exista una relación fundamental entre la cinética química y el equilibrio químico: bajo un conjunto dado de condiciones, la composición de la mezcla de equilibrio está determinada por las magnitudes de las constantes de velocidad para las reacciones directa e inversa.
Tenga en cuenta el patrón
La constante de equilibrio es igual a la constante de velocidad para la reacción directa dividida por la constante de velocidad para la reacción inversa.
En el Cuadro 15.2.1 se enumeran las concentraciones iniciales y de equilibrio de cinco experimentos diferentes utilizando el sistema de reacción descrito por la Ecuación 15.1.1. En equilibrio la magnitud de la cantidad [NO 2] 2/[N 2 O 4] es esencialmente la misma para los cinco experimentos. De hecho, no importa cuáles sean las concentraciones iniciales de NO 2 y N 2 O 4, en equilibrio la cantidad [NO 2] 2/[N 2 O 4] siempre será de 6.53 ± 0.03 × 10 −3 a 25°C, lo que corresponde a la relación de las constantes de velocidad para las reacciones hacia adelante y hacia atrás. Es decir, a una temperatura dada, la constante de equilibrio para una reacción siempre tiene el mismo valor, aunque las concentraciones específicas de los reactivos y productos varían dependiendo de sus concentraciones iniciales.
Cuadro 15.2.1 Concentraciones iniciales y de equilibrio para\(NO_2:N_2O_4\) mezclas a 25°C
| Concentraciones Iniciales | Concentraciones en Equilibrio | ||||
|---|---|---|---|---|---|
| Experimento | [N 2 O 4] (M) | [NO 2] (M) | [N 2 O 4] (M) | [NO 2] (M) | K = [NO 2] 2/[N 2 O 4] |
| 1 | 0.0500 | 0.0000 | 0.0417 | 0.0165 | 6.54 × 10 −3 |
| 2 | 0.0000 | 0.1000 | 0.0417 | 0.0165 | 6.54 × 10 −3 |
| 3 | 0.0750 | 0.0000 | 0.0647 | 0.0206 | 6.56 × 10 −3 |
| 4 | 0.0000 | 0.0750 | 0.0304 | 0.0141 | 6.54 × 10 −3 |
| 5 | 0.0250 | 0.0750 | 0.0532 | 0.0186 | 6.50 × 10 −3 |
Desarrollo de una Expresión Constante de Equilibrio
En 1864, los químicos noruegos Cato Guldberg (1836—1902) y Peter Waage (1833—1900) midieron cuidadosamente las composiciones de muchos sistemas de reacción en equilibrio. Descubrieron que para cualquier reacción reversible de la forma general
\[aA+bB \rightleftharpoons cC+dD \tag{15.2.6}\]
donde A y B son reactivos, C y D son productos, y a, b, c y d son los coeficientes estequiométricos en la ecuación química equilibrada para la reacción, la relación del producto de las concentraciones de equilibrio de los productos (elevadas a su coeficientes en la ecuación química equilibrada) al producto de las concentraciones de equilibrio de los reactivos (elevadas a sus coeficientes en la ecuación química equilibrada) es siempre una constante bajo un conjunto dado de condiciones. Esta relación se conoce como la ley de acción de masas Para la ecuación química equilibrada general AA+bB = cC+ dD la expresión de la constante de equilibrio es K = [C] c [D] d/[A] a [B] b y se puede afirmar de la siguiente manera:
\[K=\dfrac{[C]^c[D]^d}{[A]^a[B]^b} \tag{15.2.7}\]
donde K es la constante de equilibrio para la reacción. La ecuación 15.7 se llama la ecuación de equilibrio Para la ecuación química equilibrada general AA+bB = cC+ dD la expresión de la constante de equilibrio es K = [C] c [D] d/[A] a [B] b, y el lado derecho de la Ecuación 15.2.7 se llama la expresión constante de equilibrio. La relación mostrada en la Ecuación 15.2.7 es cierta para cualquier par de reacciones opuestas independientemente del mecanismo de la reacción o el número de pasos en el mecanismo.
La constante de equilibrio puede variar en un amplio rango de valores. Los valores de K mostrados en el Cuadro 15.2.2, por ejemplo, varían en 60 órdenes de magnitud. Debido a que los productos están en el numerador de la expresión constante de equilibrio y los reactivos están en el denominador, valores de K mayores a 10 3 indican una fuerte tendencia para que los reactivos formen productos. En este caso, los químicos dicen que el equilibrio se encuentra a la derecha tal como está escrito, favoreciendo la formación de productos. Un ejemplo es la reacción entre H 2 y Cl 2 para producir HCl, que tiene una constante de equilibrio de 1.6 × 10 33 a 300 K. Debido a que H 2 es un buen reductor y Cl 2 es un buen oxidante, la reacción procede esencialmente hasta su finalización. En contraste, los valores de K menores de 10 −3 indican que la relación de productos a reactivos en equilibrio es muy pequeña. Es decir, los reactivos no tienden a formar productos fácilmente, y el equilibrio se encuentra a la izquierda tal como está escrito, favoreciendo la formación de reactivos.
Tabla 15.2.2 Constantes de equilibrio para reacciones seleccionadas*
| Reacción | Temperatura (K) | Constante de Equilibrio (K) |
|---|---|---|
| \(S_{(s)}+O_{2(g)} \rightleftharpoons SO_{2(g)}\) | 300 | 4.4 × 10 53 |
| \(2H_{2(g)}+O_{2(g)} \rightleftharpoons 2H2O_{(g)}\) | 500 | 2.4 × 10 47 |
| \(H_{2(g)}+Cl_{2(g)} \rightleftharpoons 2HCl_{(g)}\) | 300 | 1.6 × 10 33 |
| \(H_{2(g)}+Br_{2(g)} \rightleftharpoons 2HBr_{(g)}\) | 300 | 4.1 × 10 18 |
| \(2NO_{(g)}+O_{2(g)} \rightleftharpoons 2NO_{2(g)}\) | 300 | 4.2 × 10 13 |
| \(3H_{2(g)}+N_{2(g)} \rightleftharpoons 2NH_{3(g)}\) | 300 | 2.7 × 10 8 |
| \(H_{2(g)}+D_{2(g)} \rightleftharpoons 2HD_{(g)}\) | 100 | 1.92 |
| \(H_{2(g)}+I_{2(g)} \rightleftharpoons 2HI_{(g)}\) | 300 | 2.9 × 10 −1 |
| \(I_{2(g)} \rightleftharpoons 2I_{(g)}\) | 800 | 4.6 × 10 −7 |
| \(Br_{2(g)} \rightleftharpoons 2Br_{(g)}\) | 1000 | 4.0 × 10 −7 |
| \(Cl_{2(g)} \rightleftharpoons 2Cl_{(g)}\) | 1000 | 1.8 × 10 −9 |
| \(F_{2(g)} \rightleftharpoons 2F_{(g)}\) | 500 | 7.4 × 10 −13 |
| *Las constantes de equilibrio varían con la temperatura. Los valores de K mostrados son para sistemas a las temperaturas indicadas. | ||
También notará en la Tabla 15.2.2 que las constantes de equilibrio no tienen unidades, aunque la Ecuación 15.2.7 sugiere que las unidades de concentración podrían no siempre cancelarse porque los exponentes pueden variar. De hecho, las constantes de equilibrio se calculan utilizando “concentraciones efectivas”, o actividades, de reactivos y productos, que son las relaciones de las concentraciones medidas a un estado estándar de 1 M. Como se muestra en la Ecuación 15.2.8, las unidades de concentración cancelan, lo que hace que K sin unidades también:
\[ \dfrac{[A]_{measured}}{[A]_{standard\; state}}=\dfrac{\cancel{M}}{\cancel{M}} = \dfrac{\cancel{\frac{mol}{L}}}{\cancel{\frac{mol}{L}}} \tag{15.2.8}\]
Muchas reacciones tienen constantes de equilibrio entre 1000 y 0.001 (10 3 ≥ K ≥ 10 −3), ni muy grandes ni muy pequeñas. En equilibrio, estos sistemas tienden a contener cantidades significativas tanto de productos como de reactivos, lo que indica que no hay una fuerte tendencia a formar productos a partir de reactivos o reactivos a partir de productos. Un ejemplo de este tipo de sistemas es la reacción del hidrógeno gaseoso y el deuterio, componente de las fuentes de luz de fibra óptica de alta estabilidad utilizadas en estudios oceánicos, para formar HD:
\[H_{2(g)}+D_{2(g)} \rightleftharpoons 2HD_{(g)} \tag{15.10}\]
La expresión constante de equilibrio para esta reacción es
\[K= \dfrac{[HD]^2}{[H_2][D_2]}\]
con K variando entre 1.9 y 4 en un amplio rango de temperatura (100—1000 K). Así, una mezcla de equilibrio de H 2, D 2 y HD contiene concentraciones significativas tanto de producto como de reactivos.
La Figura 15.2.1 resume la relación entre la magnitud de K y las concentraciones relativas de reactivos y productos en equilibrio para una reacción general, escrita como reactivos productos Porque existe una relación directa entre la cinética de una reacción y las concentraciones de equilibrio de productos y reactivos (Ecuación 15.2.8 y Ecuación 15.2.7), cuando k f >> k r, K es un número grande, y predomina la concentración de productos en equilibrio. Esto corresponde a una reacción esencialmente irreversible. Por el contrario, cuando k f << k r, K es un número muy pequeño, y la reacción casi no produce productos como está escrito. Sistemas para los cuales k f ≈ k r tienen concentraciones significativas tanto de reactivos como de productos en equilibrio.
Figura 15.2.1 La relación entre la composición de la mezcla en equilibrio y la magnitud de la constante de equilibrio Cuanto mayor sea la K, más lejos avanza la reacción hacia la derecha antes de alcanzar el equilibrio, y mayor es la relación de productos a reactivos en equilibrio.
Tenga en cuenta el patrón
Un gran valor de la constante de equilibrio K significa que los productos predominan en el equilibrio; un valor pequeño significa que los reactivos predominan en el equilibrio.
Ejemplo 15.2.1
Escriba la expresión constante de equilibrio para cada reacción.
- \(N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)}\)
- \(CO_{(g)}+\frac{1}{2}O_{2(g)} \rightleftharpoons CO_{2(g)}\)
- \(2CO_{2(g)} \rightleftharpoons 2CO_{(g)}+O_{2(g)}\)
Dado: ecuaciones químicas balanceadas
Preguntado por: expresiones constantes de equilibrio
Estrategia:
Consulte la Ecuación 15.2.7. Colocar el producto aritmético de las concentraciones de los productos (elevadas a sus coeficientes estequiométricos) en el numerador y el producto de las concentraciones de los reactivos (elevadas a sus coeficientes estequiométricos) en el denominador.
Solución:
- El único producto es el amoníaco, que tiene un coeficiente de 2. Para los reactivos, N 2 tiene un coeficiente de 1 y H 2 tiene un coeficiente de 3. La expresión constante de equilibrio es la siguiente: \[\dfrac{[NH_3]^2}{[N_2][H_2]^3} \notag \]
- El único producto es el dióxido de carbono, el cual tiene un coeficiente de 1. Los reactivos son CO, con un coeficiente de 1, y O 2, con un coeficiente de 1/2 Así la expresión de la constante de equilibrio es la siguiente: \[\dfrac{[CO_2]}{[CO][O_2]^{1/2}} \notag \]
- Esta reacción es la inversa de la reacción en la parte b, con todos los coeficientes multiplicados por 2 para eliminar el coeficiente fraccionario para O 2. La expresión constante de equilibrio es, por lo tanto, la inversa de la expresión en la parte b, con todos los exponentes multiplicados por 2: \[\dfrac{[CO]^2[O_2]}{[CO_2]^2} \notag \]
Ejercicio
Escriba la expresión constante de equilibrio para cada reacción.
- \(N_2O_{(g)} \rightleftharpoons N_{2(g)}+\frac{1}{2}O_{2(g)}\)
- \(2C_8H_{18(g)}+25O_{2(g)} \rightleftharpoons 16CO_{2(g)}+18H_2O_{(g)}\)
- \(H_{2(g)}+I_{2(g)} \rightleftharpoons 2HI_{(g)}\)
Contestar
- \(K=\dfrac{[N_2][O_2]^{1/2}}{[N_2O]}\)
- \(K=\dfrac{[CO_2]^{16}[H_2O]^{18}}{[C_8H_{18}]^2[O_2]^{25}}\)
- \(K=\dfrac{[HI]^2}{[H_2][I_2]}\)
Ejemplo 15.2.2
Predecir qué sistemas en equilibrio (a) contendrán esencialmente solo productos, (b) contendrán esencialmente solo reactivos y (c) contendrán cantidades apreciables tanto de productos como de reactivos.
- \(H_{2(g)}+I_{2(g)} \rightleftharpoons 2HI_{(g)}\;\;\; K_{(700K)}=54\)
- \(2CO_{2(g)} \rightleftharpoons 2CO_{(g)}+O_{2(g)}\;\;\; K_{(1200K)}=3.1 \times 10^{−18}\)
- \(PCl_{5(g)} \rightleftharpoons PCl_{3(g)}+Cl_{2(g)}\;\;\; K_{(613K)}=97\)
- \(2O_{3(g)} \rightleftharpoons 3O_{2(g)} \;\;\; K_{(298 K)}=5.9 \times 10^{55}\)
Dado: sistemas y valores de K
Preguntado por: composición de sistemas en equilibrio
Estrategia:
Utilice el valor de la constante de equilibrio para determinar si la mezcla de equilibrio contendrá esencialmente solo productos, esencialmente solo reactivos, o cantidades significativas de ambos.
Solución:
- Solo el sistema 4 tiene K >> 10 3, por lo que en equilibrio consistirá esencialmente en solo productos.
- El sistema 2 tiene K << 10 −3, por lo que los reactivos tienen poca tendencia a formar productos en las condiciones especificadas; así, en equilibrio el sistema contendrá esencialmente solo reactivos.
- Ambos sistemas 1 y 3 tienen constantes de equilibrio en el rango 10 3 ≥ K ≥ 10 −3, lo que indica que las mezclas de equilibrio contendrán cantidades apreciables tanto de productos como de reactivos.
Ejercicio
El hidrógeno y el nitrógeno reaccionan para formar amoníaco de acuerdo con la siguiente ecuación química equilibrada:
\[3H_{2(g)}+N_{2(g)} \rightleftharpoons 2NH_{3(g)} \notag \]
Los valores de la constante de equilibrio a diversas temperaturas se reportaron como K 25°C = 3.3 × 10 8, K 177°C = 2.6 × 10 3, y K 327°C = 4.1.
- ¿A qué temperatura esperarías encontrar la mayor proporción de H 2 y N 2 en la mezcla de equilibrio?
- Suponiendo que las velocidades de reacción son lo suficientemente rápidas para que se alcance el equilibrio rápidamente, ¿a qué temperatura diseñaría un reactor comercial para operar para maximizar el rendimiento del amoníaco?
Contestar
- 327°C, donde K es el más pequeño
- 25°C
Variaciones en la forma de la expresión constante de equilibrio
Debido a que el equilibrio puede ser abordado desde cualquier dirección en una reacción química, la expresión constante de equilibrio y por lo tanto la magnitud de la constante de equilibrio dependen de la forma en que se escribe la reacción química. Por ejemplo, si escribimos la reacción descrita en la Ecuación 15.7 a la inversa, obtenemos lo siguiente:
\[cC+dD \rightleftharpoons aA+bB \tag{15.2.10}\]
La constante de equilibrio correspondiente\(K′\) es la siguiente:
\[K'=\dfrac{[A]^a[B]^b}{[C]^c[D]^d} \tag{15.2.11}\]
Esta expresión es la inversa de la expresión para la constante de equilibrio original, por lo que K ′ = 1/ K. Es decir, cuando escribimos una reacción en la dirección inversa, se invierte la expresión de la constante de equilibrio. Por ejemplo, la constante de equilibrio para la reacción N 2 O 4 2NO 2 es la siguiente:
\[K=\dfrac{[NO_2]^2}{[N_2O_4]} \tag{15.2.12}\]
pero para la reacción opuesta, 2NO 2 N 2 O 4 la constante de equilibrio K′ viene dada por la expresión inversa:
\[K'=\dfrac{[N_2O_4]}{[NO_2]^2} \tag{15.2.13}\]
Consideremos otro ejemplo, la formación de agua: 2H 2 (g) + O 2 (g) 2H 2 O (g) Debido a que H 2 es un buen reductor y O 2 es un buen oxidante, esta reacción tiene una constante de equilibrio muy grande (K = 2.4 × 10 47 a 500 K). En consecuencia, la constante de equilibrio para la reacción inversa, la descomposición del agua para formar O 2 y H 2, es muy pequeña: K ′ = 1/ K = 1/ (2.4 × 10 47) = 4.2 × 10 −48. Como sugiere la muy pequeña constante de equilibrio, y afortunadamente para la vida tal como la conocemos, de hecho se necesita una cantidad sustancial de energía para disociar el agua en H 2 y O 2.
Tenga en cuenta el patrón
La constante de equilibrio para una reacción escrita a la inversa es la inversa de la constante de equilibrio para la reacción tal como se escribió originalmente.
Escribir una ecuación en formas diferentes pero químicamente equivalentes también hace que tanto la expresión constante de equilibrio como la magnitud de la constante de equilibrio sean diferentes. Por ejemplo, podríamos escribir la ecuación para la reacción
\[2NO_2 \rightleftharpoons N_2O_4\]
como
\[NO_2 \rightleftharpoons \frac{1}{2}N_2O_4\]
con la constante de equilibrio K ″ es como sigue:
\[ K′′=\dfrac{[N_2O_4]^{1/2}}{[NO_2]} \tag{15.2.14}\]
Los valores para K ′ (Ecuación 15.2.13) y K ″ se relacionan de la siguiente manera:
\[ K′′=(K')^{1/2}=\sqrt{K'} \tag{15.2.15}\]
En general, si todos los coeficientes en una ecuación química equilibrada se multiplican posteriormente por n, entonces la nueva constante de equilibrio es la constante de equilibrio original elevada a la n-ésima potencia.
Ejemplo 15.2.3
A 745 K, K es 0.118 para la siguiente reacción:
\[N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)} \notag \]
¿Cuál es la constante de equilibrio para cada reacción relacionada a 745 K?
- \(2NH_{3(g)} \rightleftharpoons N2(g)+3H_{2(g)}\)
- \(\frac{1}{2}N_{2(g)}+\frac{3}{2}H_{2(g)} \rightleftharpoons NH_{3(g)}\)
Dado: ecuación de equilibrio equilibrado, K a una temperatura dada, y ecuaciones de reacciones relacionadas
Preguntado por: valores de K para reacciones relacionadas
Estrategia:
Escriba la expresión constante de equilibrio para la reacción dada y para cada reacción relacionada. A partir de estas expresiones, calcula K para cada reacción.
Solución:
La expresión constante de equilibrio para la reacción dada de N2 (g) con H2 (g) para producir NH 3 (g) a 745 K es la siguiente:
\[K=\dfrac{[NH_3]^2}{[N_2][H_2]^3}=0.118 \notag \]
- Esta reacción es la inversa de la dada, por lo que su expresión constante de equilibrio es la siguiente: \[K'=\dfrac{1}{K}=\dfrac{[N_2][H_2]^3}{[NH_3]^2}=\dfrac{1}{0.118}=8.47 \notag \]
- En esta reacción, los coeficientes estequiométricos de la reacción dada se dividen por 2, por lo que la constante de equilibrio se calcula de la siguiente manera: \[K′′=\dfrac{[NH_3]}{[N_2]^{1/2}[H_2]^{3/2}}=K^{1/2}=\sqrt{K}=\sqrt{0.118} = 0.344 \notag \]
Ejercicio
A 527°C, la constante de equilibrio para la reacción
\[2SO_{2(g)}+O_{2(g)} \rightleftharpoons 2SO_{3(g)} \notag \]
es 7.9 × 10 4. Calcular la constante de equilibrio para la siguiente reacción a la misma temperatura:
\[SO_{3(g)} \rightleftharpoons SO_{2(g)}+\frac{1}{2}O_{2(g) \notag \]
Respuesta: 3.6 × 10 −3
Expresiones constantes de equilibrio para sistemas que contienen gases
Para las reacciones que involucran especies en solución, las concentraciones utilizadas en los cálculos de equilibrio generalmente se expresan en moles/litro. Para los gases, sin embargo, las concentraciones generalmente se expresan en términos de presiones parciales en lugar de molaridad, donde el estado estándar es de 1 atm de presión. El símbolo K p Una constante de equilibrio expresada como la relación de las presiones parciales de los productos y reactivos, cada uno elevado a su coeficiente en la ecuación química. se utiliza para denotar constantes de equilibrio calculadas a partir de presiones parciales. Para la reacción general aA + bB cC + dD en la que todos los componentes son gases, podemos escribir la expresión constante de equilibrio como la relación de las presiones parciales de los productos y reactivos (cada uno elevado a su coeficiente en la ecuación química):
\[K_p=\dfrac{(P_C)^c(P_D)^d}{(P_A)^a(P_B)^b} \tag{15.2.16}\]
Así K p para la descomposición de N 2 O 4 (Ecuación 15.1.1) es como sigue:
\[K_p=\dfrac{(P_{NO_2})^2}{P_{N_2O_4}} \tag{15.2.17}\]
Al igual que K, K p es una cantidad sin unidades porque la cantidad que realmente se usa para calcularla es una “presión efectiva”, la relación de la presión medida a un estado estándar de 1 bar (aproximadamente 1 atm), lo que produce una cantidad sin unidades. A la “presión efectiva” se le llama fugacidad, así como la actividad es la concentración efectiva.
Debido a que las presiones parciales suelen expresarse en atmósferas o mmHg, la concentración molar de un gas y su presión parcial no tienen el mismo valor numérico. En consecuencia, los valores numéricos de K y K p suelen ser diferentes. Sin embargo, están relacionados por la constante de gas ideal (R) y la temperatura (T):
\[K_p = K(RT)^{Δn} \tag{15.2.18}\]
donde K es la constante de equilibrio expresada en unidades de concentración y Δ n es la diferencia entre los números de moles de productos gaseosos y reactivos gaseosos (n p − n r). La temperatura se expresa como la temperatura absoluta en kelvin. De acuerdo con la Ecuación 15.19, K p = K sólo si los moles de productos gaseosos y reactivos gaseosos son los mismos (es decir, Δ n = 0). Para la descomposición de N 2 O 4, hay 2 mol de producto gaseoso y 1 mol de reactivo gaseoso, por lo que Δ n = 1. Así, para esta reacción, K p = K (RT) 1 = KRT.
Ejemplo 15.2.4
La constante de equilibrio para la reacción de nitrógeno e hidrógeno para dar amoníaco es de 0.118 a 745 K. La ecuación de equilibrio equilibrado es la siguiente:
\[N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)} \notag \]
¿Qué es K p para esta reacción a la misma temperatura?
Dado: ecuación de equilibrio, constante de equilibrio y temperatura
Preguntado por: K p
Estrategia:
Utilice los coeficientes en la ecuación química balanceada para calcular Δ n. Después usa la Ecuación 15.19 para calcular K a partir de K p.
Solución:
Esta reacción tiene 2 moles de producto gaseoso y 4 moles de reactivos gaseosos, por lo que Δ n = (2 − 4) = −2. Conocemos K, y T = 745 K. Así, a partir de la Ecuación 15.2.15, tenemos lo siguiente:
\[K_p=K(RT)^{−2}=\dfrac{K}{(RT)^2}=\dfrac{0.118}{\{ [0.08206(L \cdot atm)/(mol \cdot K)][745\; K]\}^2}=3.16 \times 10^{−5} \notag \]
Debido a que K p es una cantidad sin unidades, la respuesta es K p = 3.16 × 10 −5.
Ejercicio
Calcular K p para la reacción
\[2SO_{2(g)}+O_{2(g)} \rightleftharpoons 2SO_{3(g)} \notag \]
a 527°C, si K = 7.9 × 10 4 a esta temperatura.
Respuesta: K p = 1.2 × 10 3
Equilibrios homogéneos y heterogéneos
Cuando los productos y reactivos de una reacción de equilibrio forman una sola fase, ya sea gaseosa o líquida, el sistema es un equilibrio homogéneo Un equilibrio en el que los reactivos y productos de una reacción de equilibrio forman una sola fase, ya sea gas o líquido. . En tales situaciones, las concentraciones de los reactivos y productos pueden variar en un amplio rango. En contraste, un sistema cuyos reactivos, productos, o ambos se encuentran en más de una fase es un equilibrio heterogéneo Un equilibrio en el que los reactivos de una reacción de equilibrio, los productos, o ambos están en más de una fase. , como la reacción de un gas con un sólido o líquido.
Debido a que las concentraciones molares de líquidos puros y sólidos normalmente no varían mucho con la temperatura, sus concentraciones se tratan como constantes, lo que nos permite simplificar expresiones constantes de equilibrio que involucran sólidos o líquidos puros. Los estados de referencia para sólidos y líquidos puros son aquellas formas estables a 1 bar (aproximadamente 1 atm), a las que se les asigna una actividad de 1. (Recordemos del Capítulo 11, por ejemplo, que la densidad del agua, y por lo tanto su volumen, cambia solo en unos pocos puntos porcentuales entre 0°C y 100°C.)
Considere la siguiente reacción, la cual se utiliza en la cocción final de algunos tipos de cerámica para producir esmaltes metálicos brillantes:
\[CO_{2(g)}+C_{(s)} \rightleftharpoons 2CO_{(g)} \tag{15.2.19}\]
El esmalte se crea cuando los óxidos metálicos son reducidos a metales por el producto, el monóxido de carbono. La expresión constante de equilibrio para esta reacción es la siguiente:
\[K=\dfrac{[CO]^2}{[CO_2][C]} \tag{15.2.20}\]
Debido a que el grafito es un sólido, sin embargo, su concentración molar, determinada a partir de su densidad y masa molar, es esencialmente constante y tiene el siguiente valor:
\[ [C] =\dfrac{2.26 \cancel{g}/{\cancel{cm^3}}}{12.01\; \cancel{g}/mol} \times 1000 \; \cancel{cm^3}/L = 188 \; mol/L = 188\;M \tag{15.2.21}\]
Podemos reorganizar la Ecuación 15.2.17 para que los términos constantes estén en un lado:
\[ K[C]=K(188)=\dfrac{[CO]^2}{[CO_2]} \tag{15.2.22}\]
Incorporar el valor constante de [C] en la ecuación de equilibrio para la reacción en la Ecuación 15.2.16,
\[K'=\dfrac{[CO]^2}{[CO_2]} \tag{15.2.23}\]
La constante de equilibrio para esta reacción también se puede escribir en términos de las presiones parciales de los gases:
\[K_p=\dfrac{(P_{CO})^2}{P_{CO_2}} \tag{15.2.24}\]
Incorporar todos los valores constantes en K ′ o K p nos permite enfocarnos en las sustancias cuyas concentraciones cambian durante la reacción.
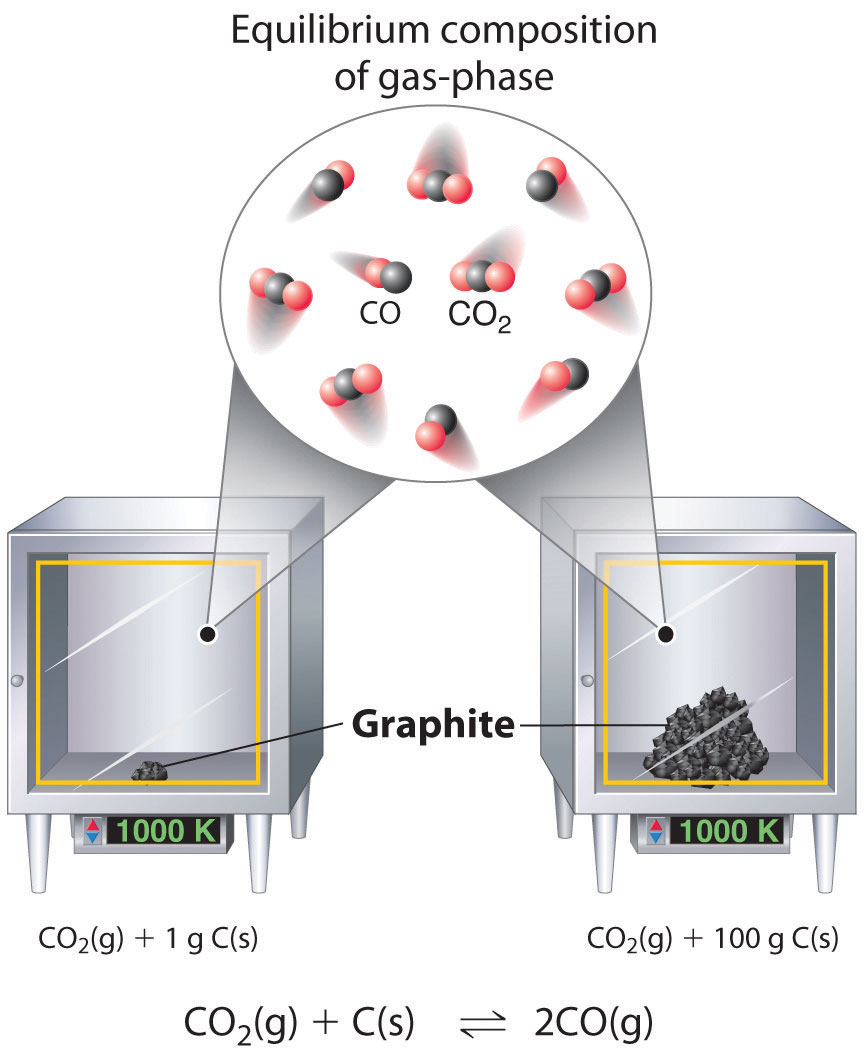
Aunque las concentraciones de líquidos puros o sólidos no están escritas explícitamente en la expresión constante de equilibrio, estas sustancias deben estar presentes en la mezcla de reacción para que ocurra el equilibrio químico. Cualesquiera que sean las concentraciones de CO y CO 2, el sistema descrito en la Ecuación 15.2.16 alcanzará el equilibrio químico solo si se ha agregado una cantidad estequiométrica de carbono sólido o exceso de carbono sólido para que algunos aún estén presentes una vez que el sistema haya alcanzado el equilibrio. Como se muestra en la Figura 15.2.2, no importa si está presente 1 g o 100 g de carbono sólido; en cualquier caso, la composición de los componentes gaseosos del sistema será la misma en equilibrio.
Figura 15.2.2 Efecto de la Cantidad de Sólido Presente sobre el Equilibrio en un Sistema Sólido-Gas Heterogéneo En el sistema, la composición de equilibrio de la fase gaseosa a una temperatura dada, 1000 K en este caso, es la misma ya sea una pequeña cantidad de carbono sólido (izquierda) o una cantidad grande ( derecha) está presente.
Ejemplo 15.2.5
Escriba cada expresión para K, incorporando todas las constantes, y K p para las siguientes reacciones de equilibrio.
- \(PCl_{3(l)}+Cl_{2(g)} \rightleftharpoons PCl_{5(s)}\)
- \(Fe_3O_{4(s)}+4H_{2(g)} \rightleftharpoons 3Fe_{(s)}+4H_2O_{(g)}\)
Dado: ecuaciones de equilibrio equilibrado
Preguntado por: expresiones para K y K p
Estrategia:
Encuentra K escribiendo cada expresión constante de equilibrio como la relación de las concentraciones de los productos y reactivos, cada uno elevado a su coeficiente en la ecuación química. Entonces expresar K p como la relación de las presiones parciales de los productos y reactivos, cada uno también elevado a su coeficiente en la ecuación química.
Solución:
- Esta reacción contiene un sólido puro (PCl 5) y un líquido puro (PCl 3). Sus concentraciones no aparecen en la expresión constante de equilibrio porque no cambian significativamente. Entonces
\[K=\dfrac{1}{[Cl_2]} \notag \]
y
\[K_p=\dfrac{1}{P_{Cl_2}} \notag \]
- Esta reacción contiene dos sólidos puros (Fe 3 O 4 y Fe), que no aparecen en las expresiones constantes de equilibrio. Los dos gases sí aparecen, sin embargo, en las expresiones: \[K=\dfrac{[H_2O]^4}{[H_2]^4} \notag \]
Ejercicio
Escribe las expresiones para K y K p para las siguientes reacciones.
- \(CaCO_{3(s)} \rightleftharpoons CaO_{(s)}+CO_{2(g)}\)
- \( \underset{glucose}{C_6H_{12}O_{6(s)}} + 6O_{2(g)} \rightleftharpoons 6CO_{2(g)}+6H_2O_{(g)}\)
Contestar
- K = [CO 2]; y Kp = P (CO 2)
- \(K=\dfrac{[CO_2]^6[H_2O]^6}{[O_2]^6}\)y\(K_p=\dfrac{(P_{CO_2})^6(P_{H_2O})^6}{(P_{O_2})^6}\)
Para las reacciones realizadas en solución, la concentración del disolvente se omite de la expresión constante de equilibrio incluso cuando el disolvente aparece en la ecuación química equilibrada para la reacción. La concentración del disolvente también es típicamente mucho mayor que la concentración de los reactivos o productos (recuerde que el agua pura es aproximadamente 55.5 M, y el etanol puro es aproximadamente 17 M). En consecuencia, la concentración de disolvente es esencialmente constante durante las reacciones químicas y, por lo tanto, el disolvente se trata como un líquido puro. La expresión constante de equilibrio para una reacción contiene solo aquellas especies cuyas concentraciones podrían cambiar significativamente durante la reacción.
Tenga en cuenta el patrón
Las concentraciones de sólidos puros, líquidos puros y solventes se omiten de las expresiones constantes de equilibrio porque no cambian significativamente durante las reacciones cuando hay suficiente presencia para alcanzar el equilibrio.
Expresiones constantes de equilibrio para las sumas de reacciones
Los químicos frecuentemente necesitan conocer la constante de equilibrio para una reacción que no ha sido estudiada previamente. En tales casos, la reacción deseada a menudo puede escribirse como la suma de otras reacciones para las que se conocen las constantes de equilibrio. La constante de equilibrio para la reacción desconocida puede entonces calcularse a partir de los valores tabulados para las otras reacciones.
Para ilustrar este procedimiento, consideremos la reacción de N 2 con O 2 para dar NO 2. Como señalamos en la Sección 15.1, esta reacción es una fuente importante del NO 2 que le da al smog urbano su típico color marrón. La reacción normalmente ocurre en dos etapas distintas. En la primera reacción (1), N 2 reacciona con O 2 a las altas temperaturas dentro de un motor de combustión interna para dar NO. El NO liberado reacciona entonces con O 2 adicional para dar NO 2 (2). También se da la constante de equilibrio para cada reacción a 100°C.
- \(N_{2(g)}+O_{2(g)} \rightleftharpoons 2NO_{(g)}\;\; K_1=2.0 \times 10^{−25}\)
- \(2NO_{(g)}+O_{2(g)} \rightleftharpoons 2NO_{2(g)}\;\;\;K_2=6.4 \times 10^9\)
- Sumando las reacciones (1) y (2) dan la reacción global de N 2 con O 2:
- \(N_{2(g)}+2O_{2(g)} \rightleftharpoons 2NO_{2(g)} \;\;\;K_3=?\)
Las expresiones constantes de equilibrio para las reacciones son las siguientes:
\[K_1=\dfrac{[NO]^2}{[N_2][O_2]}\;\;\; K_2=\dfrac{[NO_2]^2}{[NO]^2[O_2]}\;\;\; K_3=\dfrac{[NO_2]^2}{[N_2][O_2]^2} \notag \]v
¿Cuál es la relación entre K 1, K 2 y K 3, todo a 100°C? La expresión para K 1 tiene [NO] 2 en el numerador, la expresión para K 2 tiene [NO] 2 en el denominador, y [NO] 2 no aparece en la expresión para K 3. Multiplicando K 1 por K 2 y cancelando los términos [NO] 2,
\[ K_1K_2=\dfrac{\cancel{[NO]^2}}{[N_2][O_2]} \times \dfrac{[NO_2]^2}{\cancel{[NO]^2}[O_2]}=\dfrac{[NO_2]^2}{[N_2][O_2]^2}=K_3 \notag \]
Así, el producto de las expresiones constantes de equilibrio para K1 y K2 es el mismo que la expresión constante de equilibrio para K3:
\[K_3 = K_1K_2 = (2.0 \times 10^{−25})(6.4 \times 10^9) = 1.3 \times 10^{−15} \notag \]
La constante de equilibrio para una reacción que es la suma de dos o más reacciones es igual al producto de las constantes de equilibrio para las reacciones individuales. En contraste, recordemos que según la Ley de Hess, Δ H para la suma de dos o más reacciones es la suma de los valores Δ H para las reacciones individuales.
Tenga en cuenta el patrón
Para determinar K para una reacción que es la suma de dos o más reacciones, sumar las reacciones pero multiplicar las constantes de equilibrio.
Ejemplo 15.2.6
Las siguientes reacciones ocurren a 1200°C:
- \(CO_{(g)}+3H_{2(g)} \rightleftharpoons CH_{4(g)}+H_2O_{(g)} \;\;\;K_1=9.17 \times 10^{−2}\)
- \(CH_{4(g)}+2H_2S_{(g)} \rightleftharpoons CS_{2(g)}+4H_{2(g})\;\;\; K_2=3.3 \times 10^4\)
Calcular la constante de equilibrio para la siguiente reacción a la misma temperatura. - \(CO_{(g)}+2H_2S_{(g)} \rightleftharpoons CS_{2(g)}+H_2O_{(g)}+H_{2(g)}\;\;\; K_3=?\)
Dado: dos ecuaciones de equilibrio equilibrado, valores de K, y una ecuación de equilibrio para la reacción general
Preguntado por: constante de equilibrio para la reacción general
Estrategia:
Organizar las ecuaciones para que su suma produzca la ecuación general. Si hubo que invertir una ecuación, invierta el valor de K para esa ecuación. Calcular K para la ecuación general multiplicando las constantes de equilibrio para las ecuaciones individuales.
Solución:
La clave para resolver este problema es reconocer que la reacción 3 es la suma de las reacciones 1 y 2:
\[CO_{(g)}+ \cancel{3H_{2(g)}} \rightleftharpoons \cancel{CH_{4(g)}} + H_2O_{(g)} \notag \]
\[\cancel{CH_{4(g)}} +2H_2S_{(g)} \rightleftharpoons CS_{2(g)} + \cancel{3H_{2(g)}} + H_{2(g)} \notag \]
\[ CO_{(g)} + 3H_{2(g)} \rightleftharpoons CS_{2(g)}+H_2O_{(g)}+H_{2(g)} \notag \]
Se dan los valores para K1 y K 2, por lo que es sencillo calcular K 3:
\[K_3 = K_1K_2 = (9.17 \times 10^{−2})(3.3 \times 10^4) = 3.03 \times 10^3 \notag \]
Ejercicio
En el primero de dos pasos en la síntesis industrial del ácido sulfúrico, el azufre elemental reacciona con el oxígeno para producir dióxido de azufre. En la segunda etapa, el dióxido de azufre reacciona con oxígeno adicional para formar trióxido de azufre. Se muestra la reacción para cada etapa, así como el valor de la constante de equilibrio correspondiente a 25°C. Calcular la constante de equilibrio para la reacción global a esta misma temperatura.
- \(\frac{1}{8}S_{8(s)}+O_{2(g)} \rightleftharpoons SO_{2(g)}\;\;\; K_1=4.4 \times 10^{53}\)
- \(SO_{2(g)}+\frac{1}{2}O_{2(g)} \rightleftharpoons SO_{3(g)}\;\;\; K_2=2.6 \times 10^{12}\)
- \(\frac{1}{8}S_{8(s)}+\frac{3}{2}O_{2(g)} \rightleftharpoons SO_{3(g)}\;\;\; K_3=?\)
Respuesta: K 3 = 1.1 × 10 66
Resumen
La relación de las constantes de velocidad para las reacciones directa e inversa en equilibrio es la constante de equilibrio (K), una cantidad sin unidad. Por lo tanto, la composición de la mezcla de equilibrio está determinada por las magnitudes de las constantes de velocidad hacia adelante e inversa en equilibrio. Bajo un conjunto dado de condiciones, una reacción siempre tendrá la misma K. Para un sistema en equilibrio, la ley de acción de masa relaciona K con la relación de las concentraciones de equilibrio de los productos a las concentraciones de los reactivos elevadas a sus respectivas potencias para que coincidan con los coeficientes en la ecuación de equilibrio. La relación se denomina expresión constante de equilibrio. Cuando se escribe una reacción en la dirección inversa, K y la expresión constante de equilibrio se invierten. Para los gases, la expresión constante de equilibrio puede escribirse como la relación de las presiones parciales de los productos a las presiones parciales de los reactivos, cada una elevada a una potencia que coincide con su coeficiente en la ecuación química. Una constante de equilibrio calculada a partir de presiones parciales (K p) se relaciona con K por la constante de gas ideal (R), la temperatura (T) y el cambio en el número de moles de gas durante la reacción. Un sistema de equilibrio que contiene productos y reactivos en una sola fase es un equilibrio homogéneo; un sistema cuyos reactivos, productos o ambos están en más de una fase es un equilibrio heterogéneo. Cuando una reacción puede expresarse como la suma de dos o más reacciones, su constante de equilibrio es igual al producto de las constantes de equilibrio para las reacciones individuales.
Claves para llevar
- La ley de acción masiva describe un sistema en equilibrio en términos de las concentraciones de los productos y los reactivos.
- Para un sistema que involucra uno o más gases, se pueden utilizar las concentraciones molares de los gases o sus presiones parciales.
Ecuaciones Clave
Definición de constante de equilibrio en términos de constantes de velocidad directa e inversa
Ecuación 15.2.5:\( K=\dfrac{k_f}{k_r} \)
Expresión constante de equilibrio (ley de acción de masas)
Ecuación 15.2.7: <\( K=\dfrac{\left [ C \right ]^c \left [ D \right ]^d}{\left [ A \right ]^a \left [ B \right ]^b} \)
Expresión constante de equilibrio para reacciones que involucran gases usando presiones parciales
Ecuación 15.2.1617:\( K_p=\dfrac{P_C^c P_D^d}{P_A^aP_B^b} \)
Relación entre K p y K
Ecuación 15.2.18:\( K_p=K\left ( RT \right )^{\Delta n} \)
Problemas conceptuales
-
Para una reacción de equilibrio, ¿qué efecto tiene la inversión de los reactivos y productos sobre el valor de la constante de equilibrio?
-
¿Cuáles de los siguientes equilibrios son homogéneos y cuáles heterogéneos?
- \(2HF_{(g)} \rightleftharpoons H_{2(g)}+F_{2(g)}\)
- \(C_{(s)} + 2H_{2(g)} \rightleftharpoons CH_{4(g)}\)
- \(\ce{H_2C=CH_{2(g)}} + H_{2(g)} \rightleftharpoons C_2H_{6(g)}\)
- \(2Hg_{(l)} + O_{2(g)} \rightleftharpoons 2HgO_{(s)}\)
-
Clasificar cada sistema de equilibrio como homogéneo o heterogéneo.
- \(NH_4CO_2NH_{2(s)} \rightleftharpoons 2NH_{3(g)}+CO_{2(g)}\)
- \(C_{(s)} + O_{2(g)} \rightleftharpoons CO_{2(g)}\)
- \(2Mg_{(s)} + O_{2(g)} \rightleftharpoons 2MgO_{(s)}\)
- \(AgCl_{(s)} \rightleftharpoons Ag^+_{(aq)}+Cl^−_{(aq)}\)
-
Si una reacción de equilibrio es endotérmica, ¿qué sucede con la constante de equilibrio si se aumenta la temperatura de la reacción? si se disminuye la temperatura?
-
Producción industrial de NO por la reacción <math xml:id="av_1.0-15_m114" display="inline"> <semantics><mrow><msub><mtext>N</mtext> <mn>2</mn></msub> <mtext>(g)</mtext> <mo>+</mo> <msub><mtext>O</mtext> <mn>2</mn></msub> <mtext>(g)</mtext> <mo>& lt; /mo> <mtext>2NO (g)</mtext></mrow></semantics></math> se lleva a cabo a temperaturas elevadas para conducir la reacción hacia la formación del producto. Después de que se haya formado suficiente producto, la mezcla de reacción se enfría rápidamente. ¿Por qué?
-
¿Cómo diferenciarías entre un sistema que ha alcanzado el equilibrio químico y uno que está reaccionando tan lentamente que los cambios en la concentración son difíciles de observar?
-
¿Cuál es la relación entre la constante de equilibrio, la concentración de cada componente del sistema y las constantes de velocidad para las reacciones hacia adelante y hacia atrás?
-
Escriba las expresiones constantes de equilibrio para K y K p para cada reacción.
- \(CO_{(g)} + H_2O_{(g)} \rightleftharpoons CO_{2(g)}+H_{2(g)}\)
- \(PCl_{3(g)}+Cl_{2(g)} \rightleftharpoons PCl_{5(g)}\)
- \(2O_{3(g)} \rightleftharpoons 3O_{2(g)}\)
-
Escriba las expresiones constantes de equilibrio para K y K p según corresponda para cada reacción.
- \(2NO_{(g)}+O_{2(g)} \rightleftharpoons 2NO_{2(g)}\)
- \(\frac{1}{2}H_{2(g)}+12I_{2(g)} \rightleftharpoons HI_{(g)}\)
- \(cis-stilbene_{(soln)} \rightleftharpoons trans-stilbene_{(soln)}\)
-
¿Por qué es incorrecto afirmar que los líquidos puros, los sólidos puros y los solventes no forman parte de una expresión constante de equilibrio?
-
Escriba las expresiones constantes de equilibrio para K y K p para cada reacción de equilibrio.
- \(2S_{(s)}+3O_{2(g)} \rightleftharpoons 2SO_{3(g)}\)
- \(C_{(s)} + CO_{2(g)} \rightleftharpoons 2CO_{(g)}\)
- \(2ZnS_{(s)}+3O_{2(g)} \rightleftharpoons 2ZnO_{(s)}+2SO_{2(g)}\)
-
Escriba las expresiones constantes de equilibrio para K y K p para cada reacción de equilibrio.
- \(2HgO_{(s)} \rightleftharpoons 2Hg_{(l)}+O_{2(g)}\)
- \(H_{2(g)}+I_{2(s)} \rightleftharpoons 2HI_{(g)}\)
- \(NH_4CO_2NH_{2(s)} \rightleftharpoons 2NH_{3(g)}+CO_{2(g)}\)
-
A temperatura ambiente, la constante de equilibrio para la reacción <math xml:id="av_1.0-15_m134" display="inline"> <semantics><mrow><mn>2</mn> <mtext>A (g<mo>)</mo></mtext> <mtext>B (g)</mtext></mrow></semantics></math> es 1. ¿Qué indica esto sobre las concentraciones de A y B en equilibrio? ¿Esperarías que K y K p varíen significativamente entre sí? De ser así, ¿cómo se vería afectada su diferencia por la temperatura?
-
Para una cierta serie de reacciones, si [OH −] [HCO 3 −]/[CO 3 2−] = K 1 y [OH −] [H 2 CO 3]/[HCO 3 −] = K 2, cuál es la expresión constante de equilibrio para la reacción general? Escribe la ecuación de equilibrio general.
-
En la ecuación para una reacción enzimática, ES representa el complejo formado entre el sustrato S y la proteína enzimática E. En la etapa final de la siguiente reacción de oxidación, el producto P se disocia del complejo ESO 2, que regenera la enzima activa:
\[E + S \rightleftharpoons ES\;\;\; K_1\]\[ES + O_2 \rightleftharpoons ESO_2 \;\;\; K_2\]\[ESO_2 \rightleftharpoons E+P\;\;\;\; K_3\]Dar la ecuación general de reacción y mostrar que K = K 1 × K 2 × K 3.
RESPUESTAS
-
La constante de equilibrio para la reacción escrita a la inversa: K ′ = 1/ K.
-
Cada sistema es heterogéneo.
-
El enfriamiento rápido “apaga” la mezcla de reacción y evita que el sistema revierta a la composición de equilibrio de baja temperatura que favorece a los reactivos.
-
\ (K=\ dfrac {k_f} {k_r}\;\;\; K=\ dfrac {[C] ^c [D] ^d} {[A] ^a [B] ^b}\])
-
- \(K=\dfrac{[NO_2]^2}{[NO]^2[O_2]}\;\;\; K_p=\dfrac{(P_{N_2O})^2}{(P_{NO})^2(P_{O_2}})\)
- \(K=\dfrac{[HI]}{[H_2]^{1/2}[I_2]^{1/2}}\;\;\; K_p=\dfrac{P_{HI}}{(P_{H_2})^{1/2}(P_{I_2})}\)
- \(K=\dfrac{[\text{trans-stilbene}]}{[\text{cis-stilbene}]}\)
-
- \(K=\dfrac{[SO_3]^2}{[O_2]^3}\;\;\; K_p=\dfrac{(P_{SO_3})^2}{(P_{O_2})^3}\)
- \(K=\dfrac{[CO]^2}{[CO_2]}\;\;\; K_p=\dfrac{(P_{CO})^2}{P_{CO_2}}\)
- \(K=\dfrac{[SO_2]^2}{[O_2]^3}\;\;\; K_p=\dfrac{(P_{SO_2})^2}{(P_{O_2})^3}\)
-
En equilibrio,
\([A]=\sqrt{B}\)y\(Δn =−1\) así\(K_p=K(RT)^{Δn}=\dfrac{K}{RT}\)
la diferencia aumenta a medida que T aumenta.
Problemas numéricos
-
Explica lo que cada uno de los siguientes valores para K te dice sobre las concentraciones relativas de los reactivos frente a los productos en una reacción de equilibrio dada: K = 0.892; K = 3.25 × 10 8; K = 5.26 × 10 −11. ¿Se favorecen los productos o reactivos en equilibrio?
-
Escriba la expresión constante de equilibrio para cada reacción. ¿Son equivalentes estas expresiones constantes de equilibrio? Explique.
- \(N_2O_{4(g)} \rightleftharpoons 2NO_{2(g)}\)
- \(\frac{1}{2}N_2O_{4(g)} \rightleftharpoons NO_{2(g)}\)
-
Escriba la expresión constante de equilibrio para cada reacción.
- \(\frac{1}{2}N_{2(g)}+\frac{3}{2}H_{2(g)} \rightleftharpoons NH_{3(g)}\)
- \(\frac{1}{3}N_{2(g)}+H_{2(g)} \rightleftharpoons \frac{2}{3}NH_{3(g)}\)
¿Cómo se relacionan matemáticamente estas dos expresiones con la expresión constante de equilibrio para
\[N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)} ? \notag \]
-
Escribir una expresión constante de equilibrio para cada reacción.
- \(C_{(s)} + 2H_2O_{(g)}⇌CO_{2(g)}+2H_{2(g)}\)
- \(SbCl_{3(g)}+Cl_{2(g)}⇌SbCl_{5(g)}\)
- \(2O_{3(g)}⇌3O_{2(g)}\)
-
Dar una expresión constante de equilibrio para cada reacción.
- \(2NO_{(g)} + O_{2(g)} \rightleftharpoons 2NO_{2(g)}\)
- \(\frac{1}{2}H_{2(g)}+\frac{1}{2}I_{2(g)}⇌HI_{(g)}\)
- \(CaCO_{3(s)} + 2HOCl_{(aq)} \rightleftharpoons Ca^{2+}_{(aq)} + 2OCl^−_{(aq)} + H_2O_{(l)} + CO_{2(g)}\)
-
Calcular K y K p para cada reacción.
- \(2NOBr_{(g)}⇌2NO_{(g)}+Br_{(g)}\)a 727°C, la concentración de equilibrio de NO es 1.29 M, Br 2 es 10.52 M y NOBr es 0.423 M.
- \(C_{(s)} + CO_{2(g)}⇌2CO_{(g)}\): a 1200 K, un recipiente de 2.00 L en equilibrio tiene presiones parciales de 93.5 atm CO 2 y 76.8 atm CO, y el recipiente contiene 3.55 g de carbono.
-
Calcular K y K p para cada reacción.
- \(N_2O4_{(g)}⇌2NO_{2(g)}\): a la temperatura de equilibrio de -40°C, una muestra de 0.150 M de N 2 O 4 sufre una descomposición de 0.456%.
- \(CO_{(g)}+2H_{2(g)}⇌CH_3OH_{(g)}\): se alcanza un equilibrio a 227°C en un recipiente de reacción de 15.5 L con una presión total de 6.71 × 10 2 atm. Se encuentra que contiene 37.8 g de gas hidrógeno, 457.7 g de monóxido de carbono y 7193 g de metanol.
-
Determinar K y K p (en su caso) para cada reacción.
- \(2H_2S_{(g)}⇌2H_{2(g)}+S_{2(g)}\): a 1065°C, una mezcla de equilibrio consiste en\(1.00 \times 10^{−3}\)\(1.20 \times 10^{−3}\) M\(H_2\)\(S_2\),\(3.32 \times 10^{−3}\) M y\(H_2S\) M.
- \(Ba(OH)_{2(s)}⇌2OH^−_{(aq)}+Ba^{2+}_{(aq)}\): a 25°C, un vaso de precipitados de 250 mL contiene 0.330 mol de hidróxido de bario en equilibrio con 0.0267 mol de iones de bario y 0.0534 mol de iones hidróxido.
-
Determinar K y K p para cada reacción.
- \(2NOCl_{(g)}⇌2NO_{(g)}+Cl_{2(g)}\): a 500 K, una muestra de 24.3 mM de se\(NOCl\) ha descompuesto, dejando una mezcla de equilibrio que contiene 72.7% de la cantidad original de\(NOCl\).
- \(Cl_{2(g)}+PCl_{3(g)}⇌PCl_{5(g)}\): a 250°C, un recipiente de reacción de 500 mL contiene 16.9 g de\(Cl_2\) gas, 0.500 g de\(PCl_3\), y 10.2 g de\(PCl_5\) en equilibrio.
-
La expresión constante de equilibrio para una reacción es [CO 2] 2/[SO 2] 2 [O 2]. ¿Cuál es la ecuación química equilibrada para la reacción global si uno de los reactivos es Na 2 CO 3 (s)?
-
La expresión constante de equilibrio para una reacción es [NO] [H 2 O] 3/2/[NH 3] [O 2] 5/4. ¿Cuál es la ecuación química equilibrada para la reacción general?
-
Dado K = k f/k r, ¿qué sucede con la magnitud de la constante de equilibrio si se duplica la velocidad de reacción de la reacción directa? ¿Qué sucede si la velocidad de reacción de la reacción inversa para la reacción general disminuye en un factor de 3?
-
El valor de la constante de equilibrio para
\[ 2H_{2(g)}+S_{2(g)}⇌2H_2S_{(g)} \notag \]
es 1.08 × 10 7 a 700°C ¿Cuál es el valor de la constante de equilibrio para las siguientes reacciones relacionadas?
- \(H_{2(g)}+12S_{2(g)}⇌H_2S_{(g)}\)
- \(4H_{2(g)}+2S_{2(g)}⇌4H_2S_{(g)}\)
- \(H_2S_{(g)}⇌H_{2(g)}+12S_{2(g)}\)
RESPUESTAS
-
K = 0.892: las concentraciones de los productos y los reactivos son aproximadamente iguales en equilibrio por lo que ninguno se ve favorecido; K = 3.25 × 10 8: la relación de la concentración de los productos a los reactivos en equilibrio es muy grande por lo que la formación de productos es favorecido; K = 5.26 × 10 −11: la relación de la concentración de los productos a los reactivos en equilibrio es muy pequeña por lo que no se favorece la formación de productos.
-
- \(K'=\dfrac{[NH_3]}{[N_2]^{1/2}[H_2]^{3/2}}\)
- \(K''=\dfrac{[NH_3]^{2/3}}{[N_2]^{1/3}[H_2]}\;\;\; K=\dfrac{[NH_3]^2}{[N_2][H_2]^3}\;\;\; K′ = K^{1/2},\text{ and} K″ = K^{1/3}\)
-
- \(K=\dfrac{[NO_2]^2}{[NO]^2[O_2]}\)
- \(K=\dfrac{[HI]}{[H_2]^{1/2}[I_2]^{1/2}}\)
- \(K=\dfrac{[Ca^{2+}][OCl^−]^2[P_{CO_2}]}{[HOCl]^2}\)
-
- \(K = 1.25 \times 10^{−5}\;\;\; K_p = 2.39 \times 10^{−4}\)
- \(K = 9.43\;\;\; K_p = 5.60 \times 10^{−3}\)
-
- \(K=\dfrac{[Cl_2][NO]^2}{[NOCl]^2}=4.59 \times 10^{−4}\;\;\; K_p=1.88 \times 10^{−2}\)
- \(K=\dfrac{[PCl_5]}{[PCl_3][Cl_2]}=28.3\;\;\; K_p=0.658\)
-
\(NH_3 + \frac{5}{4}O_2⇌NO +\frac{3}{2}H_2O\), que también puede escribirse de la siguiente manera:\[4NH_{3(g)} + 5O_{2(g)}⇌4NO_{(g)} + 6H_2O_{(g)}\]
-
- 3.29 × 10 3
- 1.17 × 10 14
- 3.04 × 10 −4
- Anonymous
Modificado por Joshua B. Halpern