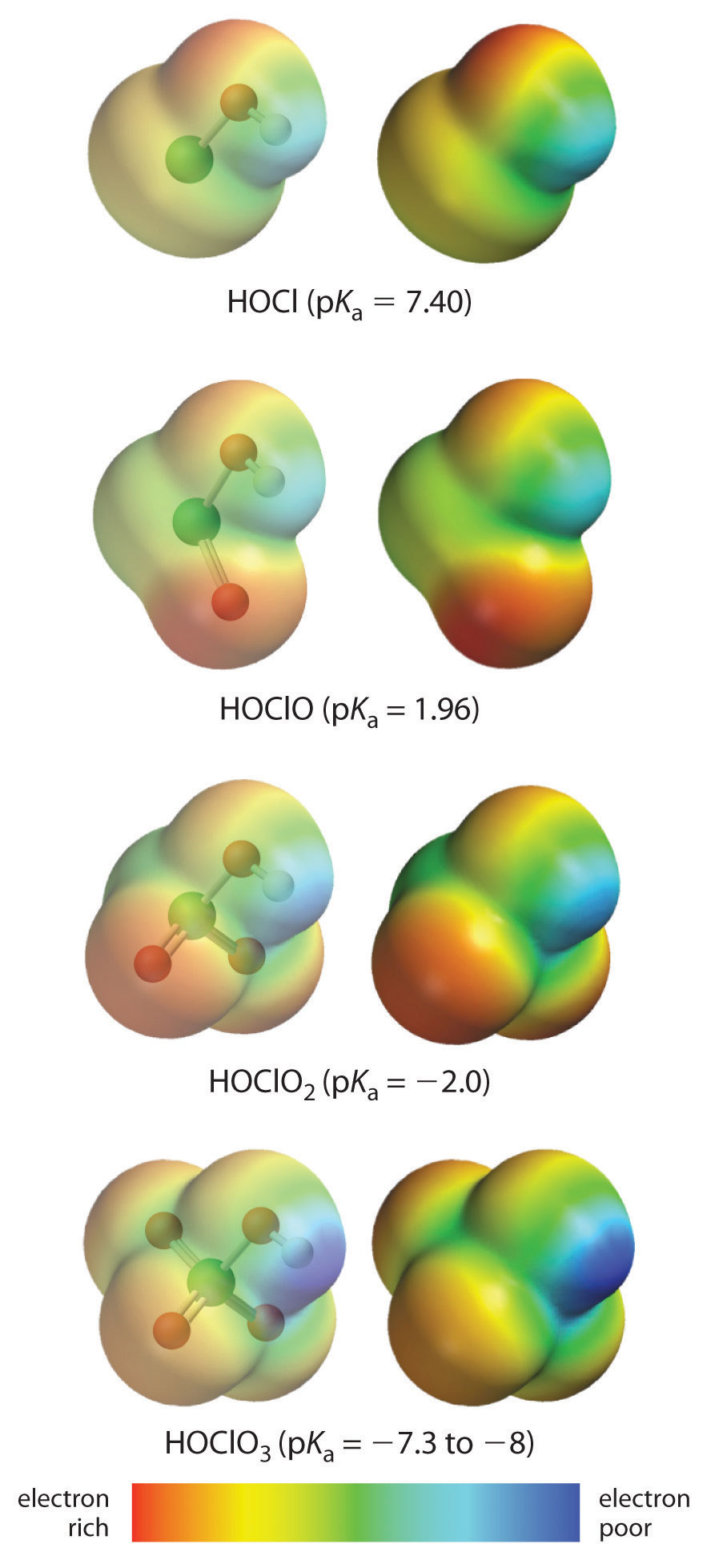16.3: Estructura Molecular y Fuerza Ácido-Base
- Page ID
- 78430
- Entender cómo la estructura molecular afecta la fuerza de un ácido o base.
Hemos visto que las fuerzas de ácidos y bases varían en muchos órdenes de magnitud. En esta sección, exploramos algunos de los factores estructurales y electrónicos que controlan la acidez o basicidad de una molécula.
Fortalezas de bonos
En general, cuanto más fuerte sea el enlace A—H o B—H +, menos probable es que el enlace se rompa para formar iones H + y, por lo tanto, menos ácida es la sustancia. Este efecto se puede ilustrar usando los haluros de hidrógeno:
| Fuerza relativa a los ácidos | HF | < | HCl | < | HBr | < | HOLA |
|---|---|---|---|---|---|---|---|
| Energía de enlace H—X (kJ/mol) | 570 | 432 | 366 | 298 | |||
| p K a | 3.20 | −6.1 | −8.9 | −9.3 |
La tendencia en las energías de enlace se debe a una disminución constante en el solapamiento entre el orbital de 1 s de hidrógeno y el orbital de valencia del átomo de halógeno a medida que aumenta el tamaño del halógeno. Cuanto mayor sea el átomo al que está unido H, más débil es el enlace. Así, el enlace entre H y un átomo grande en una familia dada, como I o Te, es más débil que el enlace entre H y un átomo más pequeño de la misma familia, como F u O. Como resultado, las fuerzas ácidas de los hidruros binarios aumentan a medida que bajamos por una columna de la tabla periódica. Por ejemplo, el orden de acidez para los hidruros binarios del Grupo 16 es el siguiente, con p K a valores entre paréntesis: H 2 O (14.00 = p K w) < H 2 S (7.05) < H 2 Se (3.89) < H 2 Te (2.6).
Estabilidad de la Base Conjugada
Si escribimos una reacción ácido-base como\(AH \rightleftharpoons A^−+H^+\) o como\(BH^+ \rightleftharpoons B+H^+\) la base conjugada (A − o B) contiene un par más de electrones solitarios que el ácido parental (AH o BH +). Cualquier factor que estabilice al par solitario sobre la base conjugada favorece la disociación de H+ y hace que el ácido parental sea un ácido más fuerte. Veamos cómo esto explica la acidez relativa de los hidruros binarios de los elementos en la segunda fila de la tabla periódica. El orden observado de acidez creciente es el siguiente, con valores de p K a entre paréntesis: CH 4 (~50) << NH 3 (~36) < H 2 O (14.00) < HF (3.20).
Consideremos, por ejemplo, los compuestos en ambos extremos de esta serie: metano y fluoruro de hidrógeno. La base conjugada de CH 4 es CH 3 −, y la base conjugada de HF es F −. Debido a que el flúor es mucho más electronegativo que el carbono, el flúor puede estabilizar mejor la carga negativa en el ion F − que el carbono puede estabilizar la carga negativa en el ion CH 3 −. En consecuencia, el HF tiene una mayor tendencia a disociarse para formar H + y F − que el metano para formar H + y CH 3 −, haciendo del HF un ácido mucho más fuerte que CH 4.
La misma tendencia se predice analizando las propiedades de los ácidos conjugados. Para una serie de compuestos de fórmula general HE, a medida que aumenta la electronegatividad de E, el enlace E—H se vuelve más polar, favoreciendo la disociación para formar E − y H +. Debido tanto a la creciente estabilidad de la base conjugada como a la creciente polarización del enlace E—H en el ácido conjugado, las fuerzas ácidas de los hidruros binarios aumentan a medida que avanzamos de izquierda a derecha a través de una fila de la tabla periódica.
Tenga en cuenta el patrón
Las fuerzas ácidas de los hidruros binarios aumentan a medida que bajamos por una columna o de izquierda a derecha a través de una fila de la tabla periódica.
Efectos inductivos
Los átomos o grupos de átomos en una molécula distinta de aquellos a los que H está unido pueden inducir un cambio en la distribución de electrones dentro de la molécula. Esto se denomina efecto inductivo, y, al igual que la coordinación del agua a un ion metálico, puede tener un efecto importante sobre la acidez o basicidad de la molécula. Por ejemplo, los ácidos hipohalosos (fórmula general HOX, con X representando un halógeno) tienen todos un átomo de hidrógeno unido a un átomo de oxígeno. En solución acuosa, todos producen el siguiente equilibrio:
\[ HOX_{(aq)} \rightleftharpoons H^+_{(aq)} + OX^−{(aq)} \tag{16.3.1}\]
Las acidedades de estos ácidos varían en aproximadamente tres órdenes de magnitud, sin embargo, debido a la diferencia en la electronegatividad de los átomos de halógeno:
| HOX | Electronegatividad de X | p K a |
|---|---|---|
| HOCl | 3.0 | 7.40 |
| HOBr | 2.8 | 8.55 |
| HOI | 2.5 | 10.5 |
A medida que aumenta la electronegatividad de X, la distribución de la densidad de electrones dentro de la molécula cambia: los electrones se dibujan más fuertemente hacia el átomo de halógeno y, a su vez, alejándose del H en el enlace O—H, debilitando así el enlace O—H y permitiendo la disociación del hidrógeno como H +.
La acidez de los oxoácidos, con la fórmula general HOXO n (n = 0−3), depende fuertemente del número de átomos de oxígeno terminales unidos al átomo central X. Como se muestra en la Figura 16.3.1, los valores K a de los oxoácidos del cloro aumentar en un factor de aproximadamente 10 4 a 10 6 con cada oxígeno a medida que se agregan sucesivos átomos de oxígeno. El aumento en la fuerza ácida con el aumento del número de átomos de oxígeno terminales se debe tanto a un efecto inductivo como a una mayor estabilización de la base conjugada.
Tenga en cuenta el patrón
Cualquier efecto inductivo que retire la densidad electrónica de un enlace O-H aumenta la acidez del compuesto.
Debido a que el oxígeno es el segundo elemento más electronegativo, agregar átomos de oxígeno terminales hace que los electrones se alejen del enlace O—H, lo que lo hace más débil y con ello aumenta la fuerza del ácido. Los colores de la Figura 16.3.1 muestran cómo el potencial electrostático, una medida de la fuerza de la interacción de una carga puntual en cualquier lugar de la superficie de la molécula, cambia a medida que aumenta el número de átomos de oxígeno terminales. En la Figura 16.3.1 y la Figura 16.3.2, el azul corresponde a bajas densidades de electrones, mientras que el rojo corresponde a altas densidades de electrones. El átomo de oxígeno en la unidad O—H se vuelve constantemente menos rojo de HClO a HClO 4 (también escrito como Hoclo 3), mientras que el átomo de H se vuelve constantemente más azul, lo que indica que la densidad de electrones en la unidad O—H disminuye a medida que aumenta el número de átomos de oxígeno terminales. La disminución de la densidad de electrones en el enlace O—H lo debilita, facilitando la pérdida de hidrógeno como iones H +, aumentando así la fuerza del ácido.
Figura 16.3.1 La relación entre las fuerzas ácidas de los oxoácidos del cloro y la densidad de electrones en la unidad O—H Estos mapas de potencial electrostático muestran cómo disminuye la densidad de electrones en la unidad O-H a medida que aumenta el número de átomos de oxígeno terminales. El azul corresponde a bajas densidades de electrones, mientras que el rojo corresponde a altas densidades de electrones.
Fuente: Oxoácidos de cloro p K a valores de J. R. Bowser, Inorganic Chemistry (Pacific Grove, CA: Brooks-Cole,1993).
Al menos tan importante, sin embargo, es el efecto de la deslocalización de la carga negativa en la base conjugada. Como se muestra en la Figura 16.3.2, el número de estructuras de resonancia que se pueden escribir para los oxoaniones de cloro aumenta a medida que aumenta el número de átomos de oxígeno terminales, permitiendo que la única carga negativa se deslocalice sobre sucesivamente más átomos de oxígeno. Las gráficas de potencial electrostático en la Figura 16.3.2 demuestran que la densidad de electrones en los átomos de oxígeno terminales disminuye de manera constante a medida que aumenta su número. El átomo de oxígeno en ClO − es rojo, lo que indica que es rico en electrones, y el color del oxígeno cambia progresivamente a verde en ClO 4 −, lo que indica que los átomos de oxígeno se están volviendo cada vez menos ricos en electrones a través de la serie. Por ejemplo, en el ion perclorato (ClO 4 −), la carga negativa única se deslocaliza sobre los cuatro átomos de oxígeno, mientras que en el ion hipoclorito (OCl −), la carga negativa se localiza en gran medida en un solo átomo de oxígeno (Figura 16.3.2). Como resultado, el ion perclorato no tiene carga negativa localizada a la que se pueda unir un protón. En consecuencia, el anión perclorato tiene una afinidad mucho menor por un protón que el ion hipoclorito, y el ácido perclórico es uno de los ácidos más fuertes conocidos.
Tenga en cuenta el patrón
La deslocalización de electrones en la base conjugada aumenta la fuerza ácida.
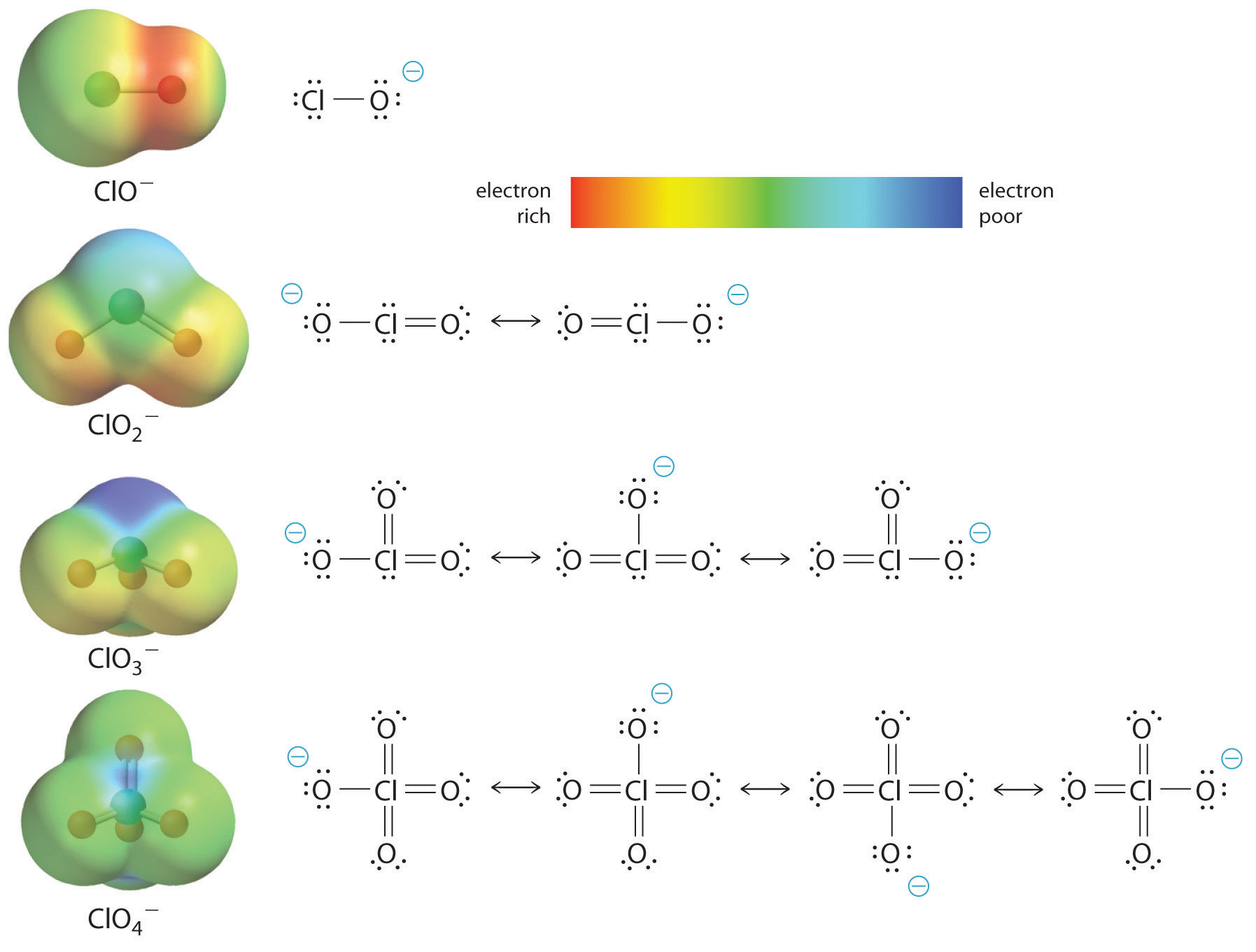
Figura 16.3.2 La relación entre la deslocalización de la carga negativa en los oxoaniones de cloro y el número de átomos de oxígeno terminales A medida que aumenta el número de átomos de oxígeno terminales, el número de estructuras de resonancia que se pueden escribir para los oxoaniones de cloro también aumenta, y la carga negativa única se deslocaliza sobre más átomos de oxígeno. Como demuestran estas gráficas de potencial electrostático, la densidad de electrones en los átomos terminales de oxígeno disminuye de manera constante a medida que aumenta su número. A medida que disminuye la densidad electrónica en los átomos de oxígeno, también lo hace su afinidad por un protón, haciendo que el anión sea menos básico. Como resultado, el oxoácido parental es más ácido.
Efectos inductivos similares también son responsables de la tendencia en las acideces de los oxoácidos que tienen el mismo número de átomos de oxígeno a medida que atravesamos una fila de la tabla periódica de izquierda a derecha. Por ejemplo, H 3 PO 4 es un ácido débil, H 2 SO 4 es un ácido fuerte, y HClO 4 es uno de los ácidos más fuertes conocidos. El número de átomos de oxígeno terminales aumenta de manera constante a lo largo de la fila, consistente con el aumento observado en la acidez. Además, la electronegatividad del átomo central aumenta de manera constante de P a S a Cl, lo que provoca que los electrones sean atraídos del oxígeno al átomo central, debilitando el enlace O—H y aumentando la fuerza del oxoácido.
La inspección cuidadosa de los datos del Cuadro 16.3.1 muestra dos anomalías aparentes: ácido carbónico y ácido fosforoso. Si el ácido carbónico (H 2 CO 3) fuera una molécula discreta con la estructura (HO) 2 C=O, tendría un solo átomo de oxígeno terminal y debería ser comparable en fuerza ácida al ácido fosfórico (H 3 PO 4), para lo cual p K a1 = 2.16. En cambio, el valor tabulado de p K a1 para el ácido carbónico es 6.35, lo que lo hace aproximadamente 10,000 veces más débil de lo esperado. Como veremos en la Sección 16.6, sin embargo, H 2 CO 3 es sólo un componente menor de las soluciones acuosas de CO 2 que se denominan ácido carbónico. De manera similar, si el ácido fosforoso (H 3 PO 3) realmente tuviera la estructura (HO) 3 P, no tendría átomos de oxígeno terminales unidos al fósforo. Por lo tanto, se esperaría que fuera un ácido aproximadamente tan fuerte como el HOCl (p K a = 7.40). De hecho, el p K a1 para el ácido fosforoso es 1.30, y la estructura del ácido fosforoso es (HO) 2 P (=O) H con un átomo de H unido directamente a P y un enlace P=O. Así, el p K a1 para el ácido fosforoso es similar al de otros oxoácidos con un átomo de oxígeno terminal, como H 3 PO 4. Afortunadamente, el ácido fosforoso es el único oxoácido común en el que un átomo de hidrógeno está unido al átomo central en lugar de oxígeno.
Cuadro 16.3.1 Valores de p K a para ácidos y bases polipróticos seleccionados
| Ácidos polipróticos | Fórmula | p K a1 | p K a2 | p K a3 |
| ácido carbónico* | “H 2 CO 3” | 6.35 | 10.33 | |
| ácido cítrico | HO 2 CCH 2 C (OH) (CO 2 H) CH 2 CO 2 H | 3.13 | 4.76 | 6.40 |
| ácido malónico | HO 2 CCH 2 CO 2 H | 2.85 | 5.70 | |
| ácido oxálico | HO 2 CCO 2 H | 1.25 | 3.81 | |
| ácido fosfórico | H 3 PO 4 | 2.16 | 7.21 | 12.32 |
| ácido fosforoso | H 3 PO 3 | 1.3 | 6.70 | |
| ácido succínico | HO 2 CCH 2 CH 2 CO 2 H | 4.21 | 5.64 | |
| ácido sulfúrico | H 2 SO 4 | −2.0 | 1.99 | |
| ácido sulfuroso* | “H 2 SO 3" | 1.85 | 7.21 | |
| Bases Polipróticas | Fórmula | p K b1 | p K b2 | |
| etilendiamina | H 2 N (CH 2) 2 NH 2 | 4.08 | 7.14 | |
| piperazina | HN (CH 2 CH 2) 2 NH | 4.27 | 8.67 | |
| propilendiamina | H 2 N (CH 2) 3 NH 2 | 3.45 | 5.12 | |
| *H 2 CO 3 y H 2 SO 3 son, en el mejor de los casos, componentes menores de soluciones acuosas de CO 2 (g) y SO 2 (g), respectivamente, pero tales soluciones se denominan comúnmente como que contienen ácido carbónico y ácido sulfuroso, respectivamente. | ||||
|---|---|---|---|---|
También se observan efectos inductivos en moléculas orgánicas que contienen sustituyentes electronegativos. La magnitud del efecto aceptor de electrones depende tanto de la naturaleza como del número de sustituyentes halógenos, como lo muestran los valores de p K a para varios derivados de ácido acético:
\[pK_a CH_3CO_2H 4.76< CH_2ClCO_2H 2.87<CHCl_2CO_2H 1.35<CCl_3CO_2H 0.66<CF_3CO_2H 0.52 \notag \]
Como cabría esperar, el flúor, que es más electronegativo que el cloro, provoca un efecto mayor que el cloro, y el efecto de tres halógenos es mayor que el efecto de dos o uno. Observe a partir de estos datos que los efectos inductivos pueden ser bastante grandes. Por ejemplo, reemplazar el grupo —CH 3 del ácido acético por un grupo —CF 3 da como resultado un aumento de aproximadamente 10,000 veces en la acidez!
Ejemplo 16.3.1
Organizar los compuestos de cada serie en orden de aumentar la fuerza ácida o base.
- ácido sulfúrico [H 2 SO 4, o (HO) 2 SO 2], ácido fluorosulfónico (FSO 3 H o FSO 2 OH) y ácido sulfuroso [H 2 SO 3, o (HO) 2 SO]
- amoníaco (NH 3), trifluoramina (NF 3) e hidroxilamina (NH 2 OH)
Aquí se muestran las estructuras.
Dado: serie de compuestos
Preguntado por: concentraciones relativas de ácido o base
Estrategia:
Usar fuerzas de unión relativas, la estabilidad de la base conjugada y efectos inductivos para organizar los compuestos en orden de tendencia creciente a ionizarse en solución acuosa.
Solución:
- Aunque tanto el ácido sulfúrico como el ácido sulfuroso tienen dos grupos —OH, el átomo de azufre en el ácido sulfúrico está unido a dos átomos de oxígeno terminales versus uno en el ácido sulfuroso. Debido a que el oxígeno es altamente electronegativo, el ácido sulfúrico es el ácido más fuerte porque la carga negativa en el anión se estabiliza por el átomo de oxígeno adicional. Al comparar el ácido sulfúrico y el ácido fluorosulfónico, observamos que el flúor es más electronegativo que el oxígeno. De esta manera, reemplazar un —OH por —F eliminará más densidad de electrones del átomo central de S, lo que, a su vez, eliminará la densidad electrónica del enlace S-OH y el enlace O—H. Debido a que su enlace O—H es más débil, FSO 3 H es un ácido más fuerte que el ácido sulfúrico. El orden previsto de las fuerzas ácidas dadas aquí se confirma por los valores medidos de p K a para estos ácidos:
\[pKa H_2SO_3 1.85<H_2SO_4^{−2} < FSO_3H−10 \notag \]
- Las estructuras tanto de la trifluoramina como de la hidroxilamina son similares a las del amoníaco. En la trifluoramina, todos los átomos de hidrógeno en NH 3 son reemplazados por átomos de flúor, mientras que en la hidroxilamina, un átomo de hidrógeno es reemplazado por OH. Reemplazar los tres átomos de hidrógeno por flúor retirará la densidad electrónica del N, haciendo que el par de electrones solitario en N esté menos disponible para enlazarse a un ion H +. Por lo tanto, se predice que NF 3 es una base mucho más débil que NH 3. De igual manera, debido a que el oxígeno es más electronegativo que el hidrógeno, reemplazar un átomo de hidrógeno en NH 3 por OH hará que la amina sea menos básica. Debido a que el oxígeno es menos electronegativo que el flúor y solo se reemplaza un átomo de hidrógeno, sin embargo, el efecto será menor. El orden previsto de aumento de la fuerza base que se muestra aquí se confirma por los valores medidos de p K b:
\[pK_bNF_3—<<NH_2OH 8.06<NH_3 4.75 \notag \]
La trifluoramina es una base tan débil que no reacciona con soluciones acuosas de ácidos fuertes. De ahí que no se haya medido su constante de ionización de bases.
Ejercicio
Organizar los compuestos de cada serie en orden de
- disminución de la fuerza ácida: H 3 PO 4, CH 3 PO 3 H 2 y HClO 3.
- aumentando la fuerza base: CH 3 S −, OH − y CF 3 S −.
Contestar
- HClO 3 > CH 3 PO 3 H 2 > H 3 PO 4
- CF 3 S − < CH 3 S − < OH −
Resumen
La fuerza ácido-base de una molécula depende fuertemente de su estructura. Cuanto más débil sea el enlace A—H o B—H +, más probable es que se disocie para formar un ion H +. Además, cualquier factor que estabilice al par solitario sobre la base conjugada favorece la disociación de H +, haciendo del ácido conjugado un ácido más fuerte. Los átomos o grupos de átomos en otras partes de una molécula también pueden ser importantes para determinar la fuerza de ácido o base a través de un efecto inductivo, que puede debilitar un enlace O-H y permitir que el hidrógeno se pierda más fácilmente como iones H +.
Llave para llevar
- Los efectos inductivos y la deslocalización de carga influyen significativamente en la acidez o basicidad de un compuesto.
Problemas conceptuales
-
En la sección 16.3 se presentaron varios factores que afectan las fuerzas relativas de ácidos y bases. Para cada par, identificar el factor más importante para determinar cuál es el ácido o base más fuerte en solución acuosa.
- CH 3 CCl 2 CH 2 CO 2 H frente a CH 3 CH 2 CH 2 CO 2 H
- CH 3 CO 2 H frente a CH 3 CH 2 OH
- HClO versus HBRo
- CH 3 C (=O) NH 2 frente a CH 3 CH 2 NH 2
- H 3 AsO 4 frente a H 3 AsO 3
-
La estabilidad de la base conjugada es un factor importante para determinar la fuerza de un ácido. ¿Cuál esperaría que fuera el ácido más fuerte en solución acuosa—C 6 H 5 NH 3 + o NH 4 +? Justifica tu razonamiento
-
Explique por qué H 2 Se es un ácido más débil que HBr.
-
Arregle lo siguiente en orden decreciente de fuerza ácida en solución acuosa: H 3 PO 4, CH 3 PO 3 H 2 y HClO 3.
-
Organice lo siguiente en orden de aumentar la fuerza base en solución acuosa: CH 3 S −, OH − y CF 3 S −.
-
Arregle lo siguiente en orden de aumentar la fuerza ácida en solución acuosa: HClO 2, HNO 2 y HNO 3.
-
¿Esperas que H 2 SO 3 o H 2 SeO 3 sea el ácido más fuerte? ¿Por qué?
-
Dar una explicación plausible de por qué CF 3 OH es un ácido más fuerte que CH 3 OH en solución acuosa. ¿Esperas que CHCl 2 CH 2 OH sea un ácido más fuerte o más débil que el CH 3 OH? ¿Por qué?
-
¿Espera que Cl 2 NH o NH 3 sea la base más fuerte en solución acuosa? ¿Por qué?
RESPUESTAS
-
CF 3 S − < CH 3 S − < OH − (base más fuerte)
-
NH 3; Los átomos de Cl retiran la densidad electrónica del N en Cl 2 NH.
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern