16.6: Búferes
- Page ID
- 78437
- Comprender cómo la adición de un ion común afecta la posición de un equilibrio ácido-base.
- Saber usar la ecuación de Henderson-Hasselbalch para calcular el pH de un tampón.
Buffers Soluciones que mantienen un pH relativamente constante cuando se agrega un ácido o una base. son soluciones que mantienen un pH relativamente constante cuando se agrega un ácido o una base. Por lo tanto, protegen, o “amortiguan”, otras moléculas en solución de los efectos del ácido o base añadidos. Los tampones contienen un ácido débil (HA) y su base conjugada (A −) o una base débil (B) y su ácido conjugado (BH +), y son de vital importancia para el correcto funcionamiento de los sistemas biológicos. De hecho, cada fluido biológico está tamponado para mantener su pH fisiológico.
El efecto común de iones
Para entender cómo funcionan los tampones, veamos primero cómo se ve afectado el equilibrio de ionización de un ácido débil al agregar ya sea la base conjugada del ácido o un ácido fuerte (una fuente de H +). El principio de Le Chatelier se puede utilizar para predecir el efecto sobre la posición de equilibrio de la solución.
Un tampón típico utilizado en los laboratorios de bioquímica contiene ácido acético y una sal como el acetato de sodio. Recordemos que la reacción de disociación del ácido acético es la siguiente:
\[CH_3CO_2H_{(aq)} \leftrightharpoons CH_3CO^−_{(aq)}+H^+_{(aq)} \tag{16.6.1}\]
y la expresión constante de equilibrio es la siguiente:
\[K_a=\dfrac{[H^+][CH_3CO_2]}{[CH_3CO_2H]} \tag{16.6.2}\]
El acetato de sodio (CH 3 CO 2 Na) es un electrolito fuerte que se ioniza completamente en solución acuosa para producir iones Na + y CH 3 CO 2 −. Si se agrega acetato de sodio a una solución de ácido acético, el principio de Le Chatelier predice que el equilibrio en la Ecuación 16.6 .1 se desplazará hacia la izquierda, consumiendo parte del CH 3 CO 2 agregado − y algunos de los iones H + originalmente presentes en solución:
Debido a que Na + es un ion espectador, no tiene ningún efecto sobre la posición del equilibrio y puede ser ignorado. La adición de acetato de sodio produce una nueva composición de equilibrio, en la que [H +] es menor que el valor inicial. Debido a que [H +] ha disminuido, el pH será mayor. Así, agregar una sal de la base conjugada a una solución de un ácido débil aumenta el pH. Esto tiene sentido porque el acetato de sodio es una base, y agregar cualquier base a una solución de un ácido débil debería aumentar el pH.
Si en cambio agregamos un ácido fuerte como HCl al sistema, [H +] aumenta. Una vez más el equilibrio se altera temporalmente, pero el exceso de iones H + reaccionan con la base conjugada (CH 3 CO 2 −), ya sea del ácido parental o del acetato de sodio, para conducir el equilibrio hacia la izquierda. El resultado neto es una nueva composición de equilibrio que tiene un [CH 3 CO 2 −] menor que antes. En ambos casos, solo ha cambiado la composición de equilibrio; la constante de ionización K a para el ácido acético sigue siendo la misma. Agregar un electrolito fuerte que contiene un ion en común con un sistema de reacción que está en equilibrio, en este caso CH 3 CO 2 −, desplazará por lo tanto el equilibrio en la dirección que reduzca la concentración del ión común. El cambio en equilibrio se llama el efecto ion común El desplazamiento en equilibrio que resulta cuando se agrega al sistema un electrolito fuerte que contiene un ion en común con un sistema de reacción que está en equilibrio. .
Tenga en cuenta el patrón
Agregar un ion común a un sistema en equilibrio afecta la composición de equilibrio pero no la constante de ionización.
Ejemplo 16.6.1
En la Sección 16.4, calculamos que una solución 0.150 M de ácido fórmico a 25°C (p K a = 3.75) tiene un pH de 2.28 y está ionizada al 3.5%.
- ¿Hay algún cambio en el pH de la solución si se agrega suficiente formiato de sodio sólido para hacer que la concentración final de formiato sea 0.100 M (supongamos que la concentración de ácido fórmico no cambia)?
- ¿Qué porcentaje del ácido fórmico se ioniza si se agrega HCl 0.200 M al sistema?
Dado: concentración de solución y pH, p K a, y porcentaje de ionización de ácido; concentración final de base conjugada o ácido fuerte agregado
Preguntado por: pH y porcentaje de ionización de ácido fórmico
Estrategia:
A Escribir una ecuación de equilibrio equilibrado para el equilibrio de ionización del ácido fórmico. Tabular las concentraciones iniciales, los cambios y las concentraciones finales.
B Sustituir las expresiones por las concentraciones finales en la expresión por K a. Calcular [H +] y el pH de la solución.
C Construir una tabla de concentraciones para la disociación de ácido fórmico. Para determinar el porcentaje de ionización, determinar la concentración de aniones, dividirla por la concentración inicial de ácido fórmico y multiplicar el resultado por 100.
Solución:
- A Debido a que el formiato de sodio es un electrolito fuerte, se ioniza completamente en solución para dar formiato e iones de sodio. Los iones Na + son iones espectadores, por lo que pueden ser ignorados en la ecuación de equilibrio. Debido a que el agua es tanto un ácido mucho más débil que el ácido fórmico como una base mucho más débil que el formiato, las propiedades ácido-base de la solución están determinadas únicamente por el equilibrio de ionización del ácido fórmico:
\[HCO_2H_{(aq)} \leftrightharpoons HCO^−_{2(aq)}+H^+_{(aq)} \notag \]
Se pueden tabular las concentraciones iniciales, los cambios de concentración que se producen a medida que se alcanza el equilibrio y las concentraciones finales.
\[HCO_2H_{(aq)} \leftrightharpoons HCO^−_{2(aq)}+H^+_{(aq)}\] [HCO 2 H] [H +] [HCO 2 −] \ [HCO_2H_ {(aq)}\ leftrightharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\]” class="lt-chem-349758">inicial \ [HCO_2H_ {(aq)}\ izquierdatharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\] [HCO2H]” class="lt-chem-349758">0.150 \ [HCO_2H_ {(aq)}\ izquierdatharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\] [H+]” class="lt-chem-349758">1.00 × 10 −7 \ [HCO_2H_ {(aq)}\ izquierdatharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\] [HCO2−]” class="lt-chem-349758">0.100 \ [HCO_2H_ {(aq)}\ leftrightharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\]” class="lt-chem-349758">cambiar \ [HCO_2H_ {(aq)}\ izquierdatharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\] [HCO2H]” class="lt-chem-349758">− x \ [HCO_2H_ {(aq)}\ izquierdatharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\] [H+]” class="lt-chem-349758">+ x \ [HCO_2H_ {(aq)}\ izquierdatharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\] [HCO2−]” class="lt-chem-349758">+ x \ [HCO_2H_ {(aq)}\ leftrightharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\]” class="lt-chem-349758">final \ [HCO_2H_ {(aq)}\ izquierdatharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\] [HCO2H]” class="lt-chem-349758"> (0.150 − x) \ [HCO_2H_ {(aq)}\ izquierdatharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\] [H+]” class="lt-chem-349758"> x \ [HCO_2H_ {(aq)}\ izquierdotharpoons HCO^−_ {2 (aq)} +H^+_ {(aq)}\] [HCO2−]” class="lt-chem-349758"> (0.100 + x) B Sustituimos las expresiones por las concentraciones finales en la expresión constante de equilibrio y hacemos nuestras suposiciones simplificadoras habituales, por lo que
\[ K_{a} = \dfrac{[H^{+}][HCO_2^{-}]}{[HCO_2H]}=\dfrac{\left ( x \right )\left (0.100+x \right )}{0.150+x}\approx \dfrac{x(0.100)}{0.150}=10^{-3.75}= 1.8 \times 10^{-4} \notag \]Reorganización y solución para x,
\[x=(1.80 \times 10^{-4}) \times \dfrac{ 0.150\; M}{ 0.200\; M}=1.35 \times 10^{-4}=[HCO_2^{-}] \notag \]El valor de x es pequeño comparado con 0.150 o 0.100 M, por lo que nuestra suposición sobre el grado de ionización está justificada. Además, K a C HA = (1.8 × 10 −4) (0.150) = 2.7 × 10 −5, que es mayor a 1.0 × 10 −6, así que nuevamente, nuestra suposición está justificada. El pH final es −log (2.7 × 10 −4) = 3.57, comparado con el valor inicial de 2.29. Así, la adición de una sal que contiene la base conjugada del ácido ha aumentado el pH de la solución, como esperamos con base en el principio de Le Chatelier; la tensión sobre el sistema se ha aliviado por el consumo de iones H +, conduciendo el equilibrio hacia la izquierda.
- C Debido a que el HCl es un ácido fuerte, se ioniza completamente, y el cloruro es un ion espectador que se puede descuidar. Así, el único equilibrio ácido-base relevante es nuevamente la disociación del ácido fórmico, e inicialmente la concentración de formiato es cero. Podemos construir una tabla de concentraciones iniciales, cambios en la concentración y concentraciones finales.
\[HCO_2H_{(aq)} \leftrightharpoons H^+_{(aq)}+HCO^−_{2(aq)}\] [HCO 2 H] [H +] [HCO 2 −] \ [HCO_2H_ {(aq)}\ leftrightharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\]” class="lt-chem-349758">inicial \ [HCO_2H_ {(aq)}\ izquierdatharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\] [HCO2H]” class="lt-chem-349758">0.150 \ [HCO_2H_ {(aq)}\ izquierdotharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\] [H+]” class="lt-chem-349758">0.200 \ [HCO_2H_ {(aq)}\ izquierdotharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\] [HCO2−]” class="lt-chem-349758">0 \ [HCO_2H_ {(aq)}\ leftrightharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\]” class="lt-chem-349758">cambiar \ [HCO_2H_ {(aq)}\ izquierdatharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\] [HCO2H]” class="lt-chem-349758">− x \ [HCO_2H_ {(aq)}\ izquierdatharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\] [H+]” class="lt-chem-349758">+ x \ [HCO_2H_ {(aq)}\ izquierdotharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\] [HCO2−]” class="lt-chem-349758">+ x \ [HCO_2H_ {(aq)}\ leftrightharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\]” class="lt-chem-349758">final \ [HCO_2H_ {(aq)}\ izquierdotharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\] [HCO2H]” class="lt-chem-349758"> (0.150 − x) \ [HCO_2H_ {(aq)}\ izquierdotharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\] [H+]” class="lt-chem-349758"> (0.200 + x) \ [HCO_2H_ {(aq)}\ izquierdotharpoons H^+_ {(aq)} +HCO^−_ {2 (aq)}\] [HCO2−]” class="lt-chem-349758"> x Para calcular el porcentaje de ácido fórmico que se ioniza bajo estas condiciones, tenemos que determinar el [HCO 2 −] final. Sustituimos las concentraciones finales en la expresión constante de equilibrio y hacemos las suposiciones simplificadoras habituales, por lo que
\[Ka=\dfrac{[H^+][HCO_2^−]}{[HCO_2H]}=\dfrac{(0.200+x)(x)}{0.150−x} \approx \dfrac{x(0.200)}{0.150}=1.80 \times 10^{−4} \notag \]Reorganización y solución para x,
\[x=(1.80 \times 10^{−4}) \times \dfrac{ 0.150\; M}{ 0.200\; M}=1.35 \times 10^{−4}=[HCO_2^−] \notag \]Una vez más, nuestros supuestos simplificadores están justificados. El porcentaje de ionización del ácido fórmico es el siguiente:
\(\text{percent ionization}=\dfrac{1.35 \times 10^{−4} \;M} {0.150\; M} \times 100%=0.0900% \)Al agregar el ácido fuerte a la solución, como se muestra en la tabla, se disminuyó el porcentaje de ionización del ácido fórmico en un factor de aproximadamente 38 (3.45%/0.0900%). Nuevamente, esto es consistente con el principio de Le Chatelier: agregar iones H + impulsa el equilibrio de disociación hacia la izquierda.
Ejercicio
Como aprendió en el Ejemplo 8, una solución 0.225 M de etilamina (CH 3 CH 2 NH 2, p K b = 3.19) tiene un pH de 12.08 y un porcentaje de ionización de 5.4% a 20°C.Calcule lo siguiente:
- el pH de la solución si se agrega suficiente clorhidrato de etilamina sólido (EtNH 3 Cl) para hacer la solución 0.100 M en EtNH 3 +
- el porcentaje de etilamina que se ioniza si se agrega suficiente NaOH sólido a la solución original para dar una concentración final de NaOH 0.050 M
Contestar
- 11.16
- 1.3%
Ahora supongamos que tenemos una solución tampón que contiene concentraciones equimolares de una base débil (B) y su ácido conjugado (BH +). La ecuación general para la ionización de una base débil es la siguiente:
\[B_{(aq)}+H_2O_{(l)} \leftrightharpoons BH^+_{(aq)}+OH^−_{(aq)} \tag{16.6.3} \]
Si la constante de equilibrio para la reacción como está escrita en la Ecuación 16.6.3 es pequeña, por ejemplo K b = 10 −5, entonces la constante de equilibrio para la reacción inversa es muy grande: K = 1/ K b = 10 5. Por lo tanto, agregar una base fuerte como OH − a la solución hace que el equilibrio en la Ecuación 16.6.3 se desplace hacia la izquierda, consumiendo el OH − agregado. Como resultado, la concentración de iones OH − en solución permanece relativamente constante, y el pH de la solución cambia muy poco. El principio de Le Chatelier predice el mismo resultado: cuando el sistema está estresado por un aumento en la concentración de iones OH −, la reacción procederá a la izquierda para contrarrestar el estrés.
Si el p K b de la base es 5.0, el p K a de su ácido conjugado es p K a = p K w − p K b = 14.0 — 5.0 = 9.0. Así, la constante de equilibrio para la ionización del ácido conjugado es incluso menor que la de la ionización de la base. La reacción de ionización para el ácido conjugado de una base débil se escribe de la siguiente manera:
\[BH^+_{(aq)}+H_2O_{(l)} \leftrightharpoons B_{(aq)}+H_3O^+_{(aq)} \tag{16.6.4}\]
Nuevamente, la constante de equilibrio para el reverso de esta reacción es muy grande: K = 1/ K a = 10 9. Si se agrega un ácido fuerte, se neutraliza por reacción con la base ya que la reacción en la Ecuación 16.6.4 se desplaza hacia la izquierda. Como resultado, la concentración de iones H + no aumenta mucho, y el pH cambia solo ligeramente. En efecto, una solución tampón se comporta algo como una esponja que puede absorber iones H + y OH −, evitando así grandes cambios en el pH cuando se agregan cantidades apreciables de ácido o base fuerte a una solución.
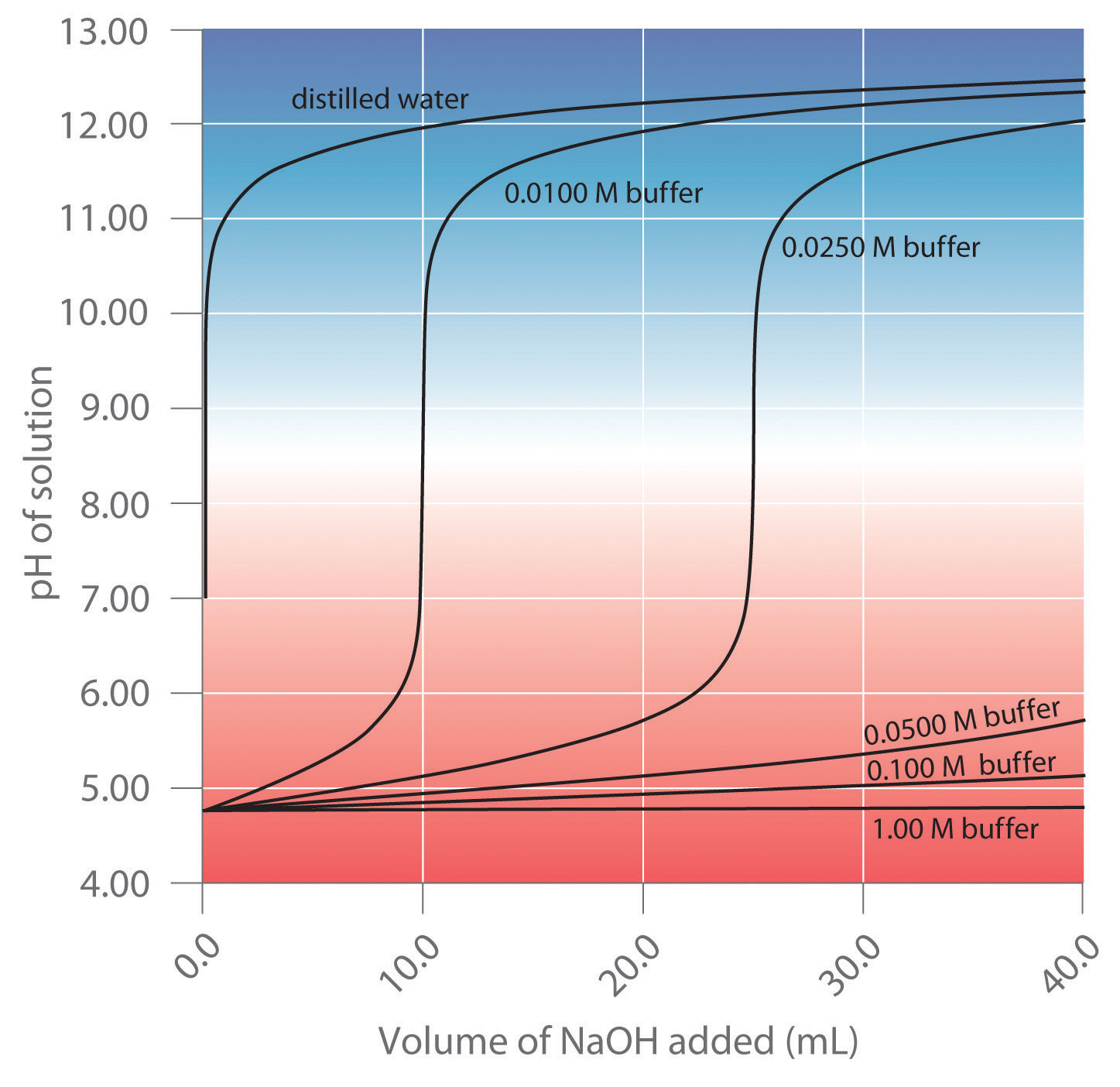
Los tampones se caracterizan por el rango de pH sobre el cual pueden mantener un pH más o menos constante y por su capacidad tampón La cantidad de ácido fuerte o base fuerte que una solución tampón puede absorber antes de que el pH cambie drásticamente. , la cantidad de ácido o base fuerte que se puede absorber antes de que el pH cambie significativamente. Aunque el rango de pH útil de un tampón depende fuertemente de las propiedades químicas del ácido débil y la base débil utilizados para preparar el tampón (es decir, de K), su capacidad de tampón depende únicamente de las concentraciones de las especies en la solución tamponada. Cuanto más concentrada esté la solución tampón, mayor será su capacidad tampón. Como se ilustra en la Figura 16.6.1, cuando se agrega NaOH a soluciones que contienen diferentes concentraciones de un tampón de ácido acético/acetato de sodio, el cambio observado en el pH del tampón es inversamente proporcional a la concentración del tampón. Si la capacidad del tampón es 10 veces mayor, entonces la solución tampón puede absorber 10 veces más ácido o base fuerte antes de sufrir un cambio significativo en el pH.
Figura 16.6.1 Efecto de la concentración de tampón sobre la capacidad de un tampón Un tampón mantiene un pH relativamente constante cuando se agrega ácido o base a una solución. La adición de volúmenes incluso pequeños de NaOH 0.10 M a 100.0 mL de agua destilada da como resultado un cambio muy grande en el pH. A medida que la concentración de una mezcla 50:50 de tampón de acetato de sodio/ácido acético en la solución se incrementa de 0.010 M a 1.00 M, el cambio en el pH producido por la adición del mismo volumen de solución de NaOH disminuye de manera constante. Para concentraciones de tampón de al menos 0.500 M, la adición de incluso 25 mL de la solución de NaOH da como resultado un cambio relativamente pequeño en el pH.
Cálculo del pH de un Buffer
El pH de un tampón se puede calcular a partir de las concentraciones del ácido débil y la base débil utilizada para prepararlo, la concentración de la base conjugada y el ácido conjugado, y la p K a o p K b del ácido débil o base débil. El procedimiento es análogo al utilizado en el Ejemplo 14 para calcular el pH de una solución que contiene concentraciones conocidas de ácido fórmico y formiato.
Un método alternativo frecuentemente utilizado para calcular el pH de una solución tampón se basa en un reordenamiento de la ecuación de equilibrio para la disociación de un ácido débil. La reacción de ionización simplificada es HA H + A − para la cual la expresión constante de equilibrio es la siguiente:
Esta ecuación se puede reorganizar de la siguiente manera:
\[[H^+]=K_a\dfrac{[HA]}{[A^−]} \tag{16.6.6}\]
Tomando el logaritmo de ambos lados y multiplicando ambos lados por −1,
\[−\log[H^+]=−\log K_a−\log\left(\dfrac{[HA]}{[A^−]}\right)=−\log{K_a}+\log\left(\dfrac{[A^−]}{[HA]}\right) \tag{16.6.7}\]
Sustitución de los logaritmos negativos en la Ecuación 16.60,
\[pH=pK_a+\log \left( \dfrac{[A^−]}{[HA]} \right) \tag{16.6.8}\]
o, de manera más general,
\[pH=pK_a+\log\left(\dfrac{[base]}{[acid]}\right) \tag{16.6.9}\]
La Ecuación 16.6.8 y la Ecuación 16.6.9 son ambas formas de la ecuación de Henderson-Hasselbalch Una versión rearreglada de la expresión constante de equilibrio que proporciona una forma directa de calcular el pH de una solución tampón: pH = pK a + log ([ base]/[ácido]). , que lleva el nombre de los dos químicos de principios del siglo XX que notaron por primera vez que esta versión reorganizada de la expresión constante de equilibrio proporciona una manera fácil de calcular el pH de una solución tampón. En general, la validez de la ecuación de Henderson-Hasselbalch puede limitarse a soluciones cuyas concentraciones sean al menos 100 veces mayores que sus valores de K a.
Hay tres casos especiales en los que la ecuación de Henderson-Hasselbalch se interpreta fácilmente sin necesidad de cálculos:
- [base] = [ácido]. En estas condiciones, [base]/[ácido] = 1 en la Ecuación 16.6.9. Porque log 1 = 0, pH = p K a, independientemente de las concentraciones reales del ácido y la base. Recordemos de la Sección 16.5 que esto corresponde al punto medio en la titulación de un ácido débil o una base débil.
- [base]/[ácido] = 10. En la Ecuación 16.6.9, porque log 10 = 1, pH = p K a + 1.
- [base]/[ácido] = 100. En la Ecuación 16.6.9, porque log 100 = 2, pH = p K a + 2.
Cada vez que aumentamos la relación [base]/[ácido] en 10, el pH de la solución aumenta en 1 unidad de pH. Por el contrario, si la relación [base]/[ácido] es 0.1, entonces pH = p K a − 1. Cada disminución adicional del factor de 10 en la relación [base]/[ácido] hace que el pH disminuya en 1 unidad de pH.
Tenga en cuenta el patrón
Si [base] = [ácido] para un tampón, entonces pH = p K a. Cambiar esta relación por un factor de 10 de cualquier manera cambia el pH en ±1 unidad.
Ejemplo 16.6.2
¿Cuál es el pH de una solución que contiene
- 0.135 M HCO 2 H y 0.215 M HCO 2 Na? (El p K a del ácido fórmico es 3.75.)
- 0.0135 M HCO 2 H y 0.0215 M HCO 2 Na?
- ¿Piridina 0.119 M y clorhidrato de piridina 0.234 M? (El p K b de piridina es 8.77.)
Dado: concentración de ácido, base conjugada y p K a; concentración de base, ácido conjugado y p K b
Preguntado por: pH
Estrategia:
Sustituir los valores en cualquiera de las formas de la ecuación de Henderson-Hasselbalch (Ecuación 16.61 o Ecuación 16.62) para calcular el pH.
Solución:
- Según la ecuación de Henderson-Hasselbalch, el pH de una solución que contiene tanto un ácido débil como su base conjugada es pH = p K a + log ([A −]/[HA]). Insertando los valores dados en la ecuación,
\[pH=3.75+\log\left(\dfrac{0.215}{0.135}\right)=3.75+\log 1.593=3.95 \notag \]
Este resultado tiene sentido porque la relación [A −]/[HA] está entre 1 y 10, por lo que el pH del tampón debe estar entre el p K a (3.75) y p K a + 1, o 4.75.
- Esto es idéntico a la parte (a), excepto por las concentraciones del ácido y la base conjugada, que son 10 veces menores. Insertar las concentraciones en la ecuación de Henderson-Hasselbalch,
\[pH=3.75+\log\left(\dfrac{0.0215}{0.0135}\right)=3.75+\log 1.593=3.95 \notag \]
Este resultado es idéntico al resultado de la parte (a), que enfatiza el punto de que el pH de un tampón depende únicamente de la relación de las concentraciones de la base conjugada y el ácido, no de la magnitud de las concentraciones. Debido a que la relación [A −]/[HA] es la misma que en la parte (a), el pH del tampón también debe ser el mismo (3.95).
- En este caso, tenemos una base débil, piridina (Py), y su ácido conjugado, el ion piridinio (HPy +). Por lo tanto, utilizaremos la Ecuación 16.62, la forma más general de la ecuación de Henderson-Hasselbalch, en la que “base” y “ácido” se refieren a las especies apropiadas del par ácido — base conjugado. Se nos da [base] = [Py] = 0.119 M y [ácido] = [HPy +] = 0.234 M. También se nos da p K b = 8.77 para piridina, pero necesitamos p K a para el ion piridinio. Recordemos de la Ecuación 16.2.10 que el p K b de una base débil y el p K a de su ácido conjugado están relacionados: p K a + p K b = p K w. Así, p K a para el ion piridinio es p K w − p K b = 14.00 − 8.77 = 5.23. Sustituyendo este valor p K a en la ecuación de Henderson-Hasselbalch,
\[pH=pK_a+\log\left(\dfrac{[base]}{[acid]}\right)=5.23+\log\left(\dfrac{0.119}{0.234}\right)=5.23 −0.294=4.94 \notag \]
Una vez más, este resultado tiene sentido: la relación [B]/[BH +] es aproximadamente 1/2, que está entre 1 y 0.1, por lo que el pH final debe estar entre la p K a (5.23) y p K a − 1, o 4.23.
Ejercicio
¿Cuál es el pH de una solución que contiene
- ¿Ácido benzoico 0.333 M y benzoato de sodio 0.252 M?
- ¿0.050 M de trimetilamina y 0.066 M de clorhidrato de trimetilamina?
El p K a del ácido benzoico es 4.20, y el p K b de trimetilamina también es 4.20.
Contestar
- 4.08
- 9.68
La ecuación de Henderson-Hasselbalch también se puede utilizar para calcular el pH de una solución tampón después de agregar una cantidad dada de ácido fuerte o base fuerte, como se demuestra en el Ejemplo 16.
Ejemplo 16.6.3
La solución tampón del Ejemplo 15 contenía 0.135 M de HCO 2 H y 0.215 M de HCO 2 Na y tuvo un pH de 3.95.
- ¿Cuál es el pH final si se agregan 5.00 mL de HCl 1.00 M a 100 mL de esta solución?
- ¿Cuál es el pH final si se agregan 5.00 mL de NaOH 1.00 M?
Dado: composición y pH del tampón; concentración y volumen de ácido o base añadidos
Preguntado por: pH final
Estrategia:
A Calcular las cantidades de ácido fórmico y formiato presentes en la solución tampón utilizando el procedimiento del Ejemplo 14. Después calcula la cantidad de ácido o base añadida.
B Construir una tabla que muestre las cantidades de todas las especies después de la reacción de neutralización. Utilizar el volumen final de la solución para calcular las concentraciones de todas las especies. Finalmente, sustituya los valores apropiados en la ecuación de Henderson-Hasselbalch (Ecuación 16.6.9) para obtener el pH.
Solución:
El HCl agregado (un ácido fuerte) o NaOH (una base fuerte) reaccionará completamente con formiato (una base débil) o ácido fórmico (un ácido débil), respectivamente, para dar ácido fórmico o formiato y agua. Por lo tanto, debemos calcular las cantidades de ácido fórmico y formiato presentes después de la reacción de neutralización.
- A Comenzamos calculando los milimoles de ácido fórmico y formiato presentes en 100 mL del tampón inicial pH 3.95: \[ 100\; \cancel{mL}\left ( \dfrac{0.135 \; mmol\; HCO_2H}{\cancel{mL}} \right )=13.5 \; mmol\; HCO_2H \notag \]
\[ 100\; \cancel{mL}\left ( \dfrac{0.215 \; mmol\; HCO_2^{-}}{\cancel{mL}} \right )=21.5 \; mmol\; HCO_2^{-} \notag \]
Los milimoles de H + en 5.00 mL de HCl 1.00 M son los siguientes:
\[ 5.00\; \cancel{mL}\left ( \dfrac{1.00 \; mmol\; H^{+}}{\cancel{mL}} \right )=5.00 \; mmol\; H^{+} \notag \]
B A continuación, construimos una tabla de montos iniciales, cambios en los montos y montos finales:
\[HCO^{2−}_{(aq)} + H^+_{(aq)} \rightarrow HCO_2H_{(aq)} \notag \]
| HCO 2 − (aq) + H + (aq) → HCO 2 H (aq) | |||
|---|---|---|---|
| [HCO 2 −] | [H +] | [HCO 2 H] | |
| inicial | 21.5 mmol | 5.00 mmol | 13.5 mmol |
| cambiar | −5.00 mmol | −5.00 mmol | +5.00 mmol |
| final | 16.5 mmol | ∼0 mmol | 18.5 mmol |
La cantidad final de H + en solución se da como “∼0 mmol”. A los efectos del cálculo estequiométrico, esto es esencialmente cierto, pero recuerde que el punto del problema es calcular el [H +] final y así el pH. Ahora tenemos toda la información que necesitamos para calcular el pH. Podemos usar el largo procedimiento del Ejemplo 14 o la ecuación de Henderson—Hasselbach. Debido a que hemos realizado muchos cálculos de equilibrio en este capítulo, tomaremos este último enfoque. La ecuación de Henderson-Hasselbalch requiere las concentraciones de HCO 2 − y HCO 2 H, las cuales se pueden calcular utilizando el número de milimoles (n) de cada uno y el volumen total (V T). Sustituyendo estos valores en la ecuación de Henderson-Hasselbalch,
\[pH=pK_a+\log \left( \dfrac{[HCO_2^−]}{[HCO_2H]} \right)=pK_a+\log\left(\dfrac{n_{HCO_2^−}/V_f}{n_{HCO_2H}/V_f}\right)=pK_a+\log \left(\dfrac{n_{HCO_2^−}}{n_{HCO_2H}}\right) \notag \]
Debido a que el volumen total aparece tanto en el numerador como en el denominador, se cancela. Por lo tanto, necesitamos usar solo la relación entre el número de milimoles de la base conjugada y el número de milimoles del ácido débil. Entonces
\[pH=pK_a+\log\left(\dfrac{n_{HCO_2^−}}{n_{HCO_2H}}\right)=3.75+\log\left(\dfrac{16.5\; mmol}{18.5\; mmol}\right)=3.75 −0.050=3.70 \notag \]
Una vez más, este resultado tiene sentido en dos niveles. En primer lugar, la adición de HCl ha disminuido el pH de 3.95, como se esperaba. En segundo lugar, la relación de HCO 2 − a HCO 2 H es ligeramente inferior a 1, por lo que el pH debe estar entre el p K a y p K a − 1.
- A El procedimiento para resolver esta parte del problema es exactamente el mismo que el utilizado en la parte (a). Ya se han calculado los números de milimoles de ácido fórmico y formiato en 100 mL del tampón inicial pH 3.95:13.5 mmol de HCO 2 H y 21.5 mmol de HCO 2 −. El número de milimoles de OH − en 5.00 mL de NaOH 1.00 M es el siguiente:
\[ 5.00\; \cancel{mL}\left ( \dfrac{1.00 \; mmol\; H^{+}}{\cancel{mL}} \right )=5.00 \; mmol\; H^{+} \notag \]
B Con esta información, podemos construir una tabla de montos iniciales, cambios en los montos y montos finales.
HCO 2 H (aq) + OH − (aq) → HCO 2 − (aq) + H 2 O (l) [HCO 2 H] [OH −] [HCO 2 −] inicial 13.5 mmol 5.00 mmol 21.5 mmol cambiar −5.00 mmol −5.00 mmol +5.00 mmol final 8.5 mmol ∼0 mmol 26.5 mmol La cantidad final de OH − en solución no es realmente cero; esto es solo aproximadamente cierto basado en el cálculo estequiométrico. Podemos calcular el pH final insertando los números de milimoles tanto de HCO 2 − como de HCO 2 H en la expresión simplificada de Henderson-Hasselbalch utilizada en la parte (a) porque el volumen cancela:
\[pH=pK_a+\log \left(\dfrac{n_{HCO_2^−}}{n_{HCO_2H}}\right)=3.75+\log \left(\dfrac{26.5\; mmol}{8.5\; mmol} \right)=3.75+0.494=4.24 \notag \]Una vez más, este resultado tiene sentido químico: el pH ha aumentado, como se esperaría después de agregar una base fuerte, y el pH final está entre el p K a y p K a + 1, como se esperaba para una solución con un HCO 2 − /HCO 2 H relación entre 1 y 10.
Ejercicio
La solución tampón del Ejemplo 15 contenía piridina 0.119 M y clorhidrato de piridina 0.234 M y tuvo un pH de 4.94.
- ¿Cuál es el pH final si se agregan 12.0 mL de NaOH 1.5 M a 250 mL de esta solución?
- ¿Cuál es el pH final si se agregan 12.0 mL de 1.5 M HCl?
Contestar
- 5.30
- 4.42
Tenga en cuenta el patrón
Solo se necesitan las cantidades (en moles o milimoles) de los componentes ácidos y básicos del tampón para usar la ecuación de Henderson-Hasselbalch, no sus concentraciones.
Tenga en cuenta el patrón
Los tampones más efectivos contienen concentraciones iguales de un ácido y su base conjugada.
Los resultados obtenidos en el Ejemplo 16 y su ejercicio correspondiente demuestran lo poco que cambia el pH de una solución tampón bien elegida a pesar de la adición de una cantidad significativa de ácido fuerte o base fuerte. Supongamos que habíamos agregado la misma cantidad de solución de HCl o NaOH a 100 mL de una solución no tamponada a pH 3.95 (correspondiente a 1.1 × 10 −4 M HCl). En este caso, agregar 5.00 mL de HCl 1.00 M reduciría el pH final a 1.32 en lugar de 3.70, mientras que agregar 5.00 mL de NaOH 1.00 M elevaría el pH final a 12.68 en lugar de 4.24. (Intente verificar estos valores haciendo los cálculos usted mismo). Así, la presencia de un tampón aumenta significativamente la capacidad de una solución para mantener un pH casi constante.
Un tampón que contiene cantidades aproximadamente iguales de un ácido débil y su base conjugada en solución es igualmente eficaz para neutralizar la base añadida o el ácido agregado. Esto se muestra en la Figura 16.6.2 para un tampón de ácido acético/acetato de sodio. Agregar una cantidad dada de ácido fuerte desplaza el sistema a lo largo del eje horizontal hacia la izquierda, mientras que agregar la misma cantidad de base fuerte desplaza el sistema la misma distancia hacia la derecha. En cualquier caso, el cambio en la relación de CH 3 CO 2 − a CH 3 CO 2 H de 1:1 reduce la capacidad de búfer de la solución.
Figura 16.6.2 Curva de distribución que muestra la fracción de moléculas de ácido acético e iones acetato en función del pH en una solución de ácido acético El rango de pH sobre el cual el sistema ácido acético/acetato de sodio es un tampón efectivo (la región sombreada más oscura) corresponde a la región en cuyas concentraciones apreciables de ambas especies están presentes (pH 3.76—5.76, correspondiente a pH = p K a ± 1).
La relación entre titulaciones y búferes
Existe una fuerte correlación entre la efectividad de una solución tampón y las curvas de titulación discutidas en la Sección 16.5. Considere la curva de titulación esquemática de un ácido débil con una base fuerte que se muestra en la Figura 16.6.3. Como indican las etiquetas, la región alrededor de p K a corresponde al punto medio de la titulación, cuando aproximadamente la mitad del ácido débil ha sido neutralizado. Esta porción de la curva de titulación corresponde a un tampón: exhibe el menor cambio en el pH por incremento de base fuerte añadida, como lo demuestra la naturaleza casi horizontal de la curva en esta región. La porción casi plana de la curva se extiende solo desde aproximadamente un valor de pH de 1 unidad menor que el p K a aproximadamente un valor de pH de 1 unidad mayor que el p K a, razón por la cual las soluciones tampón suelen tener un pH que está dentro de ±1 unidades de pH de la p K a del componente ácido del tampón.
Figura 16.6.3 La relación entre las curvas de titulación y los tampones Esta gráfica esquemática del pH para la valoración de un ácido débil con una base fuerte muestra la región casi plana de la curva de titulación alrededor del punto medio, lo que corresponde a la formación de un tampón. En la parte inferior izquierda, el pH de la solución está determinado por el equilibrio para la disociación del ácido débil; en la parte superior derecha, el pH está determinado por el equilibrio para la reacción de la base conjugada con agua.
En la región de la curva de titulación en la parte inferior izquierda, antes del punto medio, las propiedades ácido-base de la solución están dominadas por el equilibrio para la disociación del ácido débil, correspondiente a K a. En la región de la curva de titulación en la parte superior derecha, después del punto medio, las propiedades ácido-base de la solución están dominadas por el equilibrio para la reacción de la base conjugada del ácido débil con agua, correspondiente a K b. Sin embargo, podemos calcular K a o K b del otro porque están relacionados por K w.
Sangre: Un Buffer Lo Más Importante
Los procesos metabólicos producen grandes cantidades de ácidos y bases, pero los organismos son capaces de mantener un pH interno casi constante porque sus fluidos contienen tampones. Esto no quiere decir que el pH sea uniforme en todas las células y tejidos de un mamífero. El pH interno de un glóbulo rojo es de aproximadamente 7.2, pero el pH de la mayoría de los otros tipos de células es menor, alrededor de 7.0. Incluso dentro de una sola celda, diferentes compartimentos pueden tener valores de pH muy diferentes. Por ejemplo, un compartimento intracelular en los glóbulos blancos tiene un pH de alrededor de 5.0.
Debido a que ningún sistema de tampón único puede mantener efectivamente un valor de pH constante en todo el rango fisiológico de aproximadamente pH 5.0 a 7.4, los sistemas bioquímicos utilizan un conjunto de tampones con rangos superpuestos. El más importante de estos es el sistema CO 2 /HCO 3 −, que domina la acción amortiguadora del plasma sanguíneo.
El equilibrio ácido-base en el sistema de búfer CO 2 /HCO 3 − generalmente se escribe de la siguiente manera:
\[H_2CO_{3(aq)} \leftrightharpoons H^+_{(aq)}+HCO^−_{3(aq)} \tag{16.6.10}\]
con K a = 4.5 × 10 −7 y p K a = 6.35 a 25°C. De hecho, la Ecuación 16.6.10 es una versión excesivamente simplificada del sistema CO 2 /HCO 3 − porque una solución de CO 2 en agua contiene solo cantidades bastante pequeñas de H 2 CO 3. Por lo tanto, la Ecuación 16.6.10 no permite entender cómo la sangre está realmente tamponada, particularmente a una temperatura fisiológica de 37°C. Como se muestra en la Ecuación 16.6.11, el CO 2 está en equilibrio con H 2 CO 3, pero el equilibrio se encuentra lejos del izquierda, con una relación H 2 CO 3 /CO 2 menor de 0.01 en la mayoría de las condiciones:
\[CO_{2(aq)}+H_2O_{(l)} \leftrightharpoons H_2CO_{3(aq)} \tag{16.6.11}\]
con K ′ = 4.0 × 10 −3 a 37°C. La verdadera p K a del ácido carbónico a 37°C es por lo tanto de 3.70, no de 6.35, correspondiente a una K a de 2.0 × 10 −4, lo que lo convierte en un ácido mucho más fuerte de lo que sugiere la Ecuación 16.6.10. La adición de la Ecuación 16.6.10 y la Ecuación 16.6.11 y la cancelación de H 2 CO 3 de ambos lados dan la siguiente ecuación general para la reacción de CO 2 con agua para dar un protón y el ion bicarbonato:
\[CO_{2(aq)}+H_2O_{(l)} \leftrightharpoons H_2CO_{3(aq)}\tag{16.6.12a}\]
con\(K'=4.0 \times 10^{−3} (37°C)\)
\[ H_2CO_{3(aq)} \leftrightharpoons H^+_{(aq)} + HCO^−_{3(aq)}\tag{16.6.12b}\]
con\(K_a=2.0 \times 10^{−4} (37°C) \)
\[CO_{2(aq)}+H_2O_{(l)} \leftrightharpoons H^+_{(aq)}+HCO^−_{3(aq)} \tag{16.6.12c}\]
con\(K=8.0 \times 10^{−7} (37°C)\)
El valor K para la reacción en la Ecuación 16.6.12 es el producto de la verdadera constante de ionización para el ácido carbónico (K a) y la constante de equilibrio (K) para la reacción de CO 2 (ac) con agua para dar ácido carbónico. La ecuación de equilibrio para la reacción de CO 2 con agua para dar bicarbonato y un protón es por lo tanto
\[K=\dfrac{[H^+][HCO_3^−]}{[CO_2]}=8.0 \times 10^{−7} \tag{16.6.13}\]
La presencia de un gas en la expresión constante de equilibrio para un tampón es inusual. Según la ley de Henry, [CO 2] = kP (CO 2) donde k es la constante de la ley de Henry para CO 2, que es 3.0 × 10 −5 m/mmHg a 37°C. (Para más información sobre la ley de Henry, ver Sección 13.4.) Sustituyendo esta expresión por [CO 2] en la Ecuación 16.6.13,
\[K=\dfrac{[H^+][HCO_3^−]}{(3.0 \times 10^{−5}\; M/mmHg)(P_{CO_2})} \tag{16.6.14}\]
donde P (CO 2) está en mmHg. Tomando el logaritmo negativo de ambos lados y reordenando,
\[pH=6.10+\log \left( \dfrac{ [HCO_3^−]}{(3.0 \times 10^{−5} M/mm \;Hg)\; (P_{CO_2}) } \right) \tag{16.6.15}\]
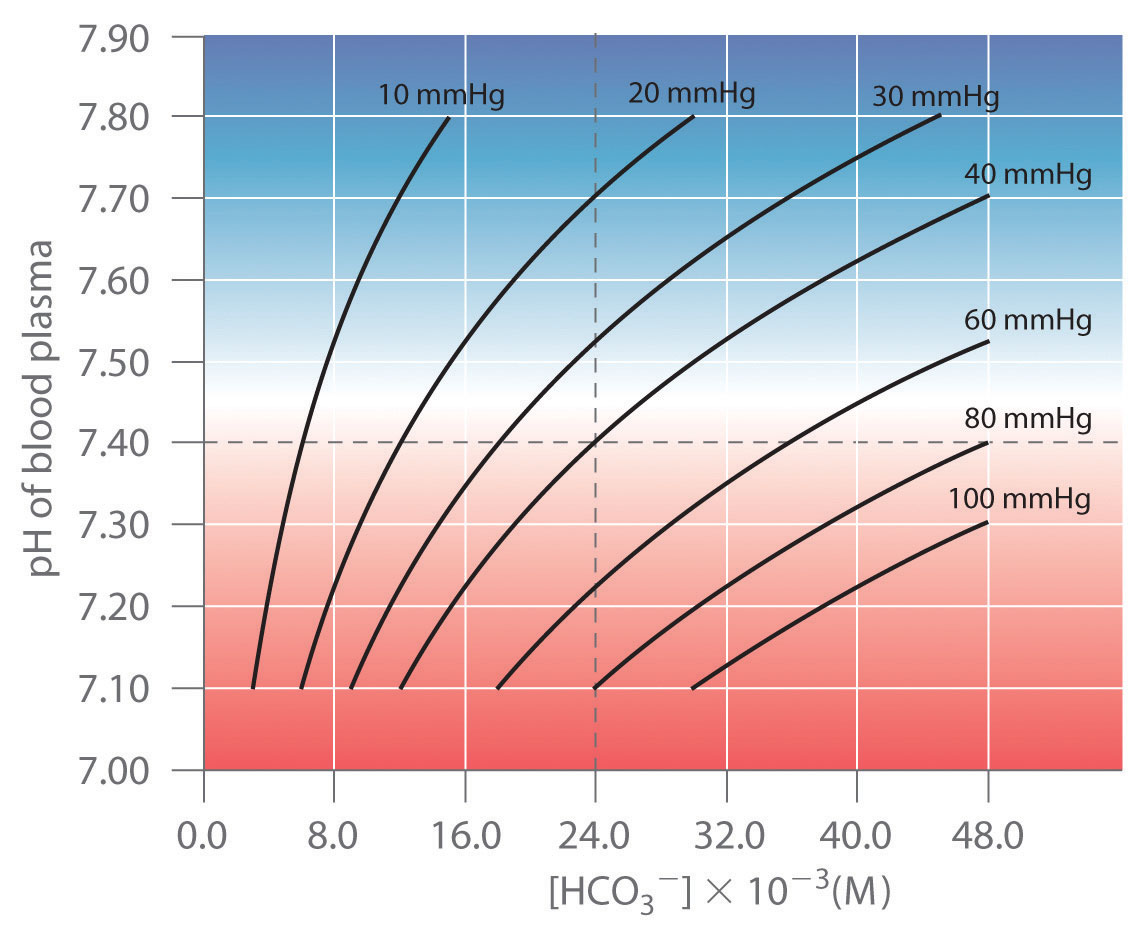
Así, el pH de la solución depende tanto de la presión de CO 2 sobre la solución como de [HCO 3 −]. La Figura 16.6.4 representa la relación entre pH y [HCO 3 −] en condiciones fisiológicas para varios valores diferentes de P (CO 2) con pH normal y valores de [HCO 3 −] indicados por las líneas discontinuas.
Figura 16.6.4 Amortiguación en sangre: pH frente a [HCO 3 −] Curvas para tampones con diferentes valores de P (CO 2) Solo se permiten aquellas combinaciones de pH y [HCO 3 −] que se encuentran en una línea dada para el valor particular de P (CO 2) indicado. Los valores normales de pH plasmático y [HCO 3 −] se indican mediante líneas discontinuas.
De acuerdo con la Ecuación 16.6.12, agregar un ácido fuerte al sistema CO 2 /HCO 3 − hace que [HCO 3 −] disminuya a medida que HCO 3 − se convierte en CO 2. El exceso de CO 2 se libera en los pulmones y se exhala a la atmósfera, sin embargo, por lo que esencialmente no hay cambio en P (CO 2). Debido a que el cambio en [HCO 3 −] /P (CO 2) es pequeño, la Ecuación 16.6.15 predice que el cambio en el pH también será bastante pequeño. Por el contrario, si se agrega una base fuerte, el OH − reacciona con CO 2 para formar [HCO 3 −], pero el CO 2 se repone por el cuerpo, limitando nuevamente el cambio tanto en [HCO 3 −] /P (CO 2) como en el pH. El sistema de tampón CO 2 /HCO 3 − es un ejemplo de un sistema abierto, en el que la concentración total de los componentes del tampón cambia para mantener el pH en un valor casi constante.
Si un pasajero sale de un avión en Denver, Colorado, por ejemplo, el P (CO 2) más bajo a elevaciones más altas (típicamente 31 mmHg a una elevación de 2000 m frente a 40 mmHg al nivel del mar) provoca un cambio a un nuevo pH y [HCO 3 −]. El aumento del pH y la disminución de [HCO 3 −] en respuesta a la disminución de P (CO 2) son responsables del malestar general que muchas personas experimentan a gran altura. Si su pH en sangre no se ajusta rápidamente, la afección puede convertirse en el fenómeno potencialmente mortal conocido como mal de altura.
Resumen
Los tampones son soluciones que resisten un cambio en el pH después de agregar un ácido o una base. Los tampones contienen un ácido débil (HA) y su base débil conjugada (A −). Agregar un electrolito fuerte que contiene un ion en común con un sistema de reacción que está en equilibrio desplaza el equilibrio de tal manera que se reduce la concentración del ion común. El cambio en el equilibrio se llama el efecto de iones comunes. Los tampones se caracterizan por su rango de pH y capacidad de tampón. El rango de pH útil de un tampón depende fuertemente de las propiedades químicas del par ácido débil-base conjugado utilizado para preparar el tampón (el K a o K b), mientras que su capacidad tampón depende únicamente de las concentraciones de las especies en el solución. El pH de un tampón se puede calcular utilizando la ecuación de Henderson-Hasselbalch, la cual es válida para soluciones cuyas concentraciones son al menos 100 veces mayores que sus valores de K a. Debido a que ningún sistema de tampón único puede mantener efectivamente un valor de pH constante en el rango fisiológico de aproximadamente 5 a 7.4, los sistemas bioquímicos utilizan un conjunto de tampones con rangos superpuestos. El más importante de estos es el sistema CO 2 /HCO 3 −, que domina la acción amortiguadora del plasma sanguíneo.
Ecuaciones Clave
Ecuación de Henderson-Hasselbalch
Ecuación 16.6.8:\[pH=pK_a +\log \left(\dfrac{[A^−]}{[HA]} \right) \notag \]
Ecuación 16.6 .9:\[pH=pK_a +\log \left(\dfrac{[base]}{[acid]} \right) \notag \]
Llave para llevar
- El efecto iónico común permite que las soluciones actúen como tampones, cuyo pH puede calcularse mediante la ecuación de Henderson-Hasselbalch.
Problemas conceptuales
-
Explicar por qué los tampones son cruciales para el correcto funcionamiento de los sistemas biológicos.
-
¿Cuál es el papel de un búfer en química y biología? ¿Es correcto decir que los búferes impiden un cambio en [H 3 O +]? Explica tu razonamiento.
-
Explique por qué los tampones más efectivos son aquellos que contienen cantidades aproximadamente iguales del ácido débil y su base conjugada.
-
¿Qué región de la curva de titulación de un ácido débil o una base débil corresponde a la región del menor cambio en el pH por cantidad de ácido fuerte o base fuerte agregado?
-
Si le dieron una solución de acetato de sodio, describa dos formas en las que podría convertir la solución en un tampón.
-
¿Por qué los tampones generalmente se usan solo dentro de aproximadamente una unidad de pH del p K a o p K b del ácido o base débil parental?
-
La curva de titulación para un ácido monoprótico se puede dividir en cuatro regiones: el punto de partida, la región alrededor del punto medio de la titulación, el punto de equivalencia y la región posterior al punto de equivalencia. ¿Para qué región utilizaría cada enfoque para describir el comportamiento de la solución?
- un búfer
- una solución de una sal de una base débil
- una solución de un ácido débil
- diluir una base fuerte
-
¿Cuál de los siguientes producirá una solución tampón? Explica tu razonamiento en cada caso.
- mezclar 100 mL de HCl 0.1 M y 100 mL de fluoruro de sodio 0.1 M
- mezclar 50 mL de HCl 0.1 M y 100 mL de fluoruro de sodio 0.1 M
- mezclar 100 mL de ácido fluorhídrico 0.1 M y 100 mL de HCl 0.1 M
- mezclar 100 mL de ácido fluorhídrico 0.1 M y 50 mL de NaOH 0.1 M
- mezclando 100 mL de fluoruro de sodio 0.1 M y 50 mL de NaOH 0.1 M.
-
¿Cuál de los siguientes producirá una solución tampón? Explica tu razonamiento en cada caso.
- mezclar 100 mL de HCl 0.1 M y 100 mL de acetato de sodio 0.1 M
- mezclar 50 mL de HCl 0.1 M y 100 mL de acetato de sodio 0.1 M
- mezclar 100 mL de ácido acético 0.1 M y 100 mL de NaOH 0.1 M
- mezclar 100 mL de ácido acético 0.1 M y 50 mL de NaOH 0.1 M
- mezclar 100 mL de acetato de sodio 0.1 M y 50 mL de ácido acético 0.1 M
-
Use la definición de K b para una base débil para derivar la siguiente expresión, que es análoga a la ecuación de Henderson-Hasselbalch pero para una base débil (B) en lugar de un ácido débil (HA):
\[pOH=pK_b−\log\left(\dfrac{[base]}{[acid]}\right)\]
-
¿Por qué los sistemas biológicos utilizan sistemas de tampón superpuestos para mantener un pH constante?
-
El sistema tampón CO 2 /HCO 3 − de la sangre tiene una p K a efectiva de aproximadamente 6.1, sin embargo el pH normal de la sangre es 7.4. ¿Por qué el CO 2 /HCO 3 − es un tampón efectivo cuando el p K a está más de 1 unidad por debajo del pH de la sangre? ¿Qué sucede con el pH de la sangre cuando aumenta la presión de CO 2? cuando aumenta la presión de O 2?
-
El dióxido de carbono producido durante la respiración se convierte en ácido carbónico (H 2 CO 3). El p K a1 del ácido carbónico es 6.35, y su p K a2 es 10.33. Escribir las ecuaciones correspondientes a cada valor p K y predecir la posición de equilibrio para cada reacción.
Responder
-
- No es un tampón; el HCl neutraliza completamente el acetato de sodio para dar ácido acético y NaCl (ac).
- Buffer; el HCl neutraliza solo la mitad del acetato de sodio para dar una solución que contiene cantidades iguales de ácido acético y acetato de sodio.
- No es un tampón; el NaOH neutraliza completamente el ácido acético para dar acetato de sodio.
- Buffer; el NaOH neutraliza solo la mitad del ácido acético para dar una solución que contiene cantidades iguales de ácido acético y acetato de sodio.
- Buffer; la solución contendrá una relación 2:1 de acetato de sodio y ácido acético.
Problemas numéricos
-
El ácido bencensulfónico (p K a = 0.70) se sintetiza tratando benceno con ácido sulfúrico concentrado. Calcula lo siguiente:
- el pH de una solución 0.286 M de ácido bencensulfónico
- el pH después de añadir suficiente bencenosulfonato de sodio para dar una concentración final de bencenosulfonato de 0.100 M
-
El fenol tiene una p K a de 9.99. Calcula lo siguiente:
- el pH de una solución 0.195 M
- el incremento porcentual en la concentración de fenol después de añadir suficiente fenóxido de sodio sólido (la sal sódica de la base conjugada) para dar una concentración total de fenóxido de 0.100 M
-
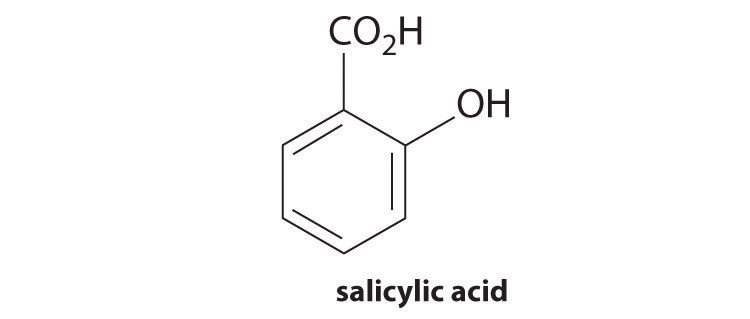
El ácido salicílico se utiliza en la síntesis de ácido acetilsalicílico, o aspirina. Un gramo se disuelve en 460 mL de agua para crear una solución saturada con un pH de 2.40.
- ¿Cuál es la K a del ácido salicílico?
- ¿Cuál es el pH final de una solución saturada que también es 0.238 M en salicilato de sodio?
- ¿Cuál es el pH final si se agregan 10.00 mL de HCl 0.100 M a 150.0 mL de la solución tamponada?
- ¿Cuál es el pH final si se agregan 10.00 mL de NaOH 0.100 M a 150.0 mL de la solución tamponada?
-
Un intermedio utilizado en la síntesis de perfumes es el ácido valérico, también llamado ácido pentanoico. El p K a del ácido pentanoico es de 4.84 a 25°C.
- ¿Cuál es el pH de una solución 0.259 M de ácido pentanoico?
- Se agrega pentanoato de sodio para hacer una solución tamponada. ¿Cuál es el pH de la solución si es 0.210 M en pentanoato de sodio?
- ¿Cuál es el pH final si se agregan 8.00 mL de HCl 0.100 M a 75.0 mL de la solución tamponada?
- ¿Cuál es el pH final si se agregan 8.00 mL de NaOH 0.100 M a 75.0 mL de la solución tamponada?
Responder
-
- 1.35 × 10 −3
- 4.03
- 3.88
- 4.30
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern