16.5: Titulación ácido-base
- Page ID
- 78431
- Calcular el pH en cualquier punto en una titulación ácido-base.
En el Capítulo 8, aprendió que en una titulación ácido-base, se usa una bureta para entregar volúmenes medidos de una solución ácida o base de concentración conocida (el valorante) a un matraz que contiene una solución de una base o un ácido, respectivamente, de concentración desconocida (el desconocido). Si se conoce la concentración del valorante, entonces se puede determinar la concentración de lo desconocido. La siguiente discusión se centra en los cambios de pH que ocurren durante una titulación ácido-base. Trazar el pH de la solución en el matraz frente a la cantidad de ácido o base añadida produce una curva de titulación Una gráfica del pH de la solución que se está valorando frente a la cantidad de ácido o base (de concentración conocida) añadida. . La forma de la curva proporciona información importante sobre lo que ocurre en solución durante la titulación.
Titulación de ácidos fuertes y bases
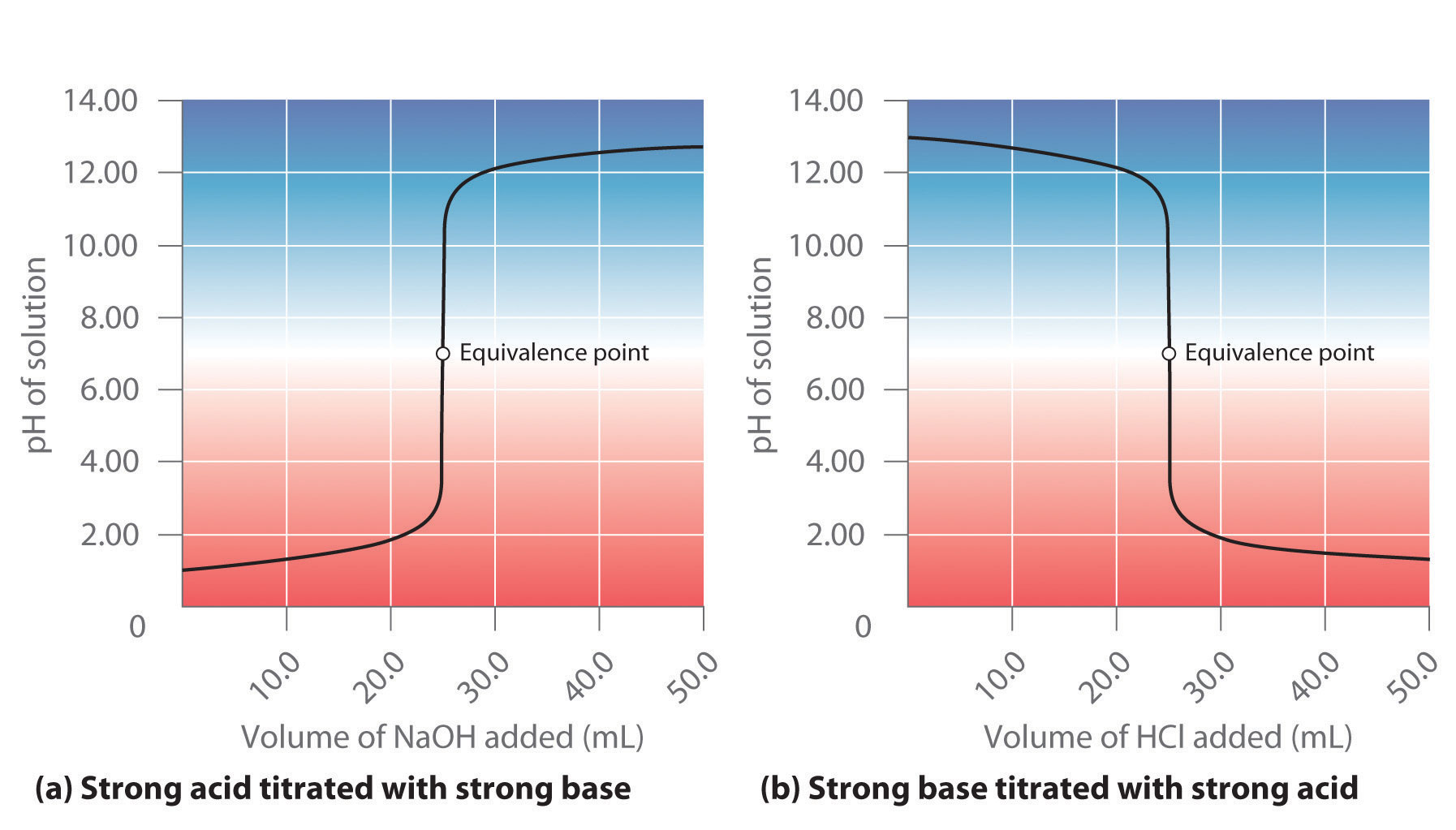
La parte (a) de la Figura 16.5.1 muestra una gráfica del pH a medida que se agrega gradualmente HCl 0.20 M a 50.00 mL de agua pura. El pH de la muestra en el matraz es inicialmente de 7.00 (como se esperaba para el agua pura), pero baja muy rápidamente a medida que se agrega HCl. Finalmente, el pH se vuelve constante a 0.70, un punto muy por encima de su valor de 1.00 con la adición de 50.0 mL de HCl (0.70 es el pH de 0.20 M HCl). En contraste, cuando se agrega NaOH 0.20 M a 50.00 mL de agua destilada, el pH (inicialmente 7.00) sube muy rápidamente al principio pero luego más gradualmente, llegando finalmente a un límite de 13.30 (el pH de NaOH 0.20 M), nuevamente mucho más allá de su valor de 13.00 con la adición de 50.0 mL de NaOH como se muestra en la parte (b) en Figura 16.5.1. Como puede ver en estas gráficas, la curva de titulación para agregar una base es la imagen especular de la curva para agregar un ácido.
Figura 16.5.1 pH de la solución en función del volumen de un ácido fuerte o una base fuerte agregado al agua destilada (a) Cuando se agrega HCl 0.20 M a 50.0 mL de agua destilada, el pH disminuye rápidamente hasta alcanzar un mínimo al pH de HCl 0.20 M. (b) Por el contrario, cuando se agrega NaOH 0.20 M a 50.0 mL de agua destilada, el pH aumenta rápidamente hasta alcanzar un máximo al pH de NaOH 0.20 M.
Supongamos que ahora agregamos NaOH 0.20 M a 50.0 mL de una solución 0.10 M de HCl. Debido a que el HCl es un ácido fuerte que está completamente ionizado en agua, el [H +] inicial es 0.10 M, y el pH inicial es 1.00. La adición de NaOH disminuye la concentración de H + debido a la reacción de neutralización: OH − + H + H 2 O (en la parte (a) en la Figura 16.5.2). De esta manera, el pH de la solución aumenta gradualmente. Cerca del punto de equivalencia El punto en una titulación donde se ha agregado una cantidad estequiométrica del valorante. , sin embargo, el punto en el que el número de moles de base (o ácido) añadidos es igual al número de moles de ácido (o base) originalmente presentes en la solución, el pH aumenta mucho más rápidamente debido a que se han consumido la mayoría de los iones H + originalmente presentes. (Para mayor información sobre titulaciones y el punto de equivalencia, véase la Sección 8.9.) Para la titulación de un ácido fuerte monoprótico (HCl) con una base fuerte monobásica (NaOH), podemos calcular el volumen de base necesario para alcanzar el punto de equivalencia a partir de la siguiente relación:
\[moles\;of \;base=(volume)_b(molarity)_bV_bM_b= moles \;of \;acid=(volume)_a(molarity)_a=V_aM_a \tag{16.5.1}\]
Si se agrega NaOH 0.20 M a 50.0 mL de una solución 0.10 M de HCl, resolvemos para V b:
Figura 16.5.2 La valoración de (a) un ácido fuerte con una base fuerte y (b) una base fuerte con un ácido fuerte (a) A medida que se agrega lentamente NaOH 0.20 M a 50.0 mL de HCl 0.10 M, el pH aumenta lentamente al principio, luego aumenta muy rápidamente a medida que se acerca el punto de equivalencia, y finalmente aumenta lentamente una vez más. (b) Por el contrario, a medida que se agrega lentamente HCl 0.20 M a 50.0 mL de NaOH 0.10 M, el pH disminuye lentamente al principio, luego disminuye muy rápidamente a medida que se acerca el punto de equivalencia, y finalmente disminuye lentamente una vez más.
En el punto de equivalencia (cuando se han agregado 25.0 mL de solución de NaOH), la neutralización es completa: solo queda una sal en solución (NaCl), y el pH de la solución es de 7.00. Agregar más NaOH produce un rápido aumento en el pH, pero eventualmente el pH se desvía a un valor de aproximadamente 13.30, el pH de NaOH 0.20 M.
Como se muestra en la parte (b) de la Figura 16.5.2, la titulación de 50.0 mL de una solución 0.10 M de NaOH con HCl 0.20 M produce una curva de titulación que es casi la imagen especular de la curva de titulación en la parte (a) en la Figura 16.5.2. El pH es inicialmente de 13.00, y disminuye lentamente a medida que se agrega HCl. A medida que se aproxima el punto de equivalencia, el pH desciende rápidamente antes de nivelarse a un valor de aproximadamente 0.70, el pH de HCl 0.20 M.
La titulación de un ácido fuerte con una base fuerte o una base fuerte con un ácido fuerte produce una curva en forma de S. La curva es algo asimétrica porque el aumento constante del volumen de la solución durante la titulación hace que la solución se diluya más. Debido al efecto nivelador, la forma de la curva para una titulación que involucra un ácido fuerte y una base fuerte depende solo de las concentraciones del ácido y la base, no de sus identidades.
Tenga en cuenta el patrón
La forma de la curva de titulación que involucra un ácido fuerte y una base fuerte depende únicamente de sus concentraciones, no de sus identidades.
Ejemplo 16.5.1
Calcular el pH de la solución después de que se hayan agregado 24.90 mL de NaOH 0.200 M a 50.00 mL de HCl 0.100 M.
Dado: volúmenes y concentraciones de base fuerte y ácido
Preguntado por: pH
Estrategia:
A Calcular el número de milimoles de H + y OH − para determinar cuál, en su caso, está en exceso después de que se haya producido la reacción de neutralización. Si una especie está en exceso, calcule la cantidad que queda después de la reacción de neutralización.
B Determinar el volumen final de la solución. Calcular la concentración de las especies en exceso y convertir este valor a pH.
Solución:
A Debido a que 0.100 mol/L es equivalente a 0.100 mmol/mL, el número de milimoles de H + en 50.00 mL de HCl 0.100 M se puede calcular de la siguiente manera:
\[ 50.00 \cancel{mL} \left ( \dfrac{0.100 \;mmol \;HCl}{\cancel{mL}} \right )= 5.00 \;mmol \;HCl=5.00 \;mmol \;H^{+} \notag \]
El número de milimoles de NaOH añadidos es el siguiente:
Así H + está en exceso. Para neutralizar completamente el ácido se requiere la adición de 5.00 mmol de OH − a la solución de HCl. Debido a que solo se han agregado 4.98 mmol de OH −, la cantidad de exceso de H + es 5.00 mmol − 4.98 mmol = 0.02 mmol de H +.
B El volumen final de la solución es de 50.00 mL + 24.90 mL = 74.90 mL, por lo que la concentración final de H + es la siguiente:
El pH es −log [H +] = −log (3 × 10 −4) = 3.5, que es significativamente menor que el pH de 7.00 para una solución neutra.
Ejercicio
Calcular el pH de una solución preparada añadiendo 40.00 mL de HCl 0.237 M a 75.00 mL de una solución 0.133 M de NaOH.
Respuesta: 11.6
Titulación de ácidos y bases débiles
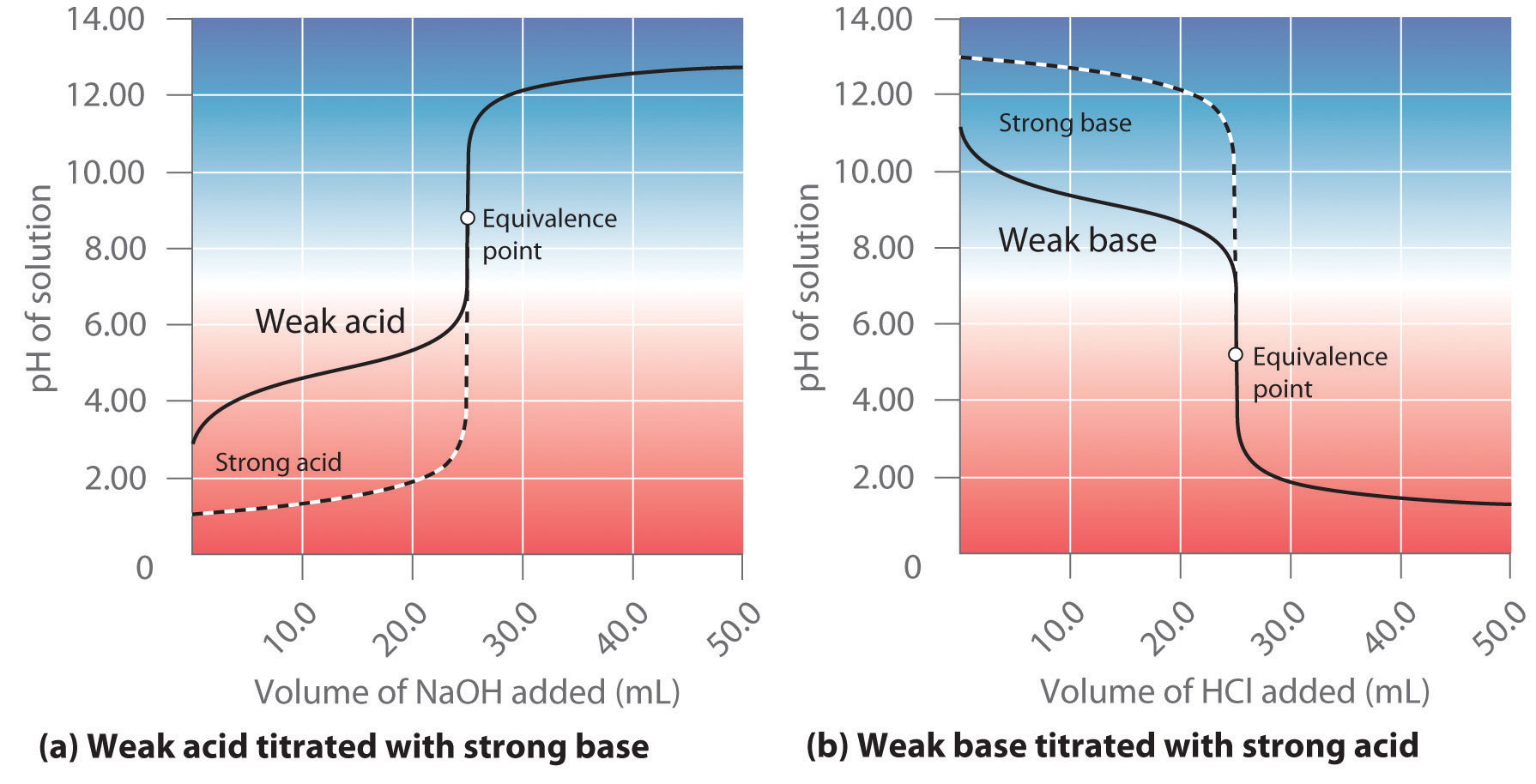
A diferencia de los ácidos y bases fuertes, la forma de la curva de titulación para un ácido débil o una base débil depende drásticamente de la identidad del ácido o la base y la K a o K b correspondiente. Como veremos, el pH también cambia mucho más gradualmente alrededor del punto de equivalencia en la titulación de un ácido débil o una base débil. Como aprendiste en la Sección 16.4, [H +] de una solución de un ácido débil (HA) no es igual a la concentración del ácido sino que depende tanto de su p K a como de su concentración. Debido a que solo una fracción de un ácido débil se disocia, [H +] es menor que [HA]. Así, el pH de una solución de un ácido débil es mayor que el pH de una solución de un ácido fuerte de la misma concentración. La parte (a) de la Figura 16.5.3 muestra la curva de titulación para 50.0 mL de una solución 0.100 M de ácido acético con NaOH 0.200 M superpuesta sobre la curva para la titulación de HCl 0.100 M mostrada en la parte (a) en la Figura 16.5.2. Por debajo del punto de equivalencia, las dos curvas son muy diferentes. Antes de agregar cualquier base, el pH de la solución de ácido acético es mayor que el pH de la solución de HCl, y el pH cambia más rápidamente durante la primera parte de la titulación. Obsérvese también que el pH de la solución de ácido acético en el punto de equivalencia es mayor a 7.00. Es decir, en el punto de equivalencia, la solución es básica. Además, el cambio en el pH alrededor del punto de equivalencia es solo aproximadamente la mitad de grande que para la titulación de HCl; la magnitud del cambio de pH en el punto de equivalencia depende de la p K a del ácido que se está titulando. Por encima del punto de equivalencia, sin embargo, las dos curvas son idénticas. Una vez neutralizado el ácido, el pH de la solución se controla únicamente por la cantidad de exceso de NaOH presente, independientemente de si el ácido es débil o fuerte.
Tenga en cuenta el patrón
La forma de la curva de titulación de un ácido débil o base débil depende en gran medida de sus identidades y de la K a o K b.
La curva de titulación en la parte (a) de la Figura 16.5.3 se creó calculando el pH inicial de la solución de ácido acético antes de agregar cualquier NaOH y luego calculando el pH de la solución después de agregar volúmenes crecientes de NaOH. El procedimiento se ilustra en la siguiente subsección y Ejemplo 12 para tres puntos en la curva de titulación, utilizando la p K a de ácido acético (4.76 a 25°C; K a = 1.7 × 10 −5).
Figura 16.5.3 La valoración de (a) un ácido débil con una base fuerte y (b) una base débil con un ácido fuerte (a) A medida que se agrega lentamente NaOH 0.200 M a 50.0 mL de ácido acético 0.100 M, el pH aumenta lentamente al principio, luego aumenta rápidamente a medida que se acerca el punto de equivalencia, y luego nuevamente aumenta más lentamente. La curva correspondiente para la titulación de 50.0 mL de HCl 0.100 M con NaOH 0.200 M se muestra como una línea discontinua. (b) A medida que se agrega lentamente HCl 0.200 M a 50.0 mL de NH 3 0.100 M, el pH disminuye lentamente al principio, luego disminuye rápidamente a medida que se acerca el punto de equivalencia, y luego vuelve a disminuir más lentamente. La curva correspondiente para la titulación de 50.0 mL de NaOH 0.100 M con HCl 0.200 M se muestra como una línea discontinua.
Cálculo del pH de una Solución de un Ácido Débil o de una Base Débil
Como se explica Sección 16.4, si conocemos K a o K b y la concentración inicial de un ácido débil o una base débil, podemos calcular el pH de una solución de un ácido débil o una base débil estableciendo una tabla de concentraciones iniciales, cambios en concentraciones y concentraciones finales. En esta situación, la concentración inicial de ácido acético es de 0.100 M. Si definimos x como [H +] debido a la disociación del ácido, entonces la tabla de concentraciones para la ionización de ácido acético 0.100 M es la siguiente:
| \[CH_3CO_2H_{(aq)} \rightleftharpoons H^+_{(aq)} + CH_3CO_2^−\] | |||
|---|---|---|---|
| [CH 3 CO 2 H] | [H +] | [CH 3 CO 2 −] | |
| \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdo-poones H^+_ {(aq)} + CH_3CO_2^−\]” class="lt-chem-349757">inicial | \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdo-poones H^+_ {(aq)} + CH_3CO_2^−\] [CH3CO2H]” class="lt-chem-349757">0.100 | \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdocharpoons H^+_ {(aq)} + CH_3CO_2^−\] [H+]” class="lt-chem-349757">1.00 × 10 −7 | \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdocharpoons H^+_ {(aq)} + CH_3CO_2^−\] [CH3CO2−]” class="lt-chem-349757">0 |
| \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdo-poons H^+_ {(aq)} + CH_3CO_2^−\]” class="lt-chem-349757">cambiar | \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdo-poones H^+_ {(aq)} + CH_3CO_2^−\] [CH3CO2H]” class="lt-chem-349757">− x | \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdo-poones H^+_ {(aq)} + CH_3CO_2^−\] [H+]” class="lt-chem-349757">+ x | \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdo-poones H^+_ {(aq)} + CH_3CO_2^−\] [CH3CO2−]” class="lt-chem-349757">+ x |
| \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdocharpoons H^+_ {(aq)} + CH_3CO_2^−\]” class="lt-chem-349757">final | \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdocharpoons H^+_ {(aq)} + CH_3CO_2^−\] [CH3CO2H]” class="lt-chem-349757"> (0.100 − x) | \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdocharpoons H^+_ {(aq)} + CH_3CO_2^−\] [H+]” class="lt-chem-349757"> x | \ [CH_3CO_2H_ {(aq)}\ derecho-izquierdocharpoons H^+_ {(aq)} + CH_3CO_2^−\] [CH3CO2−]” class="lt-chem-349757"> x |
En este y en todos los ejemplos posteriores, ignoraremos [H +] y [OH −] debido a la autoionización del agua al calcular la concentración final. Sin embargo, debe usar la Ecuación 16.4.8 y la Ecuación 16.4.9 para verificar que esta suposición esté justificada.
Insertando las expresiones para las concentraciones finales en la ecuación de equilibrio (y usando aproximaciones),
\[K_a=\dfrac{[H^+][CH_3CO_2^-]}{[CH_3CO_2H]}=\dfrac{(x)(x)}{0.100 - x} \approx \dfrac{x^2}{0.100}=1.74 \times 10^{-5} \notag \]
Resolver esta ecuación da\(x = [H^+] = 1.32 \times 10^{-3}\; M\). Así, el pH de una solución 0.100 M de ácido acético es el siguiente:
\[pH = −\log(1.32 \times 10^{-3}) = 2.879 \notag \]
Cálculo del pH durante la titulación de un ácido débil o una base débil
Ahora considere lo que sucede cuando agregamos 5.00 mL de NaOH 0.200 M a 50.00 mL de 0.100 M CH 3 CO 2 H (parte (a) en la Figura 16.5.4). Debido a que la reacción de neutralización continúa hasta su finalización, todos los iones OH - añadidos reaccionarán con el ácido acético para generar iones acetato y agua:
\[ CH_3CO_2H_{(aq)} + OH^-_{(aq)} \rightarrow CH_3CO^-_{2\;(aq)} + H_2O_{(l)} \tag{16.5.2}\]
Todos los problemas de este tipo deben resolverse en dos etapas: un cálculo estequiométrico seguido de un cálculo de equilibrio. En la primera etapa, utilizamos la estequiometría de la reacción de neutralización para calcular las cantidades de ácido y base conjugada presentes en solución después de que se haya producido la reacción de neutralización. En el segundo paso, utilizamos la ecuación de equilibrio (Ecuación 16.2.2) para determinar [H +] de la solución resultante.
Paso 1: Para determinar la cantidad de ácido y base conjugada en solución después de la reacción de neutralización, se calcula la cantidad de CH 3 CO 2 H en la solución original y la cantidad de OH − en la solución de NaOH que se añadió. La solución de ácido acético contenía
La solución de NaOH contenía
Al comparar las cantidades se observa que CH 3 CO 2 H está en exceso. Debido a que OH − reacciona con CH 3 CO 2 H en una estequiometría 1:1, la cantidad de exceso de CH 3 CO 2 H es la siguiente:
5.00 mmol CH 3 CO 2 H − 1.00 mmol OH − = 4.00 mmol CH 3 CO 2 H
Cada 1 mmol de OH − reacciona para producir 1 mmol de ion acetato, por lo que la cantidad final de CH 3 CO 2 − es de 1.00 mmol.
La estequiometría de la reacción se resume en la siguiente tabla, que muestra los números de moles de las diversas especies, no sus concentraciones.
| \[ CH_3CO_2H(aq)+OH^{-}(aq)\rightarrow CH_3CO_2^{-}(aq)+H_2O(l) \] | |||
|---|---|---|---|
| [CH 3 CO 2 H] | [OH −] | [CH 3 CO 2 −] | |
| \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\]” class="lt-chem-349757"> inicial | \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\] [CH3CO2H]” class="lt-chem-349757">5.00 mmol | \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\] [OH−]” class="lt-chem-349757">1.00 mmol | \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\] [CH3CO2−]” class="lt-chem-349757">0 mmol |
| \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\]” class="lt-chem-349757"> cambiar | \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\] [CH3CO2H]” class="lt-chem-349757">−1.00 mmol | \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\] [OH−]” class="lt-chem-349757">−1.00 mmol | \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\] [CH3CO2−]” class="lt-chem-349757">+1.00 mmol |
| \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\]” class="lt-chem-349757"> final | \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\] [CH3CO2H]” class="lt-chem-349757">4.00 mmol | \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\] [OH−]” class="lt-chem-349757">0 mmol | \ [CH_3CO_2H (aq) +OH^ {-} (aq)\ fila derecha CH_3CO_2^ {-} (aq) +H_2O (l)\] [CH3CO2−]” class="lt-chem-349757">1.00 mmol |
Esta tabla da la cantidad inicial de acetato y la cantidad final de iones OH − como 0. Debido a que una solución acuosa de ácido acético siempre contiene al menos una pequeña cantidad de ion acetato en equilibrio con ácido acético, sin embargo, la concentración inicial de acetato no es realmente 0. El valor puede ser ignorado en este cálculo debido a que la cantidad de CH 3 CO 2 − en equilibrio es insignificante en comparación con la cantidad de OH − añadida. Además, debido a la autoionización del agua, ninguna solución acuosa puede contener 0 mmol de OH −, pero la cantidad de OH − debida a la autoionización del agua es insignificante en comparación con la cantidad de OH − añadida. Utilizamos las cantidades iniciales de los reactivos para determinar la estequiometría de la reacción y diferir la consideración del equilibrio hasta la segunda mitad del problema.
Paso 2: Para calcular [H +] en equilibrio tras la adición de NaOH, primero debemos calcular [CH 3 CO 2 H] y [CH 3 CO 2 −] utilizando el número de milimoles de cada uno y el volumen total de la solución en este punto en la titulación:
Conociendo las concentraciones de ácido acético e ion acetato en equilibrio y K a para ácido acético (1.74 × 10 −5), podemos usar la Ecuación 16.2.2 para calcular [H +] en equilibrio:
Calcular −log [H +] da pH = −log (6.95 × 10 −5) = 4.158.
Comparando las curvas de titulación para HCl y ácido acético en la parte (a) en la Figura 16.5.3, vemos que agregar la misma cantidad (5.00 mL) de NaOH 0.200 M a 50 mL de una solución 0.100 M de ambos ácidos provoca un cambio de pH mucho menor para HCl (de 1.00 a 1.14) que para ácido acético (2.88 a 4.16). Esto concuerda con la descripción cualitativa de las formas de las curvas de titulación al inicio de esta sección. En el Ejemplo 16.5.2, calculamos otro punto para construir la curva de titulación del ácido acético.
Ejemplo 16.5.2
¿Cuál es el pH de la solución después de agregar 25.00 mL de NaOH 0.200 M a 50.00 mL de ácido acético 0.100 M?
Dado: volumen y molaridad de base y ácido
Preguntado por: pH
Estrategia:
- Escribe la ecuación química balanceada para la reacción. Después calcular los números iniciales de milimoles de OH − y CH 3 CO 2 H. Determinar qué especies, si alguna, está presente en exceso.
- Tabular los resultados mostrando números iniciales, cambios y números finales de milimoles.
- Si el exceso de acetato está presente después de la reacción con OH −, escriba la ecuación para la reacción del acetato con agua. Utilizar un formato tabular para obtener las concentraciones de todas las especies presentes.
- Calcular K b usando la relación K w = K a K b (Ecuación 16.2.10). Calcule [OH −] y utilícelo para calcular el pH de la solución.
Solución:
A Ignorando el ion espectador (Na +), la ecuación para esta reacción es la siguiente:
\[CH_3CO_2H_{ (aq)} + OH^-(aq) \rightarrow CH_3CO_2^-(aq) + H_2O(l) \notag \]
Los números iniciales de milimoles de OH − y CH 3 CO 2 H son los siguientes:
El número de milimoles de OH − es igual al número de milimoles de CH 3 CO 2 H, por lo que ninguna de las especies está presente en exceso.
B Debido a que el número de milimoles de OH − añadidos corresponde al número de milimoles de ácido acético en solución, este es el punto de equivalencia. Los resultados de la reacción de neutralización pueden resumirse en forma tabular.
| \(CH_3CO_2H_{(aq)}+OH^-_{(aq)} \rightleftharpoons CH_3CO_2^{-}(aq)+H_2O(l) \) | |||
|---|---|---|---|
| [CH 3 CO 2 H] | [OH −] | [CH 3 CO 2 −] | |
| \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\)” style="text-align:center;” class="lt-chem-349757"> inicial | \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\) [CH3CO2H]” style="text-align:center;” class="lt-chem-349757">5.00 mmol | \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\) [OH−]” style="text-align:center;” class="lt-chem-349757">5.00 mmol | \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\) [CH3CO2−]” style="text-align:center;” class="lt-chem-349757">0 mmol |
| \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\)” style="text-align:center;” class="lt-chem-349757"> final | \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\) [CH3CO2H]” style="text-align:center;” class="lt-chem-349757">0 mmol | \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\) [OH−]” style="text-align:center;” class="lt-chem-349757">0 mmol | \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\) [CH3CO2−]” style="text-align:center;” class="lt-chem-349757">5.00 mmol |
| \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\)” style="text-align:center;” class="lt-chem-349757"> cambiar | \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\) [CH3CO2H]” style="text-align:center;” class="lt-chem-349757">−5.00 mmol | \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\) [OH−]” style="text-align:center;” class="lt-chem-349757">−5.00 mmol | \ (CH_3CO_2H_ {(aq)} +OH^-_ {(aq)}\ derechazarpoons CH_3CO_2^ {-} (aq) +H_2O (l)\) [CH3CO2−]” style="text-align:center;” class="lt-chem-349757">+5.00 mmol |
C Debido a que el producto de la reacción de neutralización es una base débil, debemos considerar la reacción de la base débil con agua para calcular [H +] en equilibrio y así el pH final de la solución. La concentración inicial de acetato se obtiene de la reacción de neutralización:
La reacción de equilibrio del acetato con agua es la siguiente:
\[CH_3CO^-_{2(aq)}+H_2O_{(l)} \rightleftharpoons CH_3CO_2H_{(aq)}+OH^-_{(aq)} \notag \]
La constante de equilibrio para esta reacción es K b = K w/K a, donde K a es la constante de ionización ácida del ácido acético. Por lo tanto, definimos x como [OH −] producido por la reacción de acetato con agua. Aquí está la tabla de concentraciones completada:
| \(H_2O_{(l)}+CH_3CO^−_{2(aq)} \rightleftharpoons CH_3CO_2H_{(aq)} +OH^−_{(aq)}\) | |||
|---|---|---|---|
| [CH 3 CO 2 −] | [CH 3 CO 2 H] | [OH −] | |
| \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ derechazarpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\)” style="text-align:center;” class="lt-chem-349757"> inicial | \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ derechazarpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\) [CH3CO2−]” style="text-align:center;” class="lt-chem-349757">0.0667 | \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ derechazarpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\) [CH3CO2H]” style="text-align:center;” class="lt-chem-349757">0 | \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ derechazarpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\) [OH−]” style="text-align:center;” class="lt-chem-349757">1.00 × 10 −7 |
| \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ rightleftharpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\)” style="text-align:center;” class="lt-chem-349757"> cambiar | \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ derechazarpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\) [CH3CO2−]” style="text-align:center;” class="lt-chem-349757">− x | \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ derechazarpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\) [CH3CO2H]” style="text-align:center;” class="lt-chem-349757">+ x | \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ derechazarpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\) [OH−]” style="text-align:center;” class="lt-chem-349757">+ x |
| \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ rightleftharpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\)” style="text-align:center;” class="lt-chem-349757"> final | \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ derechazarpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\) [CH3CO2−]” style="text-align:center;” class="lt-chem-349757"> (0.0667 − x) | \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ derechazarpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\) [CH3CO2H]” style="text-align:center;” class="lt-chem-349757"> x | \ (H_2O_ {(l)} +CH_3CO^−_ {2 (aq)}\ derechazarpoons CH_3CO_2H_ {(aq)} +OH^−_ {(aq)}\) [OH−]” style="text-align:center;” class="lt-chem-349757"> x |
D Sustituyendo las expresiones por los valores finales de esta tabla en la Ecuación 16.2.5,
Podemos obtener K b reordenando la Ecuación 16.2.10 y sustituyendo los valores conocidos:
\[ K_{b}= \dfrac{K_w}{K_a} =\dfrac{1.01 \times 10^{-14}}{1.74 \times 10^{-5}} = 5.80 \times 10^{-10}=\dfrac{x^{2}}{0.0667} \notag \]
Ejercicio
Calcular el pH de una solución preparada añadiendo 45.0 mL de una solución de HCl 0.213 M a 125.0 mL de una solución 0.150 M de amoníaco. El p K b de amoníaco es de 4.75 a 25°C.
Respuesta: 9.23
Como se muestra en la parte (b) en la Figura 16.5.3, la curva de titulación para NH 3, una base débil, es la inversa de la curva de titulación para ácido acético. En particular, el pH en el punto de equivalencia en la titulación de una base débil es menor a 7.00 debido a que la titulación produce un ácido.
La identidad del ácido débil o la base débil que se está valorando afecta fuertemente la forma de la curva de titulación. La Figura 16.5.4 ilustra la forma de las curvas de titulación en función de la p K a o la p K b. A medida que el ácido o la base que se está titulando se debilita (su p K a o p K b se hace mayor), el cambio de pH alrededor del punto de equivalencia disminuye significativamente. Con soluciones muy diluidas, la curva se vuelve tan superficial que ya no se puede utilizar para determinar el punto de equivalencia.
Figura 16.5.4 Efecto de la Fuerza de Ácido o Base sobre la Forma de las Curvas de Titulación A diferencia de los ácidos o bases fuertes, la forma de la curva de titulación para un ácido o base débil depende de la p K a o p K b del ácido o base débil siendo titulados. (a) El pH de la solución en función del volumen de NaOH 1.00 M agregado a 10.00 mL de soluciones 1.00 M de ácidos débiles con los valores indicados de p K a. (b) El pH de la solución en función del volumen de HCl 1.00 M agregado a 10.00 mL de soluciones 1.00 M de bases débiles con los valores indicados de p K b. Las formas de los dos conjuntos de curvas son esencialmente idénticas, pero una se voltea verticalmente en relación con la otra. Se indican puntos medios para las curvas de titulación correspondientes a p K a = 10 y p K b = 10.
Un punto en la titulación de un ácido débil o una base débil es particularmente importante: el punto medio de una titulación se define como el punto en el que se ha agregado exactamente suficiente ácido (o base) para neutralizar la mitad del ácido (o la base) originalmente presente y ocurre a mitad del punto de equivalencia. El punto medio se indica en la parte (a) en la Figura 16.5.5 y la parte (b) en la Figura 16.5.5 para las dos curvas más superficiales. Por definición, en el punto medio de la titulación de un ácido, [HA] = [A −]. Recordemos de la Ecuación 16.2.2 que la constante de ionización para un ácido débil es la siguiente:
\[ K_{a}=\dfrac{\left [ H_{3}O^{+} \right ]\left [ A^{-} \right ]}{\left [ HA \right ]} \notag \]
Si [HA] = [A −], esto se reduce a K a = [H 3 O +]. Tomando el logaritmo negativo de ambos lados,
\[ log \;K_{a}= -log \left [ H_{3}O^{+} \right ] \notag \]
De las definiciones de p K a y pH, vemos que esto es idéntico a
\[ pK_{a}= pH \tag{16.5.3} \notag \]
Así, el pH en el punto medio de la titulación de un ácido débil es igual al pK a del ácido débil, como se indica en la parte (a) en la Figura 16.5.4 para el ácido más débil donde vemos que el punto medio para p K a = 10 ocurre a pH = 10. Por lo tanto, se pueden usar métodos de titulación para determinar tanto la concentración como la p K a (o la p K b) de un ácido débil (o una base débil).
Tenga en cuenta el patrón
El pH en el punto medio de la titulación de un ácido débil es igual al p K a del ácido débil.
Titulación de ácidos o bases polipróticos
Cuando se agrega una base fuerte a una solución de un ácido poliprótico, la reacción de neutralización ocurre por etapas. El grupo más ácido se titula primero, seguido del siguiente más ácido, y así sucesivamente. Si los valores de p K a están separados por al menos tres unidades p K a, entonces la curva de titulación general muestra “pasos” bien resueltos correspondientes a la titulación de cada protón. Una valoración del ácido triprótico H 3 PO 4 con NaOH se ilustra en la Figura 16.5.5 y muestra dos etapas bien definidas: el primer punto medio corresponde a p K a1, y el segundo punto medio corresponde a p K a2. Debido a que HPO 4 2− es un ácido tan débil, p K a3 tiene un valor tan alto que la tercera etapa no puede resolverse usando NaOH 0.100 M como valorante.
Figura 16.5.5 Curva de titulación para ácido fosfórico (H 3 PO 4), un ácido poliprótico típico La curva para la titulación de 25.0 mL de una solución 0.100 M H 3 PO 4 con NaOH 0.100 M junto con las especies en solución en cada Se muestra K a. Obsérvese los dos puntos de equivalencia distintos correspondientes a la desprotonación de H 3 PO 4 a pH ≈ 4.6 y H 2 PO 4 2− a pH ≈ 9.8. Debido a que HPO 4 2− es un ácido muy débil, el tercer punto de equivalencia, a pH ≈ 13, no está bien definido.
La curva de titulación para la reacción de una base poliprótica con un ácido fuerte es la imagen especular de la curva mostrada en la Figura 16.5.5 El pH inicial es alto, pero a medida que se agrega ácido, el pH disminuye en etapas si los valores sucesivos de p K b están bien separados. La Tabla 16.3.1 enumera las constantes de ionización y los valores de p K a para algunos ácidos y bases polipróticos comunes.
Ejemplo 16.5.3
Calcular el pH de una solución preparada añadiendo 55.0 mL de una solución de NaOH 0.120 M a 100.0 mL de una solución 0.0510 M de ácido oxálico (HO 2 CCO 2 H), un ácido diprótico (abreviado como H 2 ox). El ácido oxálico, el ácido dicarboxílico más simple, se encuentra en el ruibarbo y en muchas otras plantas. Las hojas de ruibarbo son tóxicas porque contienen la sal de calcio de la forma completamente desprotonada del ácido oxálico, el ion oxalato (− O 2 CCO 2 −, abreviado ox 2−). Las sales de oxalato son tóxicas por dos razones. Primero, las sales de oxalato de cationes divalentes como Ca 2+ son insolubles a pH neutro pero solubles a pH bajo. Como resultado, el oxalato de calcio se disuelve en el ácido diluido del estómago, permitiendo que el oxalato sea absorbido y transportado a las células, donde puede reaccionar con el calcio para formar diminutos cristales de oxalato de calcio que dañan los tejidos. En segundo lugar, el oxalato forma complejos estables con iones metálicos, que pueden alterar la distribución de iones metálicos en fluidos biológicos.
Dado: volumen y concentración de ácido y base
Preguntado por: pH
Estrategia:
A Calcular los milimoles iniciales del ácido y la base. Utilice un formato tabular para determinar las cantidades de todas las especies en solución.
B Calcular las concentraciones de todas las especies en la solución final. Utilice la Ecuación 16.2.3 para determinar [H +] y convertir este valor a pH.
Solución:
A El Cuadro 16.3.1 da los valores de p K a del ácido oxálico como 1.25 y 3.81. Nuevamente se procede determinando los milimoles de ácido y base inicialmente presentes:
\[ 100.00 \cancel{mL} \left ( \dfrac{0.510 \;mmol \;H_{2}ox}{\cancel{mL}} \right )= 5.10 \;mmol \;H_{2}ox \notag \]
\[ 55.00 \cancel{mL} \left ( \dfrac{0.120 \;mmol \;NaOH}{\cancel{mL}} \right )= 6.60 \;mmol \;NaOH \notag \]
El ácido más fuerte (H 2 ox) reacciona primero con la base. Esto deja (6.60 − 5.10) = 1.50 mmol de OH − para reaccionar con Hox −, formando buey 2− y H 2 O. Las reacciones se pueden escribir de la siguiente manera:
\[ \underset{5.10\;mmol}{H_{2}ox}+\underset{6.60\;mmol}{OH^{-}} \rightarrow \underset{5.10\;mmol}{Hox^{-}}+ \underset{5.10\;mmol}{H_{2}O} \notag \]
\[ \underset{5.10\;mmol}{Hox^{-}}+\underset{1.50\;mmol}{OH^{-}} \rightarrow \underset{1.50\;mmol}{ox^{2-}}+ \underset{1.50\;mmol}{H_{2}O} \notag \]
En forma tabular,
| H 2 buey | OH − | Hox - | buey 2− | |
|---|---|---|---|---|
| inicial | 5.10 mmol | 6.60 mmol | 0 mmol | 0 mmol |
| cambio (paso 1) | −5.10 mmol | −5.10 mmol | +5.10 mmol | 0 mmol |
| final (paso 1) | 0 mmol | 1.50 mmol | 5.10 mmol | 0 mmol |
| cambio (paso 2) | — | −1.50 mmol | −1.50 mmol | +1.50 mmol |
| final | 0 mmol | 0 mmol | 3.60 mmol | 1.50 mmol |
B El equilibrio entre el ácido débil (Hox −) y su base conjugada (ox 2−) en la solución final está determinado por la magnitud de la segunda constante de ionización, K a2 = 10 −3.81 = 1.6 × 10 −4. Para calcular el pH de la solución, necesitamos conocer [H +], que se determina usando exactamente el mismo método que en la titulación de ácido acético en el Ejemplo 12:
volumen final de solución = 100.0 mL + 55.0 mL = 155.0 mL
Así, las concentraciones de Hox − y buey 2− son las siguientes:
\[ \left [ Hox^{-} \right ] = \dfrac{3.60 \; mmol \; Hox^{-}}{155.0 \; mL} = 2.32 \times 10^{-2} \;M \notag \]
\[ \left [ ox^{2-} \right ] = \dfrac{1.50 \; mmol \; ox^{2-}}{155.0 \; mL} = 9.68 \times 10^{-3} \;M \notag \]
Ahora podemos calcular [H +] en equilibrio usando la siguiente ecuación:
\[ K_{a2}= =\dfrac{\left [ ox^{2-} \right ]\left [ H^{+} \right ] }{\left [ Hox^{-} \right ]} \notag \]
Reordenando esta ecuación y sustituyendo los valores por las concentraciones de Hox − y buey 2−,
\[ \left [ H^{+} \right ] =\dfrac{K_{a2}\left [ Hox^{-} \right ]}{\left [ ox^{2-} \right ]} = \dfrac{\left ( 1.6\times 10^{-4} \right ) \left ( 2.32\times 10^{-2} \right )}{\left ( 9.68\times 10^{-3} \right )}=3.7\times 10^{-4} \; M \notag \]
Entonces
\[ pH = -log\left [ H^{+} \right ]= -log\left ( 3.7 \times 10^{-4} \right )= 3.43 \notag \]
Esta respuesta tiene sentido químico porque el pH se encuentra entre el primer y segundo p K a valores de ácido oxálico, como debe ser. Agregamos suficiente ión hidróxido para valorar completamente el primer protón más ácido (lo que debería darnos un pH mayor que p K a1), pero agregamos solo lo suficiente para valorar menos de la mitad del segundo, protón menos ácido, con p K a2. Si hubiéramos agregado exactamente el hidróxido suficiente para valorar completamente el primer protón más la mitad del segundo, estaríamos en el punto medio del segundo paso en la titulación, y el pH sería de 3.81, igual a p K a2.
Ejercicio
La piperazina es una base diprótica utilizada para controlar parásitos intestinales (“gusanos”) en mascotas y humanos. A un perro se le administran 500 mg (5.80 mmol) de piperazina (p K b1 = 4.27, p K b2 = 8.67). Si el estómago del perro contiene inicialmente 100 mL de HCl 0.10 M (pH = 1.00), calcule el pH del contenido del estómago después de la ingestión de la piperazina.
Respuesta: 4.9 (Video Solution)
Indicadores
En la práctica, la mayoría de las titulaciones ácido-base no se controlan registrando el pH en función de la cantidad de ácido fuerte o solución base utilizada como valorante. En cambio, a menudo se usa un indicador ácido-base que, si se selecciona cuidadosamente, experimenta un cambio dramático de color al pH correspondiente al punto de equivalencia de la titulación. Los indicadores son ácidos débiles o bases que exhiben colores intensos que varían con el pH. El ácido conjugado y la base conjugada de un buen indicador tienen colores muy diferentes para que puedan distinguirse fácilmente. Algunos indicadores son incoloros en la forma ácida conjugada pero intensamente coloreados cuando se desprotonan (fenolftaleína, por ejemplo), lo que los hace particularmente útiles.
Podemos describir la química de los indicadores mediante la siguiente ecuación general:
\[ HIn\left ( aq \right ) \rightleftharpoons H^{+}\left ( aq \right ) + In^{-}\left ( aq \right ) \notag \]
donde la forma protonada es designada por hIN y la base conjugada por In −. La constante de ionización para la desprotonación del indicador hIN es la siguiente:
\[ K_{In} =\dfrac{\left [ H^{+} \right ]\left [ In^{-} \right ]}{HIn} \tag{16.5.4}\]
El p K in (su p K a) determina el pH al que el indicador cambia de color.
Muchas sustancias diferentes pueden ser utilizadas como indicadores, dependiendo de la reacción particular a monitorear. Por ejemplo, el jugo de col roja contiene una mezcla de sustancias coloreadas que cambian de rojo intenso a pH bajo a azul claro a pH intermedio a amarillo a pH alto (Figura 16.22). En todos los casos, sin embargo, un buen indicador debe tener las siguientes propiedades:
- El cambio de color debe detectarse fácilmente.
- El cambio de color debe ser rápido.
- La molécula indicadora no debe reaccionar con la sustancia que se está valorando.
- Para minimizar los errores, el indicador debe tener un p K en que se encuentre dentro de una unidad de pH del pH esperado en el punto de equivalencia de la titulación.
Figura 16.5.6 Indicadores de pH naturales en jugo de col roja El jugo de col roja contiene una mezcla de sustancias cuyo color depende del pH. Cada tubo de ensayo contiene una solución de jugo de col roja en agua, pero el pH de las soluciones varía de pH = 2.0 (extremo izquierdo) a pH = 11.0 (extremo derecho). A pH = 7.0, la solución es azul. (De 99 Chemical en YouTube)
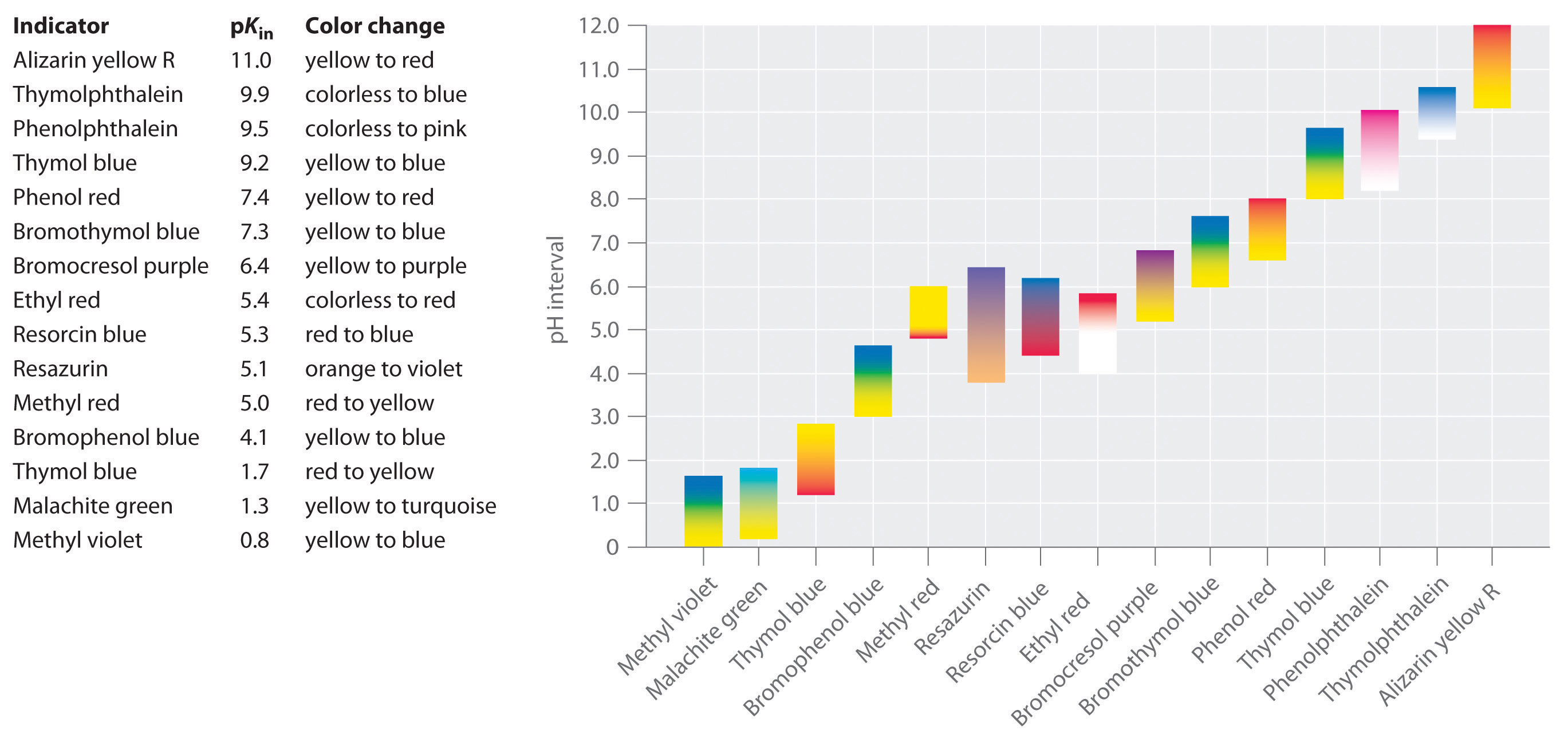
Se han desarrollado indicadores sintéticos que cumplen con estos criterios y cubren prácticamente todo el rango de pH. La Figura 16.5.7 muestra el rango de pH aproximado sobre el cual algunos indicadores comunes cambian de color y su cambio de color. Además, algunos indicadores (como el azul de timol) son los ácidos o bases polipróticos, que cambian de color dos veces a valores de pH ampliamente separados.
Figura 16.5.7 Algunos Indicadores de Ácido-Base Comunes Se muestran los colores aproximados, junto con p K en los valores y el rango de pH sobre el que cambia el color.
Es importante tener en cuenta que un indicador no cambia de color abruptamente a un valor de pH particular; en cambio, en realidad se somete a una titulación del pH igual que cualquier otro ácido o base. A medida que la concentración de hIN disminuye y la concentración de In − aumenta, el color de la solución cambia lentamente del color característico de hIN al de In −. Como veremos en la Sección 16.6, la relación [In −]/[hIN] cambia de 0.1 a un pH una unidad por debajo de p K en a 10 a un pH una unidad por encima de p K in. Así, la mayoría de los indicadores cambian de color en un rango de pH de aproximadamente dos unidades de pH.
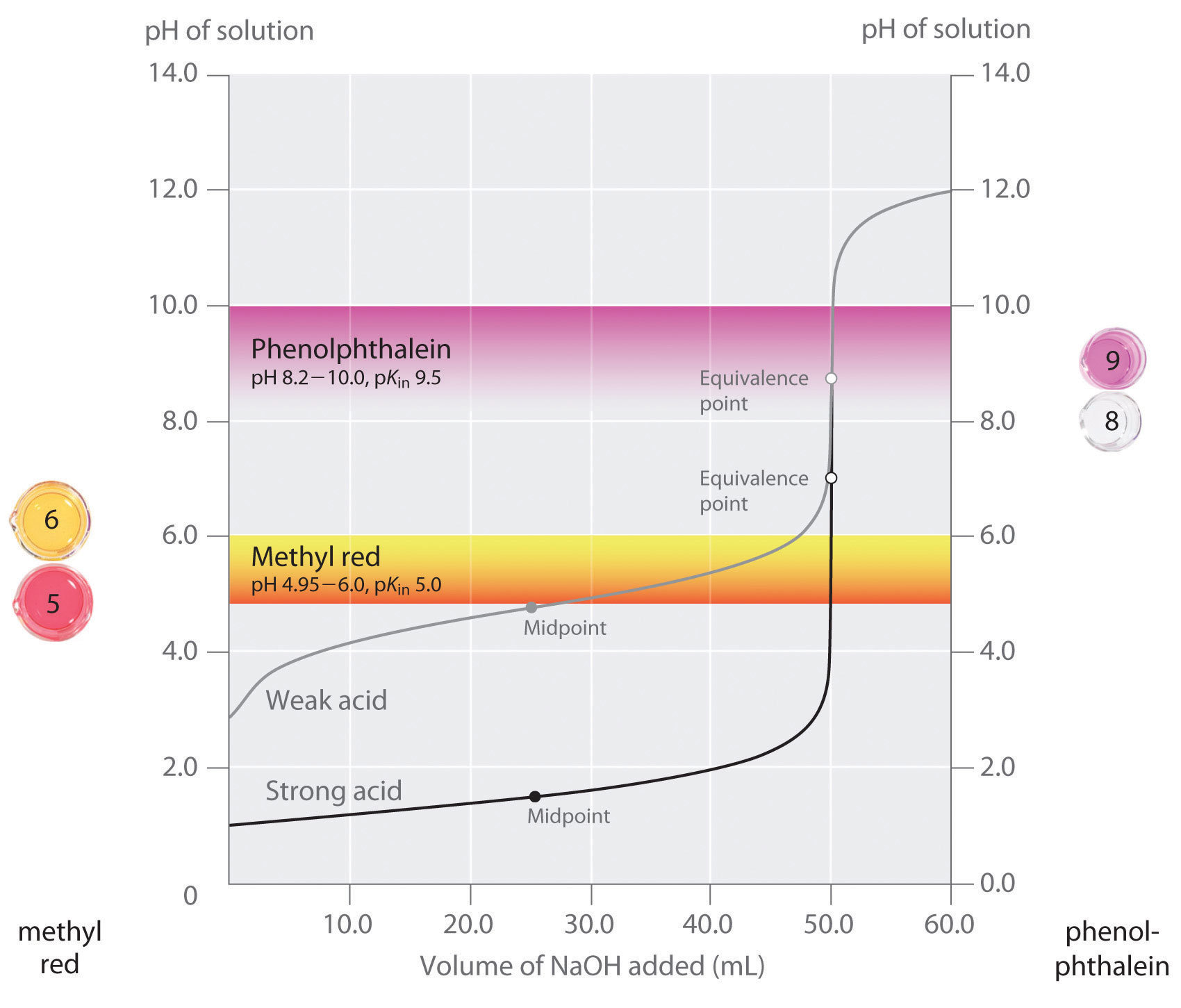
Hemos afirmado que un buen indicador debe tener un valor de p K que esté cerca del pH esperado en el punto de equivalencia. Para una titulación fuerte ácido-base fuerte, la elección del indicador no es especialmente crítica debido al cambio muy grande en el pH que ocurre alrededor del punto de equivalencia. Por el contrario, el uso del indicador incorrecto para una titulación de un ácido débil o una base débil puede dar como resultado errores relativamente grandes, como se ilustra en la Figura 16.5.8. Esta figura muestra gráficas de pH versus volumen de base añadida para la titulación de 50.0 mL de una solución 0.100 M de un ácido fuerte (HCl) y un ácido débil (ácido acético) con NaOH 0.100 M. También se muestran los rangos de pH sobre los cuales dos indicadores comunes (rojo de metilo, p K in = 5.0 y fenolftaleína, p K in = 9.5) cambian de color. Las barras horizontales indican los rangos de pH sobre los cuales ambos indicadores cambian de color cruzan la curva de titulación de HCl, donde es casi vertical. De ahí que ambos indicadores cambien de color cuando se ha agregado esencialmente el mismo volumen de NaOH (aproximadamente 50 mL), lo que corresponde al punto de equivalencia. En contraste, la titulación del ácido acético dará resultados muy diferentes dependiendo de si se usa rojo de metilo o fenolftaleína como indicador. Si bien el rango de pH sobre el cual la fenolftaleína cambia de color es ligeramente mayor que el pH en el punto de equivalencia de la titulación de ácido fuerte, el error será insignificante debido a la pendiente de esta porción de la curva de titulación. Al igual que con la titulación de HCl, el indicador de fenolftaleína se volverá rosado cuando se hayan agregado aproximadamente 50 mL de NaOH a la solución de ácido acético. En contraste, el rojo de metilo comienza a cambiar de rojo a amarillo alrededor de pH 5, que está cerca del punto medio de la titulación del ácido acético, no del punto de equivalencia. Por lo tanto, agregar solo alrededor de 25—30 ml de NaOH provocará que el indicador rojo de metilo cambie de color, lo que resultará en un gran error.
Figura 16.5.8 Elección del indicador correcto para una valoración ácido-base La gráfica muestra los resultados obtenidos utilizando dos indicadores (rojo de metilo y fenolftaleína) para la titulación de soluciones 0.100 M de un ácido fuerte (HCl) y un ácido débil (acético ácido) con NaOH 0.100 M. Debido a la pendiente de la curva de titulación de un ácido fuerte alrededor del punto de equivalencia, cualquiera de los indicadores cambiará rápidamente de color en el punto de equivalencia para la titulación del ácido fuerte. En contraste, el p K en para el rojo de metilo (5.0) está muy cerca del p K a del ácido acético (4.76); el punto medio del cambio de color para el rojo de metilo ocurre cerca del punto medio de la titulación, más que en el punto de equivalencia.
En general, para titulaciones de ácidos fuertes con bases fuertes (y viceversa), cualquier indicador con una p K entre aproximadamente 4.0 y 10.0 servirá. Para la titulación de un ácido débil, sin embargo, el pH en el punto de equivalencia es mayor a 7.0, por lo que se debe utilizar un indicador como fenolftaleína o azul de timol, con p K en > 7.0. Por el contrario, para la titulación de una base débil, donde el pH en el punto de equivalencia es menor a 7.0, se debe utilizar un indicador como rojo de metilo o azul de bromocresol, con p K en < 7.0.
La existencia de muchos indicadores diferentes con diferentes colores y p K en valores también proporciona una manera conveniente de estimar el pH de una solución sin usar un costoso medidor de pH electrónico y un electrodo de pH frágil. Las tiras de papel o plástico impregnadas con combinaciones de indicadores se utilizan como “papel de pH”, lo que permite estimar el pH de una solución simplemente sumergiendo un trozo de papel de pH en ella y comparando el color resultante con los estándares impresos en el recipiente (Figura 16.25).
Figura 16.5.9 pH El papel de pH de papel contiene un conjunto de indicadores que cambian de color a diferentes valores de pH. El pH aproximado de una solución se puede determinar simplemente sumergiendo una tira de papel en la solución y comparando el color con los estándares proporcionados.
Resumen
La forma de una curva de titulación, una gráfica de pH frente a la cantidad de ácido o base añadida, proporciona información importante sobre lo que ocurre en solución durante una titulación. Las formas de las curvas de titulación para ácidos y bases débiles dependen drásticamente de la identidad del compuesto. El punto de equivalencia de una titulación ácido-base es el punto en el que se ha agregado exactamente suficiente ácido o base para reaccionar completamente con el otro componente. El punto de equivalencia en la titulación de un ácido fuerte o una base fuerte ocurre a pH 7.0. En valoraciones de ácidos débiles o bases débiles, sin embargo, el pH en el punto de equivalencia es mayor o menor de 7.0, respectivamente. El pH tiende a cambiar más lentamente antes de alcanzar el punto de equivalencia en valoraciones de ácidos débiles y bases débiles que en valoraciones de ácidos fuertes y bases fuertes. El pH en el punto medio, el punto a mitad de camino en la curva de titulación al punto de equivalencia, es igual al p K a del ácido débil o al p K b de la base débil. Así, se pueden utilizar métodos de titulación para determinar tanto la concentración como la p K a (o la p K b) de un ácido débil (o una base débil). Los indicadores ácido-base son compuestos que cambian de color a un pH particular. Por lo general, son ácidos o bases débiles cuyos cambios de color corresponden a la desprotonación o protonación del propio indicador.
Llave para llevar
- Las gráficas de titulaciones ácido-base generan curvas de titulación que pueden ser utilizadas para calcular el pH, el pOH, el p K a y el p K b del sistema.
Problemas conceptuales
-
¿Por qué la porción de la curva de titulación que se encuentra por debajo del punto de equivalencia de una solución de un ácido débil se desplaza hacia arriba en relación con la curva de titulación de un ácido fuerte? ¿En qué se diferencian las pendientes de las curvas en el punto de equivalencia? ¿Por qué?
-
Predecir si cada solución será neutra, básica o ácida en el punto de equivalencia de cada titulación.
- Se valoró una solución acuosa de NaOH con HCl 0.100 M.
- Se valora una solución acuosa de etilamina (CH 3 CH 2 NH 2) con HNO 3 0.150 M
- Una solución acuosa de clorhidrato de anilina (C 6 H 5 NH 3 + Cl −) se titula con KOH 0.050 M.
-
Los valores de p K a de rojo fenol, azul de bromofenol y fenolftaleína son 7.4, 4.1 y 9.5, respectivamente. ¿Qué indicador es el más adecuado para cada titulación ácido-base?
- valorando una solución de Ba (OH) 2 con HCl 0.100 M
- titulación de una solución de trimetilamina (Me 3 N) con HNO 3 0.150 M
- titulación de una solución de clorhidrato de anilina (C 6 H 5 NH 3 + Cl −) con KOH 0.050 M
-
Para la titulación de cualquier ácido fuerte con cualquier base fuerte, el pH en el punto de equivalencia es 7.0. ¿Por qué no suele ser así en titulaciones de ácidos débiles o bases débiles?
-
¿Por qué las curvas de titulación para un ácido fuerte con una base fuerte y un ácido débil con una base fuerte son idénticas en forma por encima de los puntos de equivalencia pero no por debajo?
-
Describir lo que ocurre a nivel molecular durante la titulación de un ácido débil, como el ácido acético, con una base fuerte, como NaOH, en los siguientes puntos a lo largo de la curva de titulación. ¿Cuál de estos puntos corresponde a pH = p K a?
- al inicio de la titulación
- en el punto medio de la titulación
- en el punto de equivalencia
- cuando se ha agregado un exceso de titulante
-
A nivel molecular, describa lo que ocurre durante la titulación de una base débil, como el amoníaco, con un ácido fuerte, como el HCl, en los siguientes puntos a lo largo de la curva de titulación. ¿Cuál de estos puntos corresponde a PoH = p K b?
- al inicio de la titulación
- en el punto medio de la titulación
- en el punto de equivalencia
- cuando se ha agregado un exceso de titulante
-
Para la titulación de un ácido débil con una base fuerte, utilice la expresión K a para mostrar que pH = p K a en el punto medio de la titulación.
-
Los indicadores químicos se pueden utilizar para monitorear el pH de forma rápida y económica. Sin embargo, generalmente se prefieren los métodos electrónicos. ¿Por qué?
-
¿Por qué agregar cloruro de amonio a una solución de amoníaco en agua disminuye el pH de la solución?
-
Dado el sistema de equilibrio CH 3 CO 2 H (aq) CH 3 CO 2 − (aq) + H + (aq), explicar qué sucede con la posición del equilibrio y el pH en cada caso.
- Se agrega HCl diluido.
- Se agrega NaOH diluido.
- Se agrega acetato de sodio sólido.
-
Dado el sistema de equilibrio CH 3 NH 2 (aq) + H 2 O (l) CH 3 NH 3 + (aq) + OH − (aq), explicar qué sucede con la posición del equilibrio y el pH en cada caso.
- Se agrega HCl diluido.
- Se agrega NaOH diluido.
- Se agrega sólido CH 3 NH 3 + Cl −.
Responder
-
- se desplaza hacia la izquierda; el pH disminuye
- se desplaza hacia la derecha; aumenta el pH
- se desplaza hacia la izquierda; aumenta el pH
Problemas numéricos
-
Calcular el pH de cada solución.
- Se agrega un volumen de 25.0 mL de HCl 6.09 M a 100.0 mL de agua destilada
- Se agrega un volumen de 5.0 mL de NaOH 2.55 M a 75.0 mL de agua destilada.
-
¿Cuál es el pH de una solución preparada mezclando 50.0 mL de HCl 0.225 M con 100.0 mL de una solución 0.184 M de NaOH?
-
¿Qué volumen de HCl 0.50 M se necesita para neutralizar completamente 25.00 mL de NaOH 0.86 M?
-
Calcular el pH final cuando se mezcla cada par de soluciones.
- 100 mL de HCl 0.105 M y 100 mL de acetato de sodio 0.115 M
- 50 mL de HCl 0.10 M y 100 mL de acetato de sodio 0.15 M
- 100 mL de ácido acético 0.109 M y 100 mL de NaOH 0.118 M
- 100 mL de ácido acético 0.998 M y 50.0 mL de NaOH 0.110 M
-
Calcular el pH final cuando se mezcla cada par de soluciones.
- 100 mL de HCl 0.983 M y 100 mL de fluoruro de sodio 0.102 M
- 50.0 mL de HCl 0.115 M y 100 mL de fluoruro de sodio 0.109 M
- 100 mL de ácido fluorhídrico 0.106 M y 50.0 mL de NaOH 0.996 M
- 100 mL de acetato de sodio 0.107 M y 50.0 mL de ácido acético 0.987 M
-
El carbonato de calcio es uno de los principales contribuyentes a la “dureza” del agua. La cantidad de CaCo 3 en una muestra de agua se puede determinar titulando la muestra con un ácido, como HCl, que produce agua y CO 2. Escribe una ecuación química equilibrada para esta reacción. Generar una gráfica de pH de solución versus volumen de HCl 0.100 M agregado para la titulación de una solución de 250 mg de CaCo 3 en 200.0 mL de agua con HCl 0.100 M; supongamos que la solución de HCl se agrega en incrementos de 5.00 mL. ¿Qué volumen de HCl corresponde al punto de equivalencia?
-
Para una titulación de 50.0 mL de NaOH 0.288 M, le gustaría preparar una solución de HCl 0.200 M. La única solución de HCl disponible para usted, sin embargo, es 12.0 M.
- ¿Cómo prepararías 500 mL de una solución de HCl 0.200 M?
- ¿Aproximadamente qué volumen de su solución de HCl 0.200 M se necesita para neutralizar la solución de NaOH?
- Después de completar la titulación, encuentra que su solución de HCl “0.200 M” es en realidad 0.187 M. ¿Cuál fue el volumen exacto de valorante utilizado en la neutralización?
-
Mientras se valoran 50.0 mL de una solución 0.582 M de HCl con una solución etiquetada como “KOH 0.500 M”, sobrepasa el punto final. Para corregir el problema, agrega 10.00 mL de la solución de HCl a su matraz y luego continúa cuidadosamente la titulación. El volumen total de valorante necesario para la neutralización es de 71.9 mL.
- ¿Cuál es la molaridad real de su solución KOH?
- ¿Qué volumen de valorante se necesitó para neutralizar 50.0 mL del ácido?
-
Complete la siguiente tabla y genere una curva de titulación que muestre el pH versus volumen de base agregada para la titulación de 50.0 mL de HCl 0.288 M con NaOH 0.321 M. Indicar claramente el punto de equivalencia.
Base Añadida (mL) 10.0 30.0 40.0 45.0 50.0 55.0 65.0 75.0 pH -
Se obtuvieron los siguientes datos mientras se valoraban 25.0 mL de NaOH 0.156 M con una solución etiquetada como “HCl 0.202 M”. Trazar el pH versus el volumen del valorante agregado. Luego determine el punto de equivalencia de su gráfica y calcule la concentración exacta de su solución de HCl.
Volumen de HCl (mL) 5 10 15 20 25 30 35 pH 11.46 11.29 10.98 4.40 2.99 2.70 2.52 -
Rellenar los datos para la titulación de 50.0 mL de ácido fórmico 0.241 M con KOH 0.0982 M. El p K a del ácido fórmico es de 3.75. ¿Cuál es el pH de la solución en el punto de equivalencia?
Volumen de Base Añadida (mL) 0 5 10 15 20 25 pH -
El clorhidrato de glicina, que contiene la forma completamente protonada del aminoácido glicina, tiene la siguiente estructura:
Es un electrolito fuerte que se disocia completamente en el agua. La titulación con base da dos puntos de equivalencia: el primero corresponde a la desprotonación del grupo ácido carboxílico y el segundo a la pérdida del protón del grupo amonio. Las ecuaciones de equilibrio correspondientes son las siguientes:
\[ ^{+}NH_{3}-CH_{2}-CO_{2}H\left ( aq \right ) \rightleftharpoons \;\;\;\;\; pK_{a1}=2.3 \notag \]
\[ ^{+}NH_{3}-CH_{2}-CO_{2}\left ( aq \right )+ H^{+} \]
\[ ^{+}NH_{3}-CH_{2}-CO_{2}\left ( aq \right ) \rightleftharpoons \;\;\;\;\; pK_{a2}=9.6 \notag \]
\[ NH_{2}-CH_{2}-COO\left ( aq \right )+ H^{+} \notag \]
- Dado 50.0 mL de solución que es clorhidrato de glicina 0.430 M, ¿cuántos mililitros de KOH 0.150 M se necesitan para desprotonar completamente el grupo ácido carboxílico?
- ¿Cuántos mililitros adicionales de KOH se necesitan para desprotonar el grupo amonio?
- ¿Cuál es el pH de la solución en cada punto de equivalencia?
- ¿Cuántos mililitros de titulante se necesitan para obtener una solución en la que la glicina no tenga carga eléctrica neta? El pH al que una molécula como la glicina no tiene carga neta es su punto isoeléctrico. ¿Cuál es el punto isoeléctrico de la glicina?
-
¿Cuál es el pH de una solución preparada añadiendo 38.2 mL de HCl 0.197 M a 150.0 mL de piridina 0.242 M? El p K b de piridina es 8.77.
-
¿Cuál es el pH de una solución preparada añadiendo 40.3 mL de NaOH 0.289 M a 150.0 mL de ácido succínico 0.564 M (HO 2 CCH 2 CH 2 CO 2 H)? (Para el ácido succínico, p K a1 = 4.21 y p K a2 = 5.64).
-
Calcular el pH de una solución 0.15 M de ácido malónico (HO 2 CCH 2 CO 2 H), cuyos valores de p K a son los siguientes: p K a1 = 2.85 y p K a2 = 5.70.
RESPUESTAS
-
43 mL
- Solución de video
- Solución de video
- Solución de video
-
- diluir 8.33 mL de HCl 12.0 M a 500.0 mL
- 72 mL
- 77.0 mL
-
pH en el punto de equivalencia = 8.28
Volumen de Base Añadida (mL) 0 5 10 15 20 25 pH 2.19 2.38 2.70 2.89 3.04 3.15 -
1.85
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern