17.5: Solubilidad y pH
- Page ID
- 77998
- Entender por qué la solubilidad de muchos compuestos depende del pH.
La solubilidad de muchos compuestos depende fuertemente del pH de la solución. Por ejemplo, el anión en muchas sales escasamente solubles es la base conjugada de un ácido débil que puede protonarse en solución. Además, la solubilidad de compuestos binarios simples como óxidos y sulfuros, ambas bases fuertes, suele depender del pH. En esta sección se discute la relación entre la solubilidad de estas clases de compuestos y el pH.
El efecto de los equilibrios ácido-base sobre la solubilidad de sales
Comenzamos nuestra discusión examinando el efecto del pH sobre la solubilidad de una sal representativa, M + A −, donde A − es la base conjugada del ácido débil HA. Cuando la sal se disuelve en agua, se produce la siguiente reacción:
\[MA_{(s)} \rightleftharpoons M^+_{(aq)} + A^−_{(aq)} \tag{17.4.1a}\]
con
El anión también puede reaccionar con agua en una reacción de hidrólisis:
\[A^−_{(aq)} + H_2O_{(l)} \rightleftharpoons OH^−_{(aq)} + HA_{(aq)} \tag{17.4.2}\]
Debido a la reacción descrita en la Ecuación 17.4.2, se incrementa la solubilidad predicha de una sal escasamente soluble que tiene un anión básico como S2 -, PO 4 3− o CO 3 2−, como se describe en la Sección 17.1. Si en cambio se añade un ácido fuerte a la solución, el H + añadido reaccionará esencialmente por completo con A − para formar HA. Esta reacción disminuye [A −], lo que disminuye la magnitud del producto iónico (Q = [M +] [A −]). Según el principio de Le Chatelier, más MA se disolverá hasta Q = K sp. Por lo tanto, un pH ácido aumenta drásticamente la solubilidad de prácticamente todas las sales escasamente solubles cuyo anión es la base conjugada de un ácido débil. Por el contrario, el pH tiene poco o ningún efecto sobre la solubilidad de sales cuyo anión es la base conjugada de un ácido débil más fuerte o un ácido fuerte, respectivamente (por ejemplo, cloruros, bromuros, yoduros y sulfatos). Por ejemplo, la sal de hidróxido Mg (OH) 2 es relativamente insoluble en agua:
\[Mg(OH)_{2(s)} \rightleftharpoons Mg^{2+}_{(aq)} + 2OH^−_{(aq)} \tag{17.4.3a}\]
con
\[K_{sp} = 5.61 \times 10^{−12} \tag{17.4.3b}\]
Cuando se añade ácido a una solución saturada que contiene un exceso de Mg (OH) 2 sólido, se produce la siguiente reacción, eliminando OH − de la solución:
\[H^+_{(aq)} + OH^−_{(aq)} \rightarrow H_2O_{(l)} \tag{17.4.5}\]
La ecuación general para la reacción de Mg (OH) 2 con el ácido es así
\[Mg(OH)_{2(s)} + 2H^+_{(aq)} \rightleftharpoons Mg^{2+}_{(aq)} + 2H_2O_{(l)} \tag{17.4.6}\]
A medida que se agrega más ácido a una suspensión de Mg (OH) 2, el equilibrio mostrado en la Ecuación 17.4.6 es conducido hacia la derecha, por lo que se disuelve más Mg (OH) 2.
Dicha solubilidad dependiente del pH no se limita a sales que contienen aniones derivados del agua. Por ejemplo, CaF 2 es una sal escasamente soluble:
\[CaF_{2(s)} \rightleftharpoons Ca^{2+}_{(aq)} + 2F^−_{(aq)} \tag{17.4.7a}\]
con
\[K_{sp} = 3.45 \times 10^{−11} \tag{17.4.7b}\]
Cuando se añade ácido fuerte a una solución saturada de CaF 2, se produce la siguiente reacción:
\[H^+_{(aq)} + F^−_{(aq)} \rightleftharpoons HF_{(aq)} \tag{17.4.8}\]
Debido a que la reacción directa disminuye la concentración de iones fluoruro, más CaF 2 se disuelve para aliviar la tensión en el sistema. La reacción neta de CaF 2 con ácido fuerte es así
\[CaF_{2(s)} + 2H^+_{(aq)} \rightarrow Ca^{2+}_{(aq)} + 2HF_{(aq)} \tag{17.4.9}\]
El Ejemplo 7 muestra cómo calcular el efecto de solubilidad de añadir un ácido fuerte a una solución de una sal escasamente soluble.
Tenga en cuenta el patrón
Las sales escasamente solubles derivadas de ácidos débiles tienden a ser más solubles en una solución ácida.
Ejemplo 17.4.1
El oxalato de plomo (PbC 2 O 4), el yoduro de plomo (Pb2) y el sulfato de plomo (PbSO 4) son todos bastante insolubles, con valores de K sp de 4.8 × 10 −10, 9.8 × 10 −9 y 2.53 × 10 −8, respectivamente. ¿Qué efecto tiene la adición de un ácido fuerte, como el ácido perclórico, sobre sus solubilidades relativas?
Dado: Valores de K sp para tres compuestos
Preguntado por: solubilidades relativas en solución ácida
Estrategia:
Escribir la ecuación química balanceada para la disolución de cada sal. Debido a que la base conjugada más fuerte se verá más afectada por la adición de ácido fuerte, determinar las solubilidades relativas a partir de la basicidad relativa de los aniones.
Solución:
Los equilibrios de solubilidad para las tres sales son los siguientes:
\[PbC_2O_{4(s)} \rightleftharpoons Pb^{2+}_{(aq)} + C_2O^{2−}_{4(aq) \notag }\]
\[PbI_{2(s)} \rightleftharpoons Pb^{2+}_{(aq)} + 2I^−_{(aq)} \notag \]
\[PbSO_{4(s)} \rightleftharpoons Pb^{2+}_{(aq)} + SO^{2−}_{4(aq)} \notag \]
La adición de un ácido fuerte tendrá el mayor efecto sobre la solubilidad de una sal que contiene la base conjugada de un ácido débil como anión. Debido a que el HI es un ácido fuerte, predecimos que agregar un ácido fuerte a una solución saturada de PbI 2 no afectará en gran medida su solubilidad; el ácido simplemente se disociará para formar H + (aq) y el anión correspondiente. En contraste, el oxalato es la forma completamente desprotonada del ácido oxálico (HO 2 CCO 2 H), que es un ácido diprótico débil (p K a1 = 1.23 y p K a2 = 4.19). En consecuencia, el ion oxalato tiene una afinidad significativa por un protón y una menor afinidad por un segundo protón. Agregar un ácido fuerte a una solución saturada de oxalato de plomo dará como resultado las siguientes reacciones:
\[C_2O^{2−}_{4(aq)} + H^+_{(aq)} \rightarrow HO_2CCO^−_{2(aq)} \notag \]
Estas reacciones disminuirán [C 2 O 4 2−], provocando que se disuelva más oxalato de plomo para aliviar el estrés en el sistema.La p K a de HSO 4 − (1.99) es similar en magnitud a la p K a1 del ácido oxálico , por lo que añadir un ácido fuerte a una solución saturada de PbSO 4 dará como resultado la siguiente reacción:
\[ SO^{2-}_{4(aq)} + H^+_{(aq)} \rightleftharpoons HSO^-_{4(aq)} \notag \]
Debido a que HSO 4 − tiene un pKa de 1.99, esta reacción se ubicará en gran parte a la izquierda tal y como está escrito. En consecuencia, predecimos que el efecto del ácido fuerte agregado sobre la solubilidad de PbSO 4 será significativamente menor que para PbC 2 O 4.
Ejercicio
¿Cuál de las siguientes sales insolubles —AgCl, Ag 2 CO 3, Ag 3 PO 4 y/o AgBr— será sustancialmente más soluble en HNO 3 1.0 M que en agua pura?
Respuesta: Ag 2 CO 3 y Ag 3 PO 4
Las cuevas y sus pináculos asociados y espiras de piedra proporcionan uno de los ejemplos más impresionantes de equilibrios de solubilidad dependientes del pH (parte (a) en la Figura 17.6). Quizás las cuevas más familiares se forman a partir de piedra caliza, como las Cavernas Carlsbad en Nuevo México, Mammoth Cave en Kentucky y las Cavernas Luray en Virginia. Las reacciones primarias que son responsables de la formación de cuevas de piedra caliza son las siguientes:
\[CO_{2(aq)} + H_2O_{(l)} \rightleftharpoons H^+_{(aq)} + HCO^−_{3(aq)} \tag{17.4.10}\]
\[HCO^−_{3(aq)} \rightleftharpoons H+(aq) + CO^{2−}_{3(aq)} \tag{17.4.11}\]
\[Ca^{2+}_{(aq)} + CO^{2−}_{3(aq)} \rightleftharpoons CaCO_{3(s)} \tag{17.4.12}\]
Figura 17.4.1 La química de la formación de cuevas (a) Esta cueva en Campanet, Mallorca, España, y sus formaciones asociadas son ejemplos de equilibrios de solubilidad dependientes del pH. b) Se forma una cueva cuando el agua subterránea que contiene CO 2 atmosférico, formando una solución ácida, disuelve la piedra caliza (CaCo 3) en un proceso que puede tardar decenas de miles de años. A medida que el agua subterránea se filtra en una cueva, el agua se evapora de la solución de CaCo 3 en agua rica en CO 2, produciendo una solución sobresaturada y un cambio en el equilibrio que provoca la precipitación del CaCo 3 . La piedra caliza depositada finalmente forma estalactitas y estalagmitas.
Los depósitos de piedra caliza que forman cuevas consisten principalmente en CaCo 3 a partir de los restos de criaturas vivientes como almejas y corales, que lo utilizaron para hacer estructuras como conchas. Cuando una solución saturada de CaCo 3 en agua rica en CO 2 se eleva hacia la superficie de la Tierra o se calienta de otra manera, el gas CO 2 se libera a medida que el agua se calienta. CaCO 3 luego precipita de la solución de acuerdo con la siguiente ecuación (parte (b) en la Figura 17.4.1):
La dirección hacia adelante es la misma reacción que produce el sólido llamado escamas en teteras, cafeteras, calentadores de agua, calderas y otros lugares donde el agua dura se calienta repetidamente.
Cuando el CO 2 atmosférico que contiene agua subterránea (Ecuación 17.4.10 y Ecuación 17.4.11) encuentra su camino en grietas microscópicas en los depósitos de piedra caliza, CaCo 3 se disuelve en la solución ácida en la dirección inversa de la Ecuación 17.4.13. Las grietas se agrandan gradualmente de 10—50 µm a 5—10 mm, un proceso que puede tardar hasta 10,000 años. Eventualmente, después de unos 10 mil años más, se forma una cueva. El agua subterránea de la superficie se filtra hacia la cueva y se aferra al techo, donde el agua se evapora y hace que el equilibrio en la Ecuación 17.4.13 se desplace hacia la derecha. Se deposita una capa circular de CaCo 3 sólido, que finalmente produce una aguja larga y hueca de piedra caliza llamada estalactita que crece desde el techo. Abajo, donde las gotitas aterrizan cuando caen del techo, un proceso similar provoca que otra aguja, llamada estalagmita, crezca. Los mismos procesos que tallan huecos bajo tierra también se están trabajando sobre el suelo, en algunos casos produciendo paisajes fantásticamente enrevesados como el de la provincia de Yunnan en China (Figura 17.4.2).
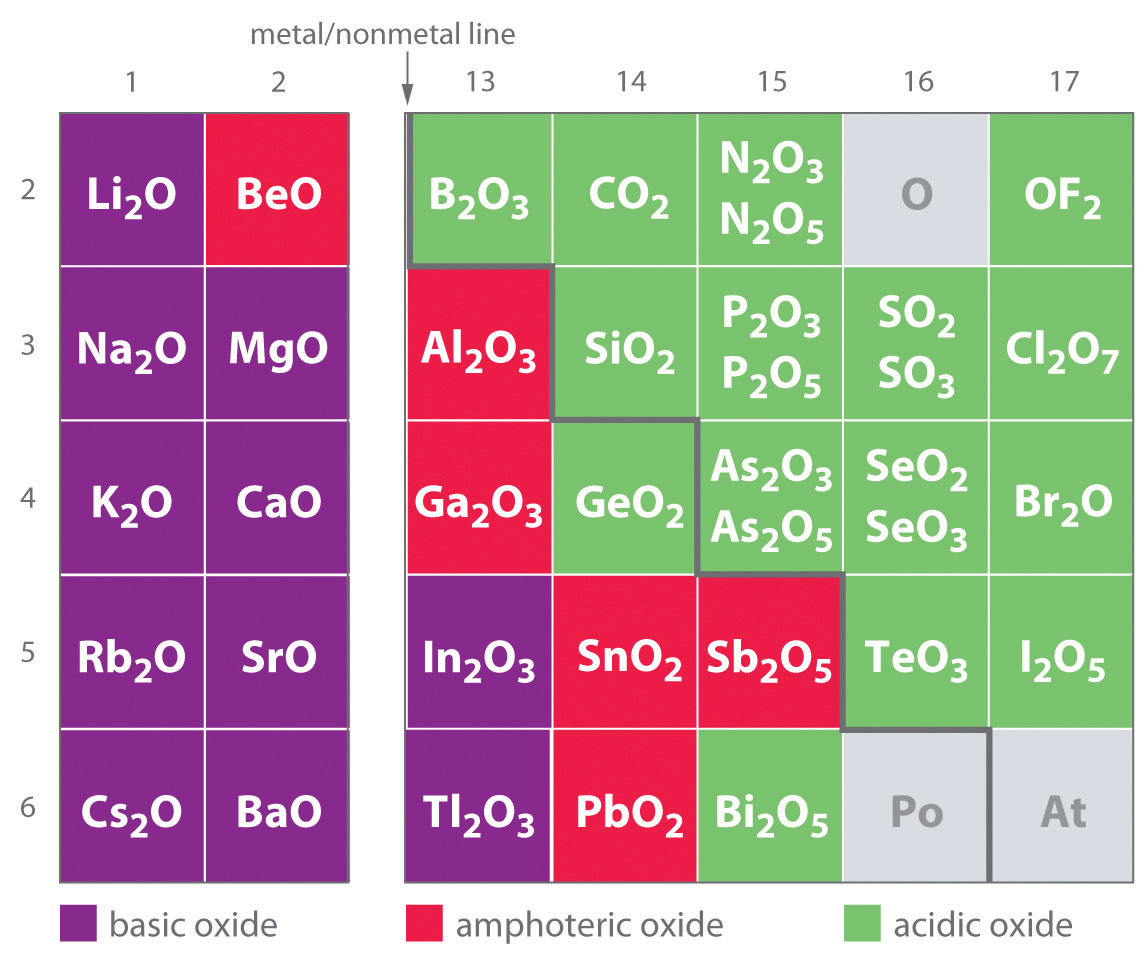
Óxidos e Hidróxidos Ácidos, Básicos y Anfóteros
Una de las primeras clasificaciones de sustancias se basó en su solubilidad en solución ácida versus básica, lo que condujo a la clasificación de óxidos e hidróxidos como básicos o ácidos. Óxidos básicos Óxido que reacciona con el agua para producir una solución básica o se disuelve fácilmente en ácido acuoso. e hidróxidos reaccionan con agua para producir una solución básica o se disuelven fácilmente en ácido acuoso. Óxidos ácidos Óxido que reacciona con el agua para producir una solución ácida o se disuelve en base acuosa. o bien los hidróxidos reaccionan con agua para producir una solución ácida o son solubles en base acuosa. Como se muestra en la Figura 17.4.3, existe una clara correlación entre el carácter ácido o básico de un óxido y la posición del elemento combinado con el oxígeno en la tabla periódica. Los óxidos de elementos metálicos son generalmente óxidos básicos, y los óxidos de elementos no metálicos son óxidos ácidos. Compare, por ejemplo, las reacciones de un óxido metálico típico, óxido de cesio y un óxido no metálico típico, trióxido de azufre, con agua:
\[Cs_2O_{(s)} + H_2O_{(l)} \rightarrow 2Cs^+_{(aq)} + 2OH^−_{(aq)} \tag{17.4.14}\]
\[SO_{3(g)} + H_2O_{(l)} \rightarrow H_2SO_{4(aq)} \tag{17.4.15}\]
El óxido de cesio reacciona con el agua para producir una solución básica de hidróxido de cesio, mientras que el trióxido de azufre reacciona con el agua para producir una solución de ácido sulfúrico, ¡comportamientos muy diferentes de hecho!
Tenga en cuenta el patrón
Los óxidos metálicos generalmente reaccionan con el agua para producir soluciones básicas, mientras que los óxidos no metálicos producen soluciones ácidas.
La diferencia en la reactividad se debe a la diferencia en la unión en los dos tipos de óxidos. Debido a la baja electronegatividad de los metales en el extremo izquierdo de la tabla periódica, sus óxidos se ven mejor como que contienen cationes M n + discretos y aniones O 2−. En el otro extremo del espectro se encuentran los óxidos no metálicos; debido a sus mayores electronegatividades, los no metales forman óxidos con enlaces covalentes al oxígeno. Sin embargo, debido a la alta electronegatividad del oxígeno, el enlace covalente entre el oxígeno y el otro átomo, E, suele estar polarizado: E δ+ —O δ−. El átomo E en estos óxidos actúa como un ácido de Lewis que reacciona con el átomo de oxígeno del agua para producir un oxoácido. Los óxidos de metales en estados de alta oxidación también tienden a ser óxidos ácidos por la misma razón: contienen enlaces covalentes al oxígeno. Un ejemplo de un óxido metálico ácido es MoO 3, que es insoluble tanto en agua como en ácido pero se disuelve en una base fuerte para dar soluciones del ion molibdato (MoO 4 2−):
\[MoO_{3(s)} + 2OH^−_{(aq)} \rightarrow MoO^{2−}_{4(aq)} + H_2O_{(l)} \tag{17.4.16}\]
Figura 17.4.3 Clasificación de los Óxidos de los Elementos del Grupo Principal Según Su Carácter Ácido o Básico Existe una transición gradual de óxidos básicos a óxidos ácidos de la parte inferior izquierda a la superior derecha en la tabla periódica. Los óxidos de elementos metálicos son generalmente óxidos básicos, que o bien reaccionan con el agua para formar una solución básica o se disuelven en ácido acuoso. En contraste, los óxidos de elementos no metálicos son óxidos ácidos, que o bien reaccionan con el agua para formar una solución ácida o son solubles en base acuosa. Los óxidos de carácter intermedio, llamados óxidos anfóteros, se ubican a lo largo de una línea diagonal entre los dos extremos. Los óxidos anfóteros se disuelven en ácido para producir agua o se disuelven en base para producir un ion complejo soluble. (Los elementos radiactivos no están clasificados.)
Como se muestra en la Figura 17.4.3, existe una transición gradual de óxidos metálicos básicos a óxidos no metálicos ácidos a medida que vamos de la parte inferior izquierda a la parte superior derecha en la tabla periódica, con una amplia banda diagonal de óxidos de carácter intermedio que separa los dos extremos. Muchos de los óxidos de los elementos en esta región diagonal de la tabla periódica son solubles tanto en soluciones ácidas como básicas; en consecuencia, se les llama óxidos anfóteros Un óxido que puede disolverse en ácido para producir agua y disolverse en base para producir un soluble complejo. (del griego ampho, que significa “ambos”, como en anfiprótico, que se definió en la Sección 16.1). Los óxidos anfóteros se disuelven en ácido para producir agua o se disuelven en base para producir un complejo soluble. Como se muestra en la Figura 17.4.4, por ejemplo, mezclar el óxido anfótero Cr (OH) 3 (también escrito como Cr 2 O 3 ·3H 2 O) con agua da una suspensión fangosa, morado-marrón. La adición de ácido hace que el Cr (OH) 3 se disuelva para dar una solución violeta brillante de Cr 3+ (aq), que contiene el ion [Cr (H 2 O) 6] 3+, mientras que al agregar una base fuerte se obtiene una solución verde del ion [Cr (OH) 4] −. Las ecuaciones químicas para las reacciones son las siguientes:
\(\mathrm{Cr(OH)_3(s)}+\mathrm{3H^+(aq)}\rightarrow\underset{\textrm{violet}}{\mathrm{Cr^{3+}(aq)}}+\mathrm{3H_2O(l)} \tag{17.4.17}\)
Figura 17.4.4 Hidróxido de Cromo (III) [Cr (OH) 3 o Cr 2 O 3 ·3H 2 O] Es un Ejemplo de un Óxido Anfótero Los tres vasos de precipitados originalmente contenían una suspensión de Cr (OH) 3 (s) púrpura parduzco (centro). Cuando se concentró ácido (6 M H 2 SO 4) al vaso de precipitados de la izquierda, se disolvió Cr (OH) 3 para producir iones violeta [Cr (H 2 O) 6] 3+ y agua. La adición de base concentrada (NaOH 6 M) al vaso de precipitados de la derecha provocó la disolución de Cr (OH) 3, produciendo iones verdes [Cr (OH) 4] −.
Ejemplo 17.4.2
El hidróxido de aluminio, escrito como Al (OH) 3 o Al 2 O 3 ·3H 2 O, es anfótero. Escribir ecuaciones químicas para describir la disolución del hidróxido de aluminio en (a) ácido y (b) base.
Dado: compuesto anfóterico
Preguntado por: reacciones de disolución en ácido y base
Estrategia:
Usando la Ecuación 17.4.17 y la Ecuación 17.4.18 como guía, escriba las reacciones de disolución en soluciones ácidas y bases.
Solución:
- Un ácido dona protones al hidróxido para dar agua y el ion metálico hidratado, por lo que el hidróxido de aluminio, que contiene tres iones OH − por Al, necesita tres iones H +:
\[Al(OH)_{3(s)} + 3H^+_{(aq)} \rightarrow Al^{3+}_{(aq)} + 3H_2O_{(l)} \notag \]
En solución acuosa, Al 3+ forma el ion complejo [Al (H 2 O) 6] 3+.
- En solución básica, se añade OH − al compuesto para producir un complejo de poli (hidroxo) soluble y estable: \[Al(OH)_{3(s)} + OH^−_{(aq)} \rightarrow [Al(OH)_4]^−_{(aq)} \notag \]
Ejercicio
El hidróxido de cobre (II), escrito como Cu (OH) 2 o CuO·h 2 O, es anfótero. Escribir ecuaciones químicas que describan la disolución del hidróxido cúprico tanto en un ácido como en una base.
Contestar
\[Cu(OH)_{2(s)} + 2H^+_{(aq)} \rightarrow Cu^{2+}_{(aq)} + 2H_2O_{(l)} \notag \]
\[Cu(OH)_{2(s)} + 2OH^−_{(aq)} \rightarrow [Cu(OH)_4]^2_{−(aq)} \notag \]
Precipitación Selectiva Usando pH
Muchos iones metálicos disueltos pueden ser separados por la precipitación selectiva de los cationes de la solución bajo condiciones específicas. En esta técnica, a menudo se utiliza el pH para controlar la concentración del anión en solución, que controla qué cationes precipitan.
Tenga en cuenta el patrón
La concentración de aniones en solución a menudo se puede controlar ajustando el pH, permitiendo así la precipitación selectiva de cationes.
Supongamos, por ejemplo, que tenemos una solución que contiene 1.0 mM Zn 2+ y 1.0 mM Cd 2+ y queremos separar los dos metales por precipitación selectiva como las sales de sulfuro insolubles, ZnS y CdS. Los equilibrios de solubilidad relevantes se pueden escribir de la siguiente manera:
\[ZnS_{(s)} \rightleftharpoons Zn^{2+}_{(aq)} + S^{2−}_{(aq)} \tag{17.4.19a}\]
con
\[K_{sp}= 1.6 \times 10^{−24} \tag{17.4.19b}\]
y
\[CdS_{(s)} \rightleftharpoons Cd^{2+}_{(aq)} + S^{2−}_{(aq)} \tag{17.4.20a}\]
con
Debido a que el ion S2 - es bastante básico y reacciona extensamente con agua para dar HS − y OH −, los equilibrios de solubilidad se escriben con mayor precisión como MS (s) = M 2+ (aq) +HS - (aq) + OH - (aq) en lugar de MS (s) = M 2+ (aq) +S2 - (aq) Aquí utilizamos la forma más simple que involucra S2−, la cual se justifica porque tomamos en cuenta la reacción de S2− con el agua más adelante en la solución, llegando a la misma respuesta usando cualquiera de las dos ecuaciones de equilibrio.
Las concentraciones de sulfuro necesarias para hacer precipitar ZnS y CdS son las siguientes:
\[K_{sp} = [Zn^{2+}][S^{2−}] \tag{17.4.21a}\]
\[1.6 \times 10^{−24} = (0.0010\; M)[S^{2−}]\tag{17.4.21b}\]
\[1.6 \times 10^{−21}\; M = [S^{2−}]\tag{17.4.21c}\]
y
\[K_{sp} = [Cd^{2+}][S^{2−}] \tag{17.4.22a}\]
\[8.0 \times 10^{−27} = (0.0010\; M)[S^{2−}]\tag{17.4.22b}\]
\[8.0 \times 10^{−24}\; M = [S^{2−}] \tag{17.4.22c}\]
Así, concentraciones de sulfuro entre 1.6 × 10 −21 M y 8.0 × 10 −24 M precipitarán CdS de la solución pero no ZnS. ¿Cómo obtenemos concentraciones tan bajas de sulfuro? Una solución acuosa saturada de H 2 S contiene 0.10 M H 2 S a 20°C; la p K a1 para H 2 S es 6.97 y p K a2 correspondiente a la formación de [S2 −] es 12.90. Las ecuaciones para estas reacciones son las siguientes:
\[H_2S_{(aq)} \rightleftharpoons H^+_{(aq)} + HS^−_{(aq)} \tag{17.4.24a}\]
con
\[pK_{a1} = 6.97 \; \text{and hence} \; K_{a1} = 1.1 \times 10^{−7} \tag{17.4.24b}\]
\[HS^−_{(aq)} \rightleftharpoons H^+_{(aq)} + S^{2−}_{(aq)} \tag{17.4.24c}\]
con
\[pK_{a2} = 12.90 \; \text{and hence} \; K_{a2} = 1.3 \times 10^{−13} \tag{17.4.24d}\]
Podemos demostrar que la concentración de S2 − es 1.3 × 10 −13 comparando K a1 y K a2 y reconociendo que la contribución a [H +] de la disociación de HS − es despreciable en comparación con [H + ] de la disociación de H 2 S. Así, sustituyendo 0.10 M en la ecuación por K a1 por la concentración de H 2 S, que es esencialmente constante independientemente del pH, da lo siguiente:
\\ x=1.1\ times10^ {-4}\ textrm {M} = [\ mathrm {H^+}] = [\ mathrm {HS^-}]\ tag {17.4.5}\]
Sustituyendo este valor por [H +] y [HS −] en la ecuación para K a2,
Aunque [S2 -] en una solución H 2 S es muy baja (1.3 × 10 −13 M), burbujear H 2S a través de la solución hasta que esté saturada precipitaría ambos iones metálicos porque la concentración de S2- sería entonces mucho mayor que 1.6 × 10 −21 M. Así debemos ajustar [S 2−] para mantenernos dentro del rango deseado. La forma más directa de hacerlo es ajustar [H +] añadiendo ácido a la solución H 2 S (recordar el principio de Le Chatelier), impulsando así el equilibrio en la Ecuación 17.4.244 hacia la izquierda. La ecuación general para la disociación de H 2 S es la siguiente:
\[H_2S_{(aq)} \rightleftharpoons 2H^+_{(aq)} + S^{2−}_{(aq)} \tag{17.4.26}\]
Ahora podemos usar la constante de equilibrio K para la reacción global, que es el producto de K a1 y K a2, y la concentración de H 2 S en una solución saturada para calcular la concentración de H + necesaria para producir [S 2−] de 1.6 × 10 −21 M:
\[K=K_{\textrm{a1}}K_{\textrm{a2}}=(1.1\times10^{-7})(1.3\times10^{-13})=1.4\times10^{-20}=\dfrac{[\mathrm{H^+}]^2[\mathrm{S^{2-}}]}{[\mathrm{H_2S}]} \tag{17.4.27}\]
\\ [\ mathrm {H^+}] &=0.94\ notag\ end {align}\ tag {17.4.28}\]
Por lo tanto, agregar un ácido fuerte como HCl para hacer que la solución sea 0.94 M en H + evitará que precipiten los ZnS más solubles al tiempo que se asegura que los CdS menos solubles precipitarán cuando la solución esté saturada con H 2 S.
Ejemplo 17.4.3
Una solución contiene 0.010 M Ca 2+ y 0.010 M La 3+. ¿Qué concentración de HCl se necesita para precipitar La 2 (C 2 O 4) 3 ·9H 2 O pero no Ca (C 2 O 4) ·H 2 O si la concentración de ácido oxálico es 1.0 M? Los valores de K sp son 2.32 × 10 −9 para Ca (C 2 O 4) y 2.5 × 10 −27 para La 2 (C 2 O 4) 3; p K a1 = 1.25 y p K a2 = 3.81 para ácido oxálico.
Dado: concentraciones de cationes, valores de K sp, y valores de concentración y p K a para ácido oxálico
Preguntado por: concentración de HCl necesaria para precipitación selectiva de La 2 (C 2 O 4) 3
Estrategia:
A Escriba cada expresión de producto de solubilidad y calcule la concentración de oxalato necesaria para que ocurra la precipitación. Determinar el rango de concentración necesario para la precipitación selectiva de La 2 (C 2 O 4) 3 ·9H 2 O.
B Agregar las ecuaciones para la primera y segunda disociaciones de ácido oxálico para obtener una ecuación general para la disociación de ácido oxálico a oxalato. Sustituir el [ox 2−] necesario para precipitar La 2 (C 2 O 4) 3·9H 2 O en la ecuación general para la disociación del ácido oxálico para calcular el requerido [H +].
Solución:
A Debido a que las sales tienen diferentes estequiometrías, no podemos comparar directamente las magnitudes de los productos de solubilidad. En cambio, debemos usar la expresión constante de equilibrio para cada producto de solubilidad para calcular la concentración de oxalato necesaria para que se produzca la precipitación. Usando ox 2− para oxalato, escribimos la expresión del producto de solubilidad para oxalato de calcio de la siguiente manera:
\[K_{sp} = [Ca^{2+}][ox^{2−}] = (0.010)[ox^{2−}] = 2.32 \times 10^{−9} \notag \]
\[[ox^{2−}] = 2.32 \times 10^{−7}\; M \notag \]
La expresión para oxalato de lantano es la siguiente:
\[K_{sp} = [La^{3+}]^2[ox^{2−}]^3 = (0.010)^2[ox^{2−}]^3 = 2.5 \times 10^{−27} \notag \]
\[[ox^{2−}] = 2.9 \times 10^{−8}\; M \notag \]
Así, el oxalato de lantano es menos soluble y precipitará selectivamente cuando la concentración de oxalato esté entre 2.9 × 10 −8 M y 2.32 × 10-7 M.
B Para evitar que Ca 2+ precipite como oxalato de calcio, debemos agregar suficiente H + para dar una concentración máxima de oxalato de 2.32 × 10 −7 M. Podemos calcular el [H +] requerido usando la ecuación general para la disociación de ácido oxálico a oxalato:
Sustituir la concentración de oxalato deseada en la expresión constante de equilibrio,
\\ [\ mathrm {H^+}] &=\ textrm {6.1 M}\ notag\ end {align}\ notag\)
Por lo tanto, agregar suficiente HCl para dar [H +] = 6.1 M provocará que solo La 2 (C 2 O 4) 3·9H 2 O precipite de la solución.
Ejercicio
Una solución contiene 0.015 M Fe 2+ y 0.015 M Pb 2+. ¿Qué concentración de ácido se necesita para asegurar que el Pb 2+ precipite como PbS en una solución saturada de H 2 S, pero el Fe 2+ no precipita como FeS? Los valores de K sp son 6.3 × 10 −18 para FeS y 8.0 × 10 −28 para PbS.
Respuesta: 0,018 M H +
Resumen
El anión en muchas sales escasamente solubles es la base conjugada de un ácido débil. A pH bajo, la protonación del anión puede aumentar drásticamente la solubilidad de la sal. Los óxidos pueden clasificarse como óxidos ácidos u óxidos básicos. Los óxidos ácidos reaccionan con el agua para dar una solución ácida o se disuelven en una base fuerte; la mayoría de los óxidos ácidos son óxidos no metálicos u óxidos de metales en estados de oxidación alta. Los óxidos básicos reaccionan con el agua para dar una solución básica o se disuelven en ácido fuerte; la mayoría de los óxidos básicos son óxidos de elementos metálicos. Los óxidos o hidróxidos que son solubles tanto en soluciones ácidas como básicas se denominan óxidos anfóteros. La mayoría de los elementos cuyos óxidos presentan comportamiento anfótero se encuentran a lo largo de la línea diagonal que separa metales y no metales en la tabla periódica. En soluciones que contienen mezclas de iones metálicos disueltos, el pH puede usarse para controlar la concentración de aniones necesaria para precipitar selectivamente el catión deseado.
Llave para llevar
- El anión en sales escasamente solubles suele ser la base conjugada de un ácido débil que puede protonarse en solución, por lo que la solubilidad de los óxidos y sulfuros simples, ambas bases fuertes, a menudo depende del pH.
Problemas conceptuales
-
¿Cuál de los siguientes mostrará el mayor incremento en la solubilidad si se usa 1 M HNO 3 en lugar de agua destilada? Explica tu razonamiento.
- CuCl 2
- K [Pb (OH) 3]
- Ba (CH 3 CO 2) 2
- CaCo 3
-
De los compuestos Sn (CH 3 CO 2) 2 y SnS, uno es soluble en HCl diluido y el otro es soluble solo en HCl concentrado caliente. ¿Cuál es cuál? Proporcionar una explicación razonable.
-
¿En qué parte de la tabla periódica espera encontrar elementos que formen óxidos básicos? ¿Dónde espera encontrar elementos que formen óxidos ácidos?
-
Debido a que el agua puede autoionizarse, reacciona con óxidos ya sea como base (como OH −) o como ácido (como H 3 O +). ¿Se espera que los óxidos de elementos en estados de oxidación alta sean más ácidos (reaccionando con OH −) o más básicos (reaccionando con H 3 O +) que los óxidos correspondientes en estados de baja oxidación? ¿Por qué?
-
Dadas las muestras sólidas de CrO, Cr 2 O 3 y CrO 3, ¿cuál esperaría que fuera la más ácida (reacciona más fácilmente con OH −)? ¿Cuál sería el más básico (reacciona más fácilmente con H 3 O +)? ¿Por qué?
-
¿Cuál de estos elementos —Be, B, Al, N, Se, In, Tl, Pb— espera formar un óxido anfótero? ¿Por qué?
Problemas numéricos
-
Una solución de 1.0 L contiene 1.98 M Al (NO 3) 3. ¿Qué son [OH −] y [H +]? ¿Qué pH se requiere para precipitar el catión como Al (OH) 3? K sp = 1.3 × 10 −33 y K a = 1.05 × 10 −5 para el ion Al 3+ hidratado.
-
Una solución de 1.0 L contiene 2.03 M de CoCl 2. ¿Qué es [H +]? ¿Qué pH se requiere para precipitar el catión como Co (OH) 2? K sp = 5.92 × 10 −15 y K a = 1.26 × 10 −9 para el ion Co 2+ hidratado.
-
Dados 100 mL de una solución que contiene 0.80 mM Ag + y 0.80 mM Cu +, ¿se pueden separar los dos metales por precipitación selectiva como las sales de bromuro insolubles añadiendo 10 mL de una solución 8.0 mM de KBr? Los valores de K sp son 6.27 × 10 −9 para CuBr y 5.35 × 10 −13 para AgBr. ¿Qué máximo [Br −] separará los iones?
-
Dados 100 mL de una solución que es 1.5 mM en Tl +, Zn 2+ y Ni 2+, ¿qué iones pueden separarse de la solución añadiendo 5.0 mL de una solución 12.0 mM de Na 2 C 2 O 4?
Precipitado K sp Tl 2 C 2 O 4 2 × 10 −4 ZnC 2 O 4 ·2H 2 O 1.38 × 10 −9 NIC 2 O 4 4 × 10 −10 ¿Cuántos mililitros de 12.0 mM Na 2 C 2 O 4 deben agregarse para separar Tl + y Zn 2+ del Ni 2+?
RESPUESTAS
-
[H +] = 4.56 × 10 −3; [OH −] = 2.19 × 10 −12; pH = 2.94
-
No; ambos iones metálicos precipitarán; AgBr precipitará a medida que se añade Br − y CuBr comenzará a precipitar a [Br −] = 8.6 × 10 −6 M.
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern