18.1: Termodinámica y Trabajo
- Page ID
- 78093
- Comprender las relaciones entre el trabajo, el calor y la energía.
- Familiarizarse con el concepto de trabajo fotovoltaico.
Comenzamos nuestra discusión sobre la termodinámica revisando algunos términos importantes introducidos en el Capítulo 9. Primero, hay que distinguir entre un sistema y su entorno. Un sistema es aquella parte del universo en la que nos interesa, como una mezcla de gases en una bombilla de vidrio o una solución de sustancias en un matraz. Los alrededores son todo lo demás, el resto del universo. Por lo tanto, podemos afirmar lo siguiente:
\[ system + surroundings = universe \tag{18.1.1} \]
Un sistema cerrado, como el contenido de un frasco sellado, no puede intercambiar materia con su entorno, mientras que un sistema abierto puede; en este caso, podemos convertir un sistema cerrado (el frasco) en un sistema abierto retirando la tapa del frasco.
En el Capítulo 9, también introdujimos el concepto de función estatal Una propiedad de un sistema cuya magnitud depende únicamente del estado presente del sistema, no de su historia anterior. , propiedad de un sistema que depende únicamente del estado actual del sistema, no de su historia. Así, un cambio en una función de estado depende únicamente de la diferencia entre los estados inicial y final, no del camino utilizado para ir de uno a otro. Para ayudar a entender el concepto de una función estatal, imagina a una persona subiendo una montaña (Figura 18.1.1). Si la persona está bien entrenada y en forma, es posible que pueda escalar casi verticalmente hasta la cima (camino A), mientras que otra persona menos atlética puede elegir un camino que se enrolla gradualmente hacia la cima (camino B). Si ambos excursionistas parten del mismo punto en la base de la montaña y terminan en el mismo punto en la cima, su cambio neto de altitud será el mismo independientemente del camino elegido. De ahí que la altitud sea una función de estado. Por otro lado, una persona puede o no llevar un paquete pesado y puede escalar en climas cálidos o fríos. Estas condiciones influirían en los cambios en el nivel de fatiga del excursionista, lo que depende del camino tomado y de las condiciones experimentadas. La fatiga, por lo tanto, no es una función de estado. La termodinámica generalmente se ocupa de las funciones estatales y no trata de cómo ocurre el cambio entre el estado inicial y el estado final.
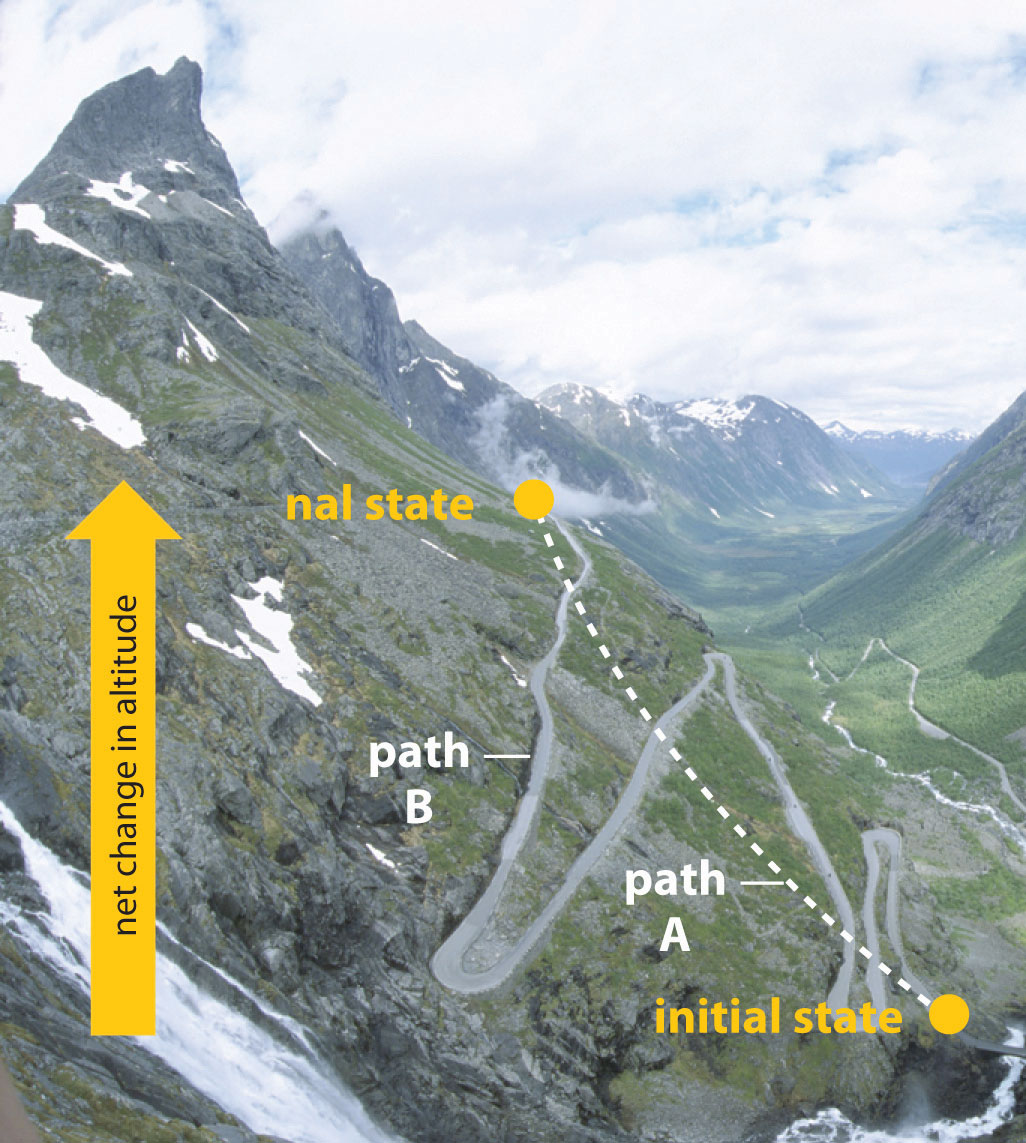
Figura 18.1.1 La altitud es una función de estado. Al subir una montaña, una persona puede decidir tomar el camino A, que es casi vertical, o el sendero B, que poco a poco va llegando hasta la cima. Independientemente del camino tomado, el cambio neto de altitud que va desde el estado inicial (parte inferior de la subida) hasta el estado final (parte superior de la subida) es el mismo. Así, la altitud es una función de estado.
Las conexiones entre el trabajo, el calor y la energía
La energía interna (E) Una función de estado que es la suma de las energías cinéticas y potenciales de todos los componentes de un sistema. de un sistema es la suma de la energía potencial y la energía cinética de todos los componentes; la energía interna es una función de estado. Aunque un sistema cerrado no puede intercambiar materia con su entorno, puede intercambiar energía con su entorno de dos maneras: haciendo trabajo o liberando o absorbiendo calor, el flujo de energía térmica. Por lo tanto, el trabajo y el calor son dos formas distintas de cambiar la energía interna de un sistema. Definimos el trabajo (w) en el Capítulo 9 como una fuerza F que actúa a través de una distancia d:
\( w=Fd \tag{18.1.2}\)
Debido a que el trabajo ocurre solo cuando un objeto, como una persona, o una sustancia, como el agua, se mueve contra una fuerza opuesta, el trabajo requiere que un sistema y su entorno estén conectados. En contraste, el flujo de calor, la transferencia de energía por diferencias de temperatura entre dos objetos, representa una conexión térmica entre un sistema y su entorno. Así, hacer el trabajo provoca un desplazamiento físico, mientras que el flujo de calor provoca un cambio de temperatura. Las unidades de trabajo y calor deben ser las mismas porque ambos procesos dan como resultado la transferencia de energía. En el sistema SI, esas unidades son julios (J), la misma unidad utilizada para la energía. No hay diferencia entre un cambio de energía provocado al trabajar en un sistema y un cambio igual de energía provocado al calentarlo.
Las conexiones entre el trabajo, el calor y la energía fueron descritas por primera vez por Benjamin Thompson (1753-1814), un científico nacido en Estados Unidos que también era conocido como Conde Rumford. Mientras supervisaba la fabricación de cañones, Rumford reconoció la relación entre la cantidad de trabajo requerido para perforar un cañón y la temperatura del agua utilizada para enfriarlo durante el proceso de perforación (Figura 18.1.2). En ese momento, generalmente se pensaba que el calor y el trabajo eran fenómenos separados y no relacionados. De ahí que las ideas de Rumford no fueron ampliamente aceptadas hasta muchos años después, luego de que sus hallazgos hubieran sido corroborados en otros laboratorios.
Figura 18.1.2 La relación entre el calor y el trabajo En la década de 1780, un científico estadounidense llamado Benjamin Thompson, también conocido como Conde Rumford, fue contratado por el Elector de Baviera para supervisar la fabricación de cañones. Durante el proceso de fabricación, equipos de caballos aprovechados a una rueda dentada grande suministraron la potencia necesaria para perforar un agujero de varias pulgadas de diámetro recto por el centro de un cilindro macizo de latón o bronce, el cual fue enfriado por agua. Con base en sus observaciones, Rumford se convenció de que el calor y el trabajo son formas equivalentes de transferir energía.
Trabajo PV
Como vimos en el Capítulo 9, hay muchos tipos de trabajo, incluyendo el trabajo mecánico, el trabajo eléctrico y el trabajo contra un campo gravitacional o magnético. Aquí consideraremos únicamente el trabajo mecánico, enfocándonos en el trabajo realizado durante los cambios en la presión o el volumen de un gas. Para describir este trabajo presión-volumen (trabajo PV), utilizaremos rarezas imaginarias tales como pistones sin fricción, que no implican ningún componente de resistencia, y gases ideales, que no tienen interacciones atractivas o repulsivas.
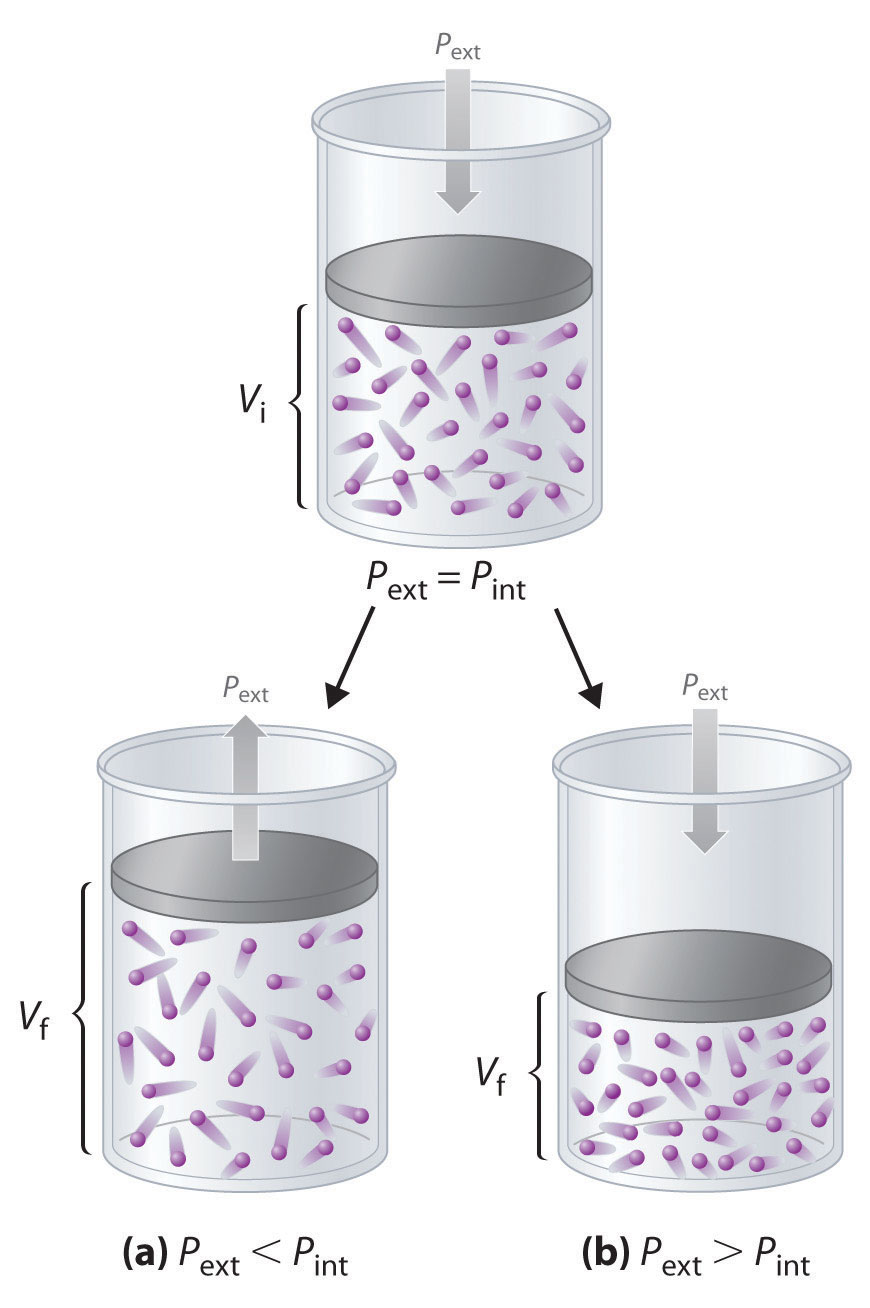
Imagínese, por ejemplo, un gas ideal, confinado por un pistón sin fricción, con presión interna P int y volumen inicial V i (Figura 18.1.3). Si P ext = P int, el sistema está en equilibrio; el pistón no se mueve y no se realiza ningún trabajo. Sin embargo, si la presión externa sobre el pistón (P ext) es menor que P int, entonces el gas ideal dentro del pistón se expandirá, obligando al pistón a realizar trabajos en su entorno; es decir, el volumen final (V f) será mayor que V i. Si P ext > P int, entonces el gas se comprimirá, y los alrededores realizarán trabajos en el sistema.
Si el pistón tiene área de sección transversal A, la presión externa ejercida por el pistón es, por definición, la fuerza por unidad de área: P ext = F/A. El volumen de cualquier objeto tridimensional con lados paralelos (como un cilindro) es el área de la sección transversal por la altura (V = Ah). Reordenando para dar F = P ext A y definiendo la distancia que se mueve el pistón (d) como Δ h, podemos calcular la magnitud del trabajo realizado por el pistón sustituyendo en la Ecuación 18.1.2:
\[ w=Fd=P_{ext}A\Delta h \tag{18.1.3}\]
Figura 18.1.3 Trabajo PV Usando un pistón sin fricción, si la presión externa es menor que P int (a), el gas ideal dentro del pistón se expandirá, obligando al pistón a realizar trabajos en su entorno. El volumen final (V f) será mayor que V i. Alternativamente, si la presión externa es mayor que P int (b), el gas se comprimirá y los alrededores realizarán trabajos en el sistema.
El cambio en el volumen del cilindro (Δ V) a medida que el pistón se mueve una distancia d es Δ V = A Δ h, como se muestra en la Figura 18.1.4. El trabajo realizado es así
\[ w=P_{ext}\Delta V \tag{18.1.4}\]
Las unidades de trabajo obtenidas usando esta definición son correctas para la energía: la presión es fuerza por unidad de área (newton/m 2) y el volumen tiene unidades de metros cúbicos, por lo que
\( w=\left ( \dfrac{F}{A} \right ) \Delta V= \dfrac{newton}{m^{2}\times m^{3}} \)
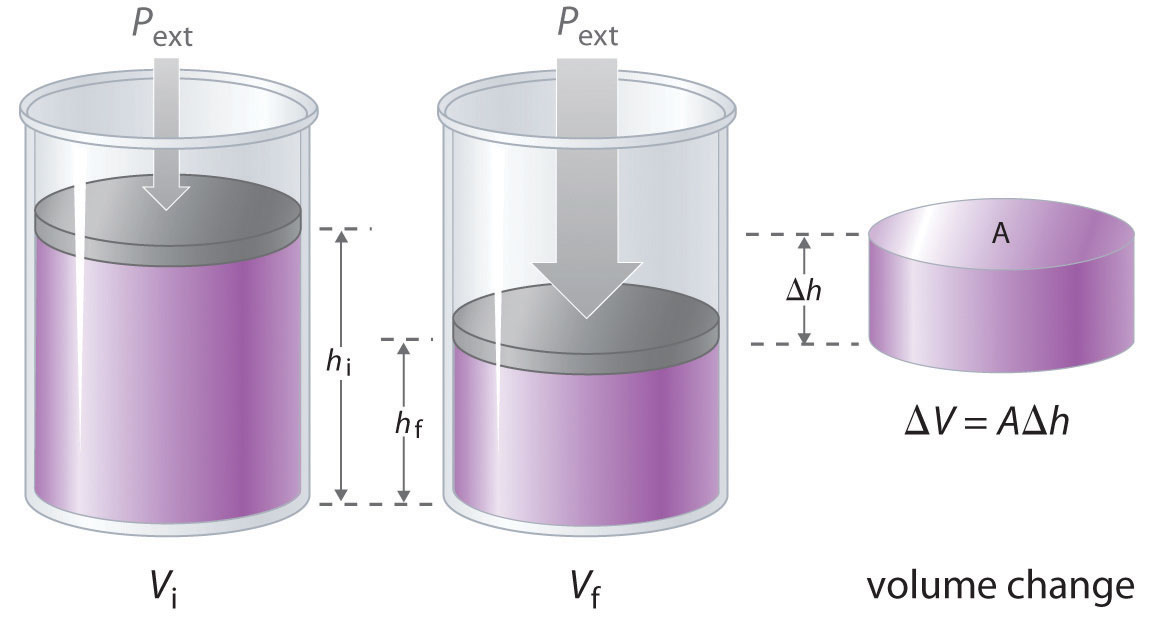
Figura 18.1.4 Trabajo realizado con un cambio de volumen El cambio en el volumen (Δ V) del cilindro que aloja un pistón es Δ V = A Δ h a medida que el pistón se mueve. El trabajo realizado por el entorno en el sistema a medida que el pistón se mueve hacia adentro viene dado por w = P ext Δ V.
Si utilizamos atmósferas para P y litros para V, obtenemos unidades de L·atm para el trabajo. Estas unidades corresponden a unidades de energía, como se muestra en los diferentes valores de la constante de gas ideal R:
\( R= \dfrac{0.08206\;L\cdot atm}{mol\cdot K} =\dfrac{8.314\;J}{mol\cdot K} \notag \)
Así 0.08206 L·atm = 8.314 J y 1 l·atm = 101.3 J. (Para mayor información sobre la ley de gas ideal, ver Capítulo 10.)
Que el trabajo se defina como tener un signo positivo o negativo es cuestión de convención. En el Capítulo 9, definimos el flujo de calor de un sistema a su entorno como negativo. Usando esa misma convención de signos, definimos el trabajo realizado por un sistema en su entorno como tener un signo negativo porque resulta en una transferencia de energía de un sistema a su entorno. Se trata de una convención arbitraria y que no se usa universalmente. Algunas disciplinas de ingeniería están más interesadas en el trabajo realizado en el entorno que en el trabajo realizado por el sistema y por lo tanto utilizan la convención opuesta. Debido a que Δ V > 0 para una expansión, la Ecuación 18.4 debe escribirse con un signo negativo para describir el trabajo PV realizado por el sistema como negativo:
\( w= P_{ext}\Delta V \tag{18.1.5} \)
El trabajo realizado por un gas que se expande contra una presión externa es, por lo tanto, negativo, correspondiente al trabajo realizado por un sistema en su entorno. Por el contrario, cuando un gas es comprimido por una presión externa, Δ V < 0 y el trabajo es positivo porque se está trabajando en un sistema por su entorno.
Supongamos, por ejemplo, que el sistema en estudio es una masa de vapor calentada por la combustión de varios cientos de libras de carbón y encerrada dentro de un cilindro que aloja un pistón unido al cigüeñal de una gran máquina de vapor. El gas no es ideal, y el cilindro no es sin fricción. Sin embargo, cuando el vapor entra en la cámara del motor y el gas en expansión empuja contra el pistón, el pistón se mueve, por lo que se realiza un trabajo útil. De hecho, la obra fotovoltaica puso en marcha la Revolución Industrial del siglo XIX y alimenta el motor de combustión interna del que la mayoría de nosotros todavía confiamos para el transporte.
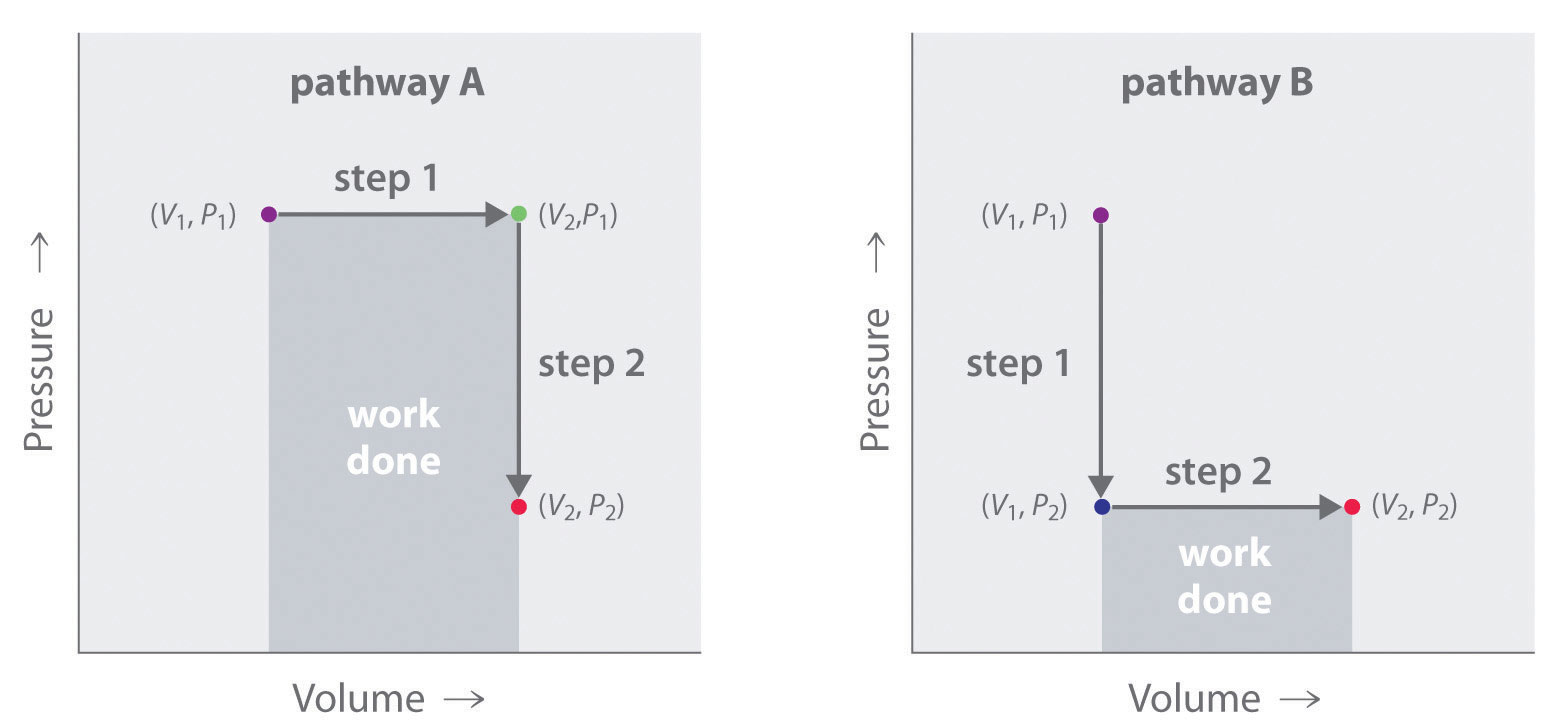
A diferencia de la energía interna, el trabajo no es una función estatal. Esto lo podemos ver examinando la Figura 18.1.5, en la que dos vías diferentes, de dos etapas, llevan un sistema gaseoso de un estado inicial a un estado final con los correspondientes cambios de temperatura. En la vía A, el volumen de un gas se incrementa inicialmente mientras su presión permanece constante (paso 1); luego su presión disminuye mientras el volumen permanece constante (paso 2). En la vía B, se invierte el orden de los pasos. Las temperaturas, presiones y volúmenes de los estados inicial y final son idénticos en ambos casos, pero la cantidad de trabajo realizado, indicada por las áreas sombreadas en la figura, es sustancialmente diferente. Como podemos ver, la cantidad de trabajo realizado depende del camino tomado de (V 1, P 1) a (V 2, P 2), lo que significa que el trabajo no es una función de estado.
Tenga en cuenta el patrón
La energía interna es una función de estado, mientras que el trabajo no lo es.
Figura 18.1.5 El trabajo no es una función de estado En la vía A, el volumen de un gas se incrementa inicialmente mientras su presión permanece constante (paso 1). Luego se disminuye su presión mientras el volumen permanece constante (paso 2). La vía B invierte estos pasos. Si bien (V 1, P 1) y (V 2, P 2) son idénticos en ambos casos, la cantidad de trabajo realizado (área sombreada) depende de la vía tomada.
Ejemplo 18.1.1
Un pequeño motor de combustión interna de alto rendimiento tiene seis cilindros con un desplazamiento nominal total (volumen) de 2.40 L y una relación de compresión 10:1 (lo que significa que el volumen de cada cilindro disminuye en un factor de 10 cuando el pistón comprime la mezcla aire-gas dentro del cilindro antes del encendido). ¿Cuánto trabajo en julios se realiza cuando un gas en un cilindro del motor se expande a temperatura constante contra una presión opuesta de 40.0 atm durante el ciclo del motor? Supongamos que el gas es ideal, el pistón no tiene fricción y no se pierde energía como calor.
Dado: volumen final, relación de compresión y presión externa
Preguntado por: trabajo realizado
Estrategia:
A Calcular el volumen final de gas en un solo cilindro. Luego compute el volumen inicial de gas en un solo cilindro a partir de la relación de compresión.
B Utilice la Ecuación 18.1.5 para calcular el trabajo realizado en litros-atmósferas. Convertir de litro-atmósferas a julios.
Solución:
A Para calcular el trabajo realizado, necesitamos conocer los volúmenes inicial y final. El volumen final es el volumen de uno de los seis cilindros con el pistón completamente hacia abajo: V f = 2.40 L/6 = 0.400 L. Con una relación de compresión 10:1, el volumen del mismo cilindro con el pistón todo el camino hacia arriba es V i = 0.400 L/10 = 0.0400 L. El trabajo se realiza por el sistema en su entorno, por lo que el trabajo es negativo.
\( w= -P_{ext}\Delta V=-\left ( 40.0\;atm \right )\left ( 0.400\;L-0.0400\;L \right )=14.4\; L\cdot atm \)
Convertir de litro-atmósferas a julios,
\( w= -P_{ext}\Delta V=-\left (14.4\; \cancel{L\cdot atm} \right )\left [ 101.3J/\left ( \cancel{L\cdot atm} \right ) \right ]=-1.46\times 10^{3}\;J \)
En el siguiente ejercicio, verá que el concepto de trabajo no se limita a los motores y pistones. También se encuentra en otras aplicaciones.
Ejercicio
Respirar requiere trabajo, aunque no seas consciente de ello. El volumen pulmonar de un hombre de 70 kg en reposo cambió de 2200 mL a 2700 mL cuando inhaló, mientras que sus pulmones mantuvieron una presión de aproximadamente 1.0 atm. ¿Cuánto trabajo en litro-atmósferas y julios se requirió para tomar un solo respiro? Durante el ejercicio, su volumen pulmonar cambió de 2200 mL a 5200 mL en cada respiración. ¿Cuánto trabajo adicional en julios requirió para tomar aliento mientras hacía ejercicio?
Respuesta: −0.500 l·atm, o −50.7 J; −304 J; si respira cada tres segundos, esto corresponde a 1.4 Calorías por minuto (1.4 kcal).
Resumen
La termodinámica es el estudio de las interrelaciones entre el calor, el trabajo y el contenido energético de un sistema en equilibrio. La suma de la energía potencial y la energía cinética de todos los componentes de un sistema es la energía interna (E) del sistema, que es una función de estado. Cuando se cambia la presión o el volumen de un gas, cualquier trabajo mecánico realizado se denomina trabajo fotovoltaico. El trabajo realizado por un sistema en su entorno recibe un valor negativo, mientras que el trabajo realizado en un sistema por su entorno tiene un valor positivo.
Llave para llevar
- La energía interna es una función de estado que es la suma del potencial y la energía cinética del sistema, mientras que el trabajo no es una función de estado.
Problemas conceptuales
-
La termodinámica se centra en la energía de los reactivos y productos y proporciona información sobre la composición del sistema de reacción en equilibrio. ¿Qué información sobre los sistemas de reacción no es proporcionada por la termodinámica?
-
Dado un sistema en el que una sustancia puede producir cualquiera de dos posibles productos, A → B o A → C, ¿cuál de los siguientes puede predecirse usando termodinámica química?
- En equilibrio, la concentración del producto C es mayor que la concentración del producto B.
- El producto C se forma más rápidamente que el producto B.
- La reacción A → C es exotérmica.
- Se forman intermedios de baja energía en la reacción A → B.
- La reacción A → C es espontánea.
-
¿De qué dos maneras puede un sistema cerrado intercambiar energía con su entorno? ¿Estos dos procesos son dependientes de ruta o independientes de ruta?
-
Un horno de microondas funciona proporcionando suficiente energía para rotar las moléculas de agua, lo que produce calor. ¿Se puede describir el cambio en la energía interna de una taza de agua calentada en un horno microondas como una función de estado? ¿Se puede describir el calor producido como una función de estado?
RESPUESTAS
-
La termodinámica no nos dice nada sobre la velocidad a la que los reactivos se convierten en productos.
-
calor y trabajo; dependiente de la trayectoria
Problemas numéricos
-
Calcular el trabajo realizado en julios en cada proceso.
- comprimir 12.8 L de gas hidrógeno a una presión externa de 1.00 atm a 8.4 L a una temperatura constante
- expandiendo 21.9 L de gas oxígeno a una presión externa de 0.71 atm a 23.7 L a una temperatura constante
-
¿Cuánto trabajo en julios se realiza cuando el oxígeno se comprime de un volumen de 22.8 L y una presión externa de 1.20 atm a 12.0 L a una temperatura constante? ¿El trabajo fue realizado por el sistema o los alrededores?
-
El champán se embotella a una presión de CO 2 de aproximadamente 5 atm. ¿Cuál es la fuerza sobre el corcho si su área de sección transversal es de 2.0 cm 2? ¿Cuánto trabajo se realiza si un corcho de 2.0 g vuela una distancia de 8.2 pies directamente en el aire cuando se hace estallar el corcho? ¿El trabajo fue realizado por el sistema o los alrededores?
-
Un mol de agua se convierte en vapor a 1.00 atm de presión y 100°C. Suponiendo un comportamiento ideal, ¿cuál es el cambio de volumen cuando el agua se convierte de un líquido a un gas? Si esta transformación se realizara en un cilindro con pistón, ¿cuánto trabajo se podría hacer vaporizando el agua a 1.00 atm? ¿El trabajo es realizado por el sistema o los alrededores?
-
La aceleración debida a la gravedad en la superficie terrestre es de 9.8 m/s 2. ¿Cuánto trabajo realiza una persona de 175 lb que sobrepasa las Cataratas del Niágara (aproximadamente 520 pies de altura) en un barril que pesa 145 lb?
-
Recordemos que la fuerza puede expresarse como masa multiplicada por aceleración (F = ma). La aceleración debida a la gravedad en la superficie terrestre es de 9.8 m/s 2.
- ¿Cuál es la fuerza gravitacional sobre una persona que pesa 52 kg?
- ¿Cuánto trabajo se realiza si la persona salta de un edificio en llamas por una ventana que está a 20 m sobre el suelo?
- Si la persona aterriza en un cojín de rescate grande equipado con una válvula de liberación de presión que mantiene una presión interna de 1.5 atm, ¿cuánto aire se expulsa del cojín?
-
Se permite que un gas se expanda de un volumen de 2.3 L a un volumen de 5.8 L. Durante el proceso, se transfieren 460 J de calor del entorno al gas.
- ¿Cuánto trabajo se ha realizado si el gas se expande contra un vacío?
- ¿Cuánto trabajo se ha realizado si el gas se expande contra una presión de 1.3 atm?
- ¿Cuál es el cambio en la energía interna del sistema?
-
Se permite que un mol de un gas ideal se expanda desde un volumen inicial de 0.62 L hasta un volumen final de 1.00 L a temperatura constante contra una presión externa constante de 1.0 atm. ¿Cuánto trabajo se ha realizado?
RESPUESTAS
-
−230 kJ
-
- 0 J
- −460 J
- 0 J
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern