18.5: Energía Libre
- Page ID
- 78094
- Comprender la relación entre la energía libre de Gibbs y el trabajo.
Uno de los principales objetivos de la termodinámica química es establecer criterios para predecir si una reacción o proceso particular ocurrirá espontáneamente. Hemos desarrollado uno de esos criterios, el cambio en la entropía del universo: si ΔS univ > 0 para un proceso o una reacción, entonces el proceso ocurrirá espontáneamente como está escrito. Por el contrario, si ΔS univ < 0, un proceso no puede ocurrir espontáneamente; si ΔS univ = 0, el sistema está en equilibrio. El signo de ΔS univ es un indicador universalmente aplicable e infalible de la espontaneidad de una reacción. Desafortunadamente, el uso de ΔS univ requiere que calculemos ΔS tanto para un sistema como para su entorno. Esto no es particularmente útil por dos razones: normalmente nos interesa mucho más el sistema que en el entorno, y es difícil hacer mediciones cuantitativas del entorno (es decir, el resto del universo). Un criterio de espontaneidad que se base únicamente en las funciones estatales de un sistema sería mucho más conveniente y es proporcionado por una nueva función estatal: la energía libre de Gibbs.
La energía libre de Gibbs y la dirección de las reacciones espontáneas
La energía libre de Gibbs (\(G\)), a menudo llamada simplemente energía libre, fue nombrada en honor a J. Willard Gibbs (1838—1903), un físico estadounidense que desarrolló por primera vez el concepto. Se define en términos de otras tres funciones de estado con las que ya estás familiarizado: entalpía, temperatura y entropía:
\[ G = H − TS \label{Eq1}\]
Debido a que es una combinación de funciones de estado, también\(G\) es una función de estado.
Nacido en Connecticut, Josiah Willard Gibbs asistió a Yale, al igual que su padre, profesor de literatura sagrada en Yale, quien estuvo involucrado en el juicio de Amistad. En 1863, Gibbs fue galardonado con el primer doctorado en ingeniería otorgado en Estados Unidos. Fue nombrado profesor de física matemática en Yale en 1871, la primera cátedra de este tipo en Estados Unidos. Su serie de ponencias titulada “Sobre el equilibrio de las sustancias heterogéneas” fue la base del campo de la química física y es considerada uno de los grandes logros del siglo XIX. Gibbs, cuya obra fue traducida al francés por Le Chatelier, vivió con su hermana y cuñado hasta su muerte en 1903, poco antes de la inauguración de los Premios Nobel.
El criterio para predecir la espontaneidad se basa en (\(ΔG\)), el cambio en\(G\), a temperatura y presión constantes. Aunque muy pocas reacciones químicas ocurren realmente en condiciones de temperatura y presión constantes, la mayoría de los sistemas pueden volver a la temperatura y presión iniciales sin afectar significativamente el valor de las funciones del estado termodinámico como\(G\). A temperatura y presión constantes,
\[ ΔG = ΔH − TΔS \label{Eq2}\]
donde todas las cantidades termodinámicas son las del sistema. Recordemos que a presión constante\(ΔH = q\),, si un proceso es reversible o irreversible, y TΔS = q rev. Usando estas expresiones, podemos reducir Ecuación\(\ref{Eq2}\) a\(ΔG = q − q_{rev}\). Así ΔG es la diferencia entre el calor liberado durante un proceso (a través de una trayectoria reversible o irreversible) y el calor liberado para el mismo proceso que ocurre de manera reversible. Bajo la condición especial en la que ocurre un proceso de manera reversible, q = q rev y ΔG = 0. Como veremos pronto, si\(ΔG\) es cero, el sistema está en equilibrio, y no habrá cambio neto.
¿Qué pasa con los procesos para los cuales ΔG ≠ 0? Para entender cómo el signo de ΔG para un sistema determina la dirección en la que el cambio es espontáneo, podemos reescribir la relación entre\(\Delta S \) y\(q_{rev}\), discutida anteriormente.
\[ \Delta S= \dfrac{q_{rev}}{T} \]
con la definición de\(\Delta H\) en términos de\(q_{rev}\)
\[ q_{rev} = ΔH \]
para obtener
\[\Delta S_{\textrm{surr}}=-\dfrac{\Delta H_{\textrm{sys}}}{T} \label{Eq3}\]
Así, el cambio de entropía del entorno está relacionado con el cambio de entalpía del sistema. Hemos afirmado que para una reacción espontánea\(ΔS_{univ} > 0\), por lo que sustituyendo obtenemos
\[\begin{align} \Delta S_{\textrm{univ}}&=\Delta S_{\textrm{sys}}+\Delta S_{\textrm{surr}}>0 \\[4pt] &=\Delta S_{\textrm{sys}}-\dfrac{\Delta H_{\textrm{sys}}}{T}>0\end{align}\]
Multiplicar ambos lados de la desigualdad por −T invierte el signo de la desigualdad; reordenando,
\[ΔH_{sys}−TΔS_{sys}<0\]
que es igual a\(ΔG\) (Ecuación\(\ref{Eq2}\)). Por lo tanto, podemos ver que para un proceso espontáneo,\(ΔG < 0\).
La relación entre el cambio de entropía del entorno y el calor ganado o perdido por el sistema proporciona la conexión clave entre las propiedades termodinámicas del sistema y el cambio en la entropía del universo. La relación mostrada en Ecuación nos\(\ref{Eq2}\) permite predecir la espontaneidad centrándonos exclusivamente en las propiedades termodinámicas y la temperatura del sistema. Predecimos que los procesos altamente exotérmicos (\(ΔH \ll 0\)) que incrementan el trastorno de un sistema (\(ΔS_{sys} \gg 0\)) se producirían por tanto espontáneamente. Un ejemplo de tal proceso es la descomposición del fertilizante de nitrato de amonio. También se utilizó nitrato de amonio para destruir el Edificio Federal Murrah en Oklahoma City, Oklahoma, en 1995. Para un sistema a temperatura y presión constantes, podemos resumir los siguientes resultados:
- Si\(ΔG < 0\), el proceso ocurre espontáneamente.
- Si\(ΔG = 0\), el sistema está en equilibrio.
- Si\(ΔG > 0\), el proceso no es espontáneo como está escrito sino que ocurre espontáneamente en sentido inverso.
Para entender mejor cómo los diversos componentes de ΔG dictan si un proceso ocurre espontáneamente, ahora nos fijamos en un cambio físico simple y familiar: la conversión del agua líquida en vapor de agua. Si este proceso se lleva a cabo a 1 atm y el punto de ebullición normal de 100.00°C (373.15 K), podemos calcular ΔG a partir del valor medido experimentalmente de ΔH vap (40.657 kJ/mol). Para vaporizar 1 mol de agua\(ΔH = 40,657; J\), por lo que el proceso es altamente endotérmico. De la definición de ΔS (Ecuación\(\ref{Eq3}\)), sabemos que para 1 mol de agua,
\[\begin{align*} \Delta S_{\textrm{vap}}&=\dfrac{\Delta H_{\textrm{vap}}}{T_\textrm b} \\[4pt] &=\dfrac{\textrm{40,657 J}}{\textrm{373.15 K}} \\[4pt] &=\textrm{108.96 J/K} \end{align*}\]
De ahí que haya un incremento en el desorden del sistema. En el punto de ebullición normal del agua,
\[\begin{align*}\Delta G_{100^\circ\textrm C}&=\Delta H_{100^\circ\textrm C}-T\Delta S_{100^\circ\textrm C} \\[4pt] &=\textrm{40,657 J}-[(\textrm{373.15 K})(\textrm{108.96 J/K})] \\[4pt] &=\textrm{0 J}\end{align*}\]
La energía requerida para la vaporización contrarresta el incremento del desorden del sistema. Así ΔG = 0, y el líquido y el vapor están en equilibrio, como es el caso de cualquier líquido en su punto de ebullición bajo condiciones estándar.
Ahora supongamos que debíamos recalentar 1 mol de agua líquida a 110°C. El valor de ΔG para la vaporización de 1 mol de agua a 110°C, asumiendo que ΔH y ΔS no cambian significativamente con la temperatura, se convierte en
\[\begin{align*}\Delta G_{110^\circ\textrm C}&=\Delta H-T\Delta S \\[4pt] &=\textrm{40,657 J}-[(\textrm{383.15 K})(\textrm{108.96 J/K})] \\[4pt] &=-\textrm{1091 J}\end{align*}\]
A 110°C,\(ΔG < 0\), y se prevé que la vaporización ocurra de manera espontánea e irreversible.
También podemos calcular\(ΔG\) para la vaporización de 1 mol de agua a una temperatura por debajo de su punto de ebullición normal, por ejemplo, 90°C, haciendo los mismos supuestos:
\[\begin{align*}\Delta G_{90^\circ\textrm C}&=\Delta H-T\Delta S \\[4pt] &=\textrm{40,657 J}-[(\textrm{363.15 K})(\textrm{108.96 J/K})] \\[4pt] &=\textrm{1088 J}\end{align*}\]
A 90°C, ΔG > 0, y el agua no se convierte espontáneamente en vapor de agua. Al usar todos los dígitos en la pantalla de la calculadora en la realización de nuestros cálculos, ΔG 110°C = 1090 J = −ΔG 90°C, como predecimos.
\(ΔG = 0\)sólo si\(ΔH = TΔS\).
También podemos calcular la temperatura a la que el agua líquida está en equilibrio con el vapor de agua. Insertar los valores de ΔH y ΔS en la definición de ΔG (Ecuación\(\ref{Eq2}\))\(ΔG = 0\), establecer y resolver para\(T\),
Así\(ΔG = 0\) a T = 373.15 K y 1 atm, lo que indica que el agua líquida y el vapor de agua están en equilibrio; esta temperatura se denomina punto de ebullición normal del agua. A temperaturas superiores a 373.15 K,\(ΔG\) es negativo, y el agua se evapora espontáneamente e irreversiblemente. Por debajo de 373.15 K,\(ΔG\) es positivo, y el agua no se evapora espontáneamente. En cambio, el vapor de agua a una temperatura inferior a 373.15 K y 1 atm se condensará espontánea e irreversiblemente en agua líquida. La figura\(\PageIndex{1}\) muestra cómo varían los\(TΔS\) términos\(ΔH\) y con la temperatura para la vaporización del agua. Cuando las dos líneas se cruzan,\(ΔG = 0\), y\(ΔH = TΔS\).
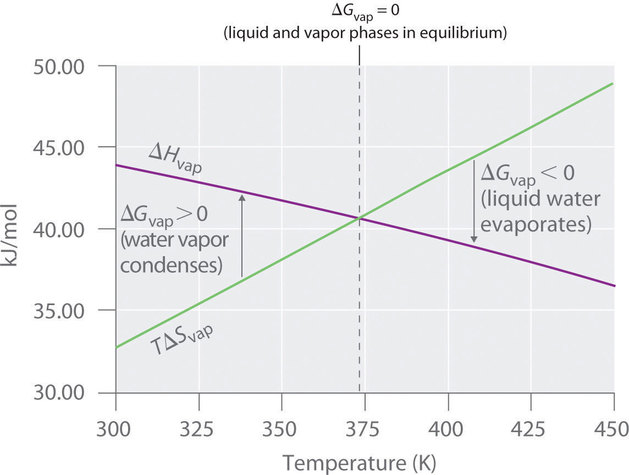
Una situación similar surge en la conversión de la clara de huevo líquida a un sólido cuando se hierve un huevo. El componente principal de la clara de huevo es una proteína llamada albúmina, que se mantiene en una estructura compacta y ordenada por una gran cantidad de enlaces de hidrógeno. Romperlas requiere un aporte de energía (ΔH > 0), que convierte la albúmina en una estructura altamente desordenada en la que las moléculas se agregan como un sólido desorganizado (ΔS > 0). A temperaturas mayores a 373 K, domina el término TΔS, y ΔG < 0, por lo que la conversión de un huevo crudo en huevo duro es un proceso irreversible y espontáneo por encima de 373 K.
La relación entre ΔG y Trabajo
En la subsección anterior, aprendimos que el valor de ΔG nos permite predecir la espontaneidad de un cambio físico o químico. Además, la magnitud de ΔG para un proceso proporciona otra información importante. El cambio en la energía libre (ΔG) es igual a la cantidad máxima de trabajo que un sistema puede realizar en el entorno mientras experimenta un cambio espontáneo (a temperatura y presión constantes): ΔG = w máx. Para ver por qué esto es cierto, volvamos a ver las relaciones entre energía libre, entalpía y entropía expresadas en Ecuación\(\ref{Eq2}\). Podemos reorganizar esta ecuación de la siguiente manera:
\[ ΔH = ΔG + TΔS \label{Eq4}\]
Esta ecuación nos dice que cuando se libera energía durante un proceso exotérmico (ΔH < 0), como durante la combustión de un combustible, parte de esa energía puede ser utilizada para hacer trabajo (ΔG < 0), while some is used to increase the entropy of the universe (TΔS > 0). Sólo si el proceso ocurre infinitamente lentamente de una manera perfectamente reversible, la entropía del universo quedará inalterada. (Para mayor información sobre entropía y reversibilidad, ver el apartado anterior). Debido a que ningún sistema real es perfectamente reversible, la entropía del universo aumenta durante todos los procesos que producen energía. Como resultado, ningún proceso que utilice energía almacenada puede ser 100% eficiente; es decir, ΔH nunca será igual a ΔG porque ΔS tiene un valor positivo.
Uno de los principales desafíos que enfrentan los ingenieros es maximizar la eficiencia de convertir la energía almacenada en trabajo útil o convertir una forma de energía en otra. Como se indica en la Tabla\(\PageIndex{1}\), las eficiencias de varios dispositivos de conversión de energía varían ampliamente. Por ejemplo, un motor de combustión interna normalmente utiliza solo el 25% — 30% de la energía almacenada en el combustible de hidrocarburo para realizar el trabajo; el resto de la energía almacenada se libera en forma inutilizable como calor. Por el contrario, los motores híbridos gas-eléctricos, que ahora se utilizan en varios modelos de automóviles, ofrecen aproximadamente un 50% más de eficiencia de combustible. Un generador eléctrico grande es altamente eficiente (aproximadamente 99%) en la conversión de energía mecánica a eléctrica, pero una bombilla incandescente típica es uno de los dispositivos menos eficientes conocidos (solo aproximadamente el 5% de la energía eléctrica se convierte en luz). En contraste, una célula de hígado de mamífero es una máquina relativamente eficiente y puede utilizar combustibles como la glucosa con una eficiencia de 30% — 50%.
| Dispositivo | Conversión de energía | Eficiencia aproximada (%) |
|---|---|---|
| generador eléctrico grande | mecánico → eléctrico | 99 |
| batería química | químico → eléctrico | 90 |
| horno casero | químico → calor | 65 |
| pequeña herramienta eléctrica | eléctrico → mecánico | 60 |
| motor de transbordador espacial | químico → mecánico | 50 |
| células hepáticas de mamíferos | químico → químico | 30—50 |
| célula de hoja de espinaca | ligero → químico | 30 |
| motor de combustión interna | químico → mecánico | 25—30 |
| luz fluorescente | eléctrico → luz | 20 |
| célula solar | luz → electricidad | 10-20 |
| bombilla incandescente | electricidad → luz | 5 |
| célula de levadura | químico → químico | 2—4 |
Cambio estándar de energía libre
Hemos visto que no hay forma de medir entalpías absolutas, aunque podemos medir cambios en la entalpía (ΔH) durante una reacción química. Debido a que la entalpía es uno de los componentes de la energía libre de Gibbs, en consecuencia somos incapaces de medir las energías libres absolutas; solo podemos medir los cambios en la energía libre. El cambio estándar de energía libre (ΔG°) es el cambio en la energía libre cuando una sustancia o un conjunto de sustancias en sus estados estándar se convierte en una o más otras sustancias, también en sus estados estándar. El cambio estándar de energía libre se puede calcular a partir de la definición de energía libre, si se conocen los cambios estándar de entalpía y entropía, usando la ecuación\(\ref{Eq5}\):
\[ΔG° = ΔH° − TΔS° \label{Eq5}\]
Si ΔS° y ΔH° para una reacción tienen el mismo signo, entonces el signo de ΔG° depende de las magnitudes relativas de los términos ΔH° y TΔS°. Es importante reconocer que un valor positivo de ΔG° para una reacción no significa que no se formarán productos si se mezclan los reactivos en sus estados estándar; significa solo que en equilibrio las concentraciones de los productos serán menores que las concentraciones de los reactivos.
Un ΔG° positivo significa que la constante de equilibrio es menor que 1.
Calcular el cambio estándar de energía libre (\(ΔG^o\)) a 25°C para la reacción
\[ \ce{ H2(g) + O2(g) \rightleftharpoons H2O2(l)}\nonumber\]
A 25°C, el cambio de entalpía estándar (ΔH°) es −187.78 kJ/mol, y las entropías absolutas de los productos y reactivos son:
- S° (H 2 O 2) = 109.6 J/ (mol•K),
- S° (O 2) = 205.2 J/ (mol•K), y
- S° (H 2) = 130.7 J/ (mol•K).
¿La reacción es espontánea como está escrita?
Dado: ecuación química equilibrada, ΔH° y S° para reactivos y productos
Preguntado por: espontaneidad de reacción tal como está escrito
Estrategia:
- Calcular ΔS° a partir de los valores absolutos de entropía molar dados.
- Utilice la Ecuación\(\ref{Eq5}\), el valor calculado de ΔS°, y otros datos dados para calcular ΔG° para la reacción. Utilizar el valor de ΔG° para determinar si la reacción es espontánea tal como está escrito.
Solución
A Para calcular ΔG° para la reacción, necesitamos saber\(ΔH^o\),\(ΔS^o\), y\(T\). Se nos da\(ΔH^o\), y sabemos que T = 298.15 K. Podemos calcular ΔS° a partir de los valores absolutos de entropía molar proporcionados usando la regla de “productos menos reactivos”:
\ nonumber\\ [4pt] &= [\ mathrm {1\; mol\; H_2O_2}\ times109.6\;\ mathrm {J/ (mol\ cdot K})]
\ nonumber\\ [4pt] &-\ left\ {[\ textrm {1 mol H} _2\ times130.7\;\ mathrm {J/ (mol\ cdot K)}] + [\ textrm {1 mol O} _2\ times205.2\;\ mathrm {J/ (mol\ cdot K)}]\ derecha\}
\ nonumber\\[4pt]&=-226.3\textrm{ J/K }(\textrm{per mole of }\mathrm{H_2O_2}) \end{align*}\]
Como cabría esperar para una reacción en la que 2 mol de gas se convierten en 1 mol de un líquido mucho más ordenado,\(ΔS^o\) es muy negativo para esta reacción.
B Sustituyendo las cantidades apropiadas en la Ecuación\(\ref{Eq5}\),
\[\begin{align*}\Delta G^\circ &=\Delta H^\circ -T\Delta S^\circ \\[4pt] &=-187.78\textrm{ kJ/mol}-(\textrm{298.15 K}) [-226.3\;\mathrm{J/(mol\cdot K)}\times\textrm{1 kJ/1000 J}]\nonumber \\[4pt] &=-187.78\textrm{ kJ/mol}+67.47\textrm{ kJ/mol} \\[4pt] &=-120.31\textrm{ kJ/mol}\nonumber \end{align*}\]
El valor negativo de\(ΔG^o\) indica que la reacción es espontánea tal y como está escrito. Porque\(ΔS^o\) y\(ΔH^o\) para esta reacción tienen el mismo signo, el signo de\(ΔG^o\) depende de las magnitudes relativas de los\(TΔS^o\) términos\(ΔH^o\) y. En este caso particular, domina el término de entalpía, indicando que la fuerza de los enlaces formados en el producto compensa con creces el\(ΔS^o\) término desfavorable y la energía necesaria para romper los enlaces en los reactivos.
Calcular el cambio estándar de energía libre (\(ΔG^o\)) a 25°C para la reacción
\[2H_2(g)+N_2(g) \rightleftharpoons N_2H_4(l)\nonumber . \]
¿La reacción es espontánea tal como está escrita a 25°C?
- Pista
-
A 25°C, el cambio de entalpía estándar (\(ΔH^o\)) es de 50.6 kJ/mol, y las entropías absolutas de los productos y reactivos son
- S° (N 2 H 4) = 121.2 J/ (mol•K),
- S° (N 2) = 191.6 J/ (mol•K), y
- S° (H 2) = 130.7 J/ (mol•K).
- Contestar
-
149.5 kJ/mol
no, no espontáneo
Solución de video
Los valores tabulados de energías libres estándar de formación permiten a los químicos calcular los valores de ΔG° para una amplia variedad de reacciones químicas en lugar de tener que medirlos en el laboratorio. La energía libre estándar de formación (\(ΔG^∘_f\)) de un compuesto es el cambio en la energía libre que ocurre cuando se forma 1 mol de una sustancia en su estado estándar a partir de los elementos componentes en sus estados estándar. Por definición, la energía libre estándar de formación de un elemento en su estado estándar es cero a 298.15 K. Un mol de gas Cl 2 a 298.15 K, por ejemplo, tiene\(\Delta G^∘_f = 0\). La energía libre estándar de formación de un compuesto se puede calcular a partir de la entalpía estándar de formación (ΔH° f) y la entropía estándar de formación (ΔS ° f) usando la definición de energía libre:
\[\Delta G^o_{f} =ΔH^o_{f} −TΔS^o_{f} \label{Eq6}\]
El uso de energías libres estándar de formación para calcular la energía libre estándar de una reacción es análogo a calcular los cambios de entalpía estándar a partir de entalpías estándar de formación usando la regla familiar de “productos menos reactivos”:
\[ΔG^o_{rxn}=\sum mΔG^o_{f} (products)− \sum nΔ^o_{f} (reactants) \label{Eq7a}\]
donde m y n son los coeficientes estequiométricos de cada producto y reactivo en la ecuación química equilibrada. Un ΔG° negativo muy grande indica una fuerte tendencia a que los productos se formen espontáneamente a partir de reactivos; sin embargo, no necesariamente indica que la reacción ocurrirá rápidamente. Para hacer esta determinación, necesitamos evaluar la cinética de la reacción.
El\(ΔG^o\) de una reacción se puede calcular a partir de valores tabulados ΔG° f (Tabla T1) usando la regla de “productos menos reactivos”.
Calcular ΔG° para la reacción de isooctano con gas oxígeno para dar dióxido de carbono y agua (descrito en el Ejemplo 7). Utilice los siguientes datos:
- ΔG° f (isooctano) = −353,2 kJ/mol,
- ΔG° f (CO 2) = −394,4 kJ/mol, y
- ΔG° f (H 2 O) = −237.1 kJ/mol. ¿La reacción es espontánea como está escrita?
Dado: ecuación química equilibrada y valores de ΔG° f para isooctano, CO 2 y H 2 O
Preguntado por: espontaneidad de reacción tal como está escrito
Estrategia:
Utilice la regla de “productos menos reactivos” para obtener ΔG ° rxn, recordando que ΔG° f para un elemento en su estado estándar es cero. A partir del valor calculado, determinar si la reacción es espontánea tal como está escrita.
Solución
La ecuación química equilibrada para la reacción es la siguiente:
\[\ce{C8H_{18}(l) + 25/2 O2 (g) \rightarrow 8CO2(g) + 9H2O(l)}\nonumber\]
Se nos dan valores ΔG° f para todos los productos y reactivos excepto O 2 (g). Debido a que el gas oxígeno es un elemento en su estado estándar, ΔG° f (O 2) es cero. Usando la regla de “productos menos reactivos”,
\ [\ begin {align*}\ Delta G^\ circ &= [8\ Delta G^\ circ_\ textrm f (\ mathrm {CO_2}) +9\ Delta G^\ circ_\ textrm f (\ mathrm {H_2O})] -\ left [1\ Delta G^\ circ_\ textrm f (\ mathrm {C_8H_ {18}}) +\ dfrac {25} {2}\ Delta G^\ circ_\ textrm f (\ mathrm {O_2})\ derecha]
\ nonumber\\ [4pt] &= [(\ textrm {8 mol}) (-394.4\ textrm {kJ/mol}) + (\ textrm {9 mol}) (-237.1\ textrm {kJ/mol})]
\ nonumber\\ [4pt] &-\ left [(\ textrm {1 mol}) (-353.2\ textrm {kJ/mol}) +\ izquierda (\ dfrac {25} {2}\;\ textrm {mol}\ derecha) (0\ textrm {kJ/mol})\ derecha]
\ nonumber\\[4pt] &=-4935.9\textrm{ kJ }(\textrm{per mol of }\mathrm{C_8H_{18}})\nonumber \end{align*}\]
Debido a que ΔG° es un gran número negativo, existe una fuerte tendencia a la formación espontánea de productos a partir de reactivos (aunque no necesariamente a una velocidad rápida). También observe que la magnitud de ΔG° está determinada en gran medida por el ΔG ° f de los productos estables: agua y dióxido de carbono.
Calcular ΔG° para la reacción de benceno con gas hidrógeno para dar ciclohexano usando los siguientes datos
- ΔG ° f (benceno) = 124.5 kJ/mol
- ΔG ° f (ciclohexano) = 217.3 kJ/mol.
¿La reacción es espontánea como está escrita?
- Contestar
-
92.8 kJ; no
Solución de video
Los valores calculados de ΔG° son extremadamente útiles para predecir si una reacción ocurrirá espontáneamente si los reactivos y productos se mezclan en condiciones estándar. Debemos señalar, sin embargo, que muy pocas reacciones se llevan a cabo realmente en condiciones estándar, y los valores calculados de ΔG° pueden no decirnos si una reacción dada ocurrirá espontáneamente en condiciones no estándar. Lo que determina si una reacción ocurrirá espontáneamente es el cambio de energía libre (ΔG) bajo las condiciones experimentales reales, que suelen ser diferentes de ΔG°. Si los términos ΔH y TΔS para una reacción tienen el mismo signo, por ejemplo, entonces puede ser posible revertir el signo de ΔG cambiando la temperatura, convirtiendo así una reacción que no sea termodinámicamente espontánea, teniendo K eq < 1, a una es decir, teniendo una K eq > 1, o vice versa. Debido a que ΔH y ΔS generalmente no varían mucho con la temperatura en ausencia de un cambio de fase, podemos usar valores tabulados de ΔH° y ΔS° para calcular ΔG° a diversas temperaturas, siempre y cuando no se produzca ningún cambio de fase sobre el rango de temperatura que se está considerando.
En ausencia de un cambio de fase,\(ΔH\) ni ni\(ΔS\) varían mucho con la temperatura.
Calcular (a) ΔG° y (b) ΔG 300°C para la reacción N 2 (g) +3H 2 (g) 2NH 3 (g), suponiendo que ΔH y ΔS no cambian entre 25°C y 300°C. Utilice estos datos:
- S° (N 2) = 191.6 J/ (mol•K),
- S° (H 2) = 130.7 J/ (mol•K),
- S° (NH 3) = 192.8 J/ (mol•K), y
- ΔH ° f (NH 3) = −45.9 kJ/mol.
Dado: ecuación química equilibrada, temperaturas, valores de S° y ΔH ° f para NH 3
Preguntado por: ΔG° y ΔG a 300°C
Estrategia:
- Convierte cada temperatura a kelvin. Después se calcula ΔS° para la reacción. Calcular ΔH° para la reacción, recordando que ΔH° f para cualquier elemento en su estado estándar es cero.
- Sustituir los valores apropiados en Ecuación\(\ref{Eq5}\) para obtener ΔG° para la reacción.
- Suponiendo que ΔH y ΔS son independientes de la temperatura, sustituya los valores en la Ecuación\(\ref{Eq2}\) para obtener ΔG para la reacción a 300°C.
Solución
A Para calcular ΔG° para la reacción usando la Ecuación\(\ref{Eq5}\), debemos conocer la temperatura así como los valores de ΔS° y ΔH°. En condiciones estándar, la temperatura es 25°C, o 298 K. Podemos calcular ΔS° para la reacción a partir de los valores absolutos de entropía molar dados para los reactivos y los productos usando la regla de “productos menos reactivos”:
\ nonumber\\ &= [\ textrm {2 mol NH} 3\ times192.8\;\ mathrm {J/ (mol\ cdot K)}]
\ nonumber\\ &-\ left\ {[\ textrm {1 mol N} _2\ times191.6\;\ mathrm {J/ (mol\ cdot K)}] + [\ textrm {3 mol H} _2\ horas130.7\;\ mathrm {J/ (mol\ cdot K)}]\ derecha\}\ nonumber\\ &=-198.1\ textrm {J/K (por mol de N} _2)\ end {align}\ nonumber\]
También podemos calcular ΔH° para la reacción usando la regla de “productos menos reactivos”. Se da el valor de ΔH o f (NH 3), y ΔH o f es cero tanto para N 2 como para H2:
\[\begin{align}\Delta H^\circ_{\textrm{rxn}}&=2\Delta H^\circ_\textrm f(\mathrm{NH_3})-[\Delta H^\circ_\textrm f(\mathrm{N_2})+3\Delta H^\circ_\textrm f(\mathrm{H_2})]\nonumber \\ &=[2\times(-45.9\textrm{ kJ/mol})]-[(1\times0\textrm{ kJ/mol})+(3\times0 \textrm{ kJ/mol})]\nonumber \\ &=-91.8\textrm{ kJ(per mole of N}_2)\nonumber\end{align}\nonumber\]
B Inserción de los valores apropiados en la ecuación\(\ref{Eq5}\)
\[\Delta G^\circ_{\textrm{rxn}}=\Delta H^\circ-T\Delta S^\circ=(-\textrm{91.8 kJ})-(\textrm{298 K})(-\textrm{198.1 J/K})(\textrm{1 kJ/1000 J})=-\textrm{32.7 kJ (per mole of N}_2)\nonumber\]
C Para calcular ΔG para esta reacción a 300°C, suponemos que ΔH y ΔS son independientes de la temperatura (es decir, ΔH 300°C = H° y ΔS 300°C = ΔS°) e insertamos la temperatura apropiada (573 K) en la Ecuación\(\ref{Eq2}\):
\[\begin{align*}\Delta G_{300^\circ\textrm C}&=\Delta H_{300^\circ\textrm C}-(\textrm{573 K})(\Delta S_{300^\circ\textrm C}) \\[4pt] &=\Delta H^\circ -(\textrm{573 K})\Delta S^\circ\nonumber \\[4pt] &=(-\textrm{91.8 kJ})-(\textrm{573 K})(-\textrm{198.1 J/K})(\textrm{1 kJ/1000 J}) \\[4pt]&=21.7\textrm{ kJ (per mole of N}_2) \end{align*}\]
En este ejemplo, cambiar la temperatura tiene un efecto importante en la espontaneidad termodinámica de la reacción. En condiciones estándar, la reacción de nitrógeno e hidrógeno gaseoso para producir amoníaco es termodinámicamente espontánea, pero en la práctica, es demasiado lenta para ser útil industrialmente. El aumento de la temperatura en un intento de hacer que esta reacción ocurra más rápidamente también cambia la termodinámica al hacer que el término −TΔS° domine, y la reacción ya no es espontánea a altas temperaturas; es decir, su K eq es menor que uno. Este es un ejemplo clásico del conflicto que se encuentra en los sistemas reales entre la termodinámica y la cinética, que a menudo es inevitable.
Calcular
- \(ΔG°\)y
- \(ΔG_{750°C}\)
para la siguiente reacción
\[\ce{ 2NO(g) + O2 (g) \rightleftharpoons 2NO2 (g)}\nonumber\]
lo cual es importante en la formación del smog urbano. Suponga que\(ΔH\) y\(ΔS\) no cambie entre 25.0°C y 750°C y use estos datos:
- S° (NO) = 210.8 J/ (mol•K),
- S° (O 2) = 205.2 J/ (mol•K),
- S° (NO 2) = 240.1 J/ (mol•K),
- ΔH o f (NO 2) = 33.2 kJ/mol, y
- ΔH ° f (NO) = 91.3 kJ/mol.
- Contestar a
-
−72.5 kJ/mol de\(O_2\)
- Respuesta b
-
33.8 kJ/mol de\(O_2\)
El efecto de la temperatura sobre la espontaneidad de una reacción, que es un factor importante en el diseño de un experimento o un proceso industrial, depende del signo y magnitud tanto de ΔH° como ΔS°. La temperatura a la que una reacción dada está en equilibrio se puede calcular estableciendo ΔG° = 0 en la Ecuación\(\ref{Eq5}\), como se ilustra en el Ejemplo\(\PageIndex{4}\).
Como viste en Ejemplo\(\PageIndex{3}\), la reacción de nitrógeno e hidrógeno gaseoso para producir amoníaco es aquella en la que ΔH° y ΔS° son ambos negativos. Se prevé que tales reacciones sean termodinámicamente espontáneas a bajas temperaturas pero no espontáneas a altas temperaturas. Utilice los datos del Ejemplo 9.5.3 para calcular la temperatura a la que esta reacción cambia de espontánea a no espontánea, asumiendo que ΔH° y ΔS° son independientes de la temperatura.
Dado: ΔH° y ΔS°
Preguntado por: temperatura a la que la reacción cambia de espontánea a no espontánea
Estrategia:
Establezca ΔG° igual a cero en Ecuación\(\ref{Eq5}\) y resuelva para T, la temperatura a la que la reacción se vuelve no espontánea.
Solución
En Ejemplo\(\PageIndex{3}\), calculamos que ΔH° es −91.8 kJ/mol de N 2 y ΔS° es −198.1 J/K por mol de N 2, correspondiente a ΔG° = −32.7 kJ/mol de N 2 a 25°C, así la reacción es efectivamente espontánea a bajas temperaturas, como se esperaba con base en los signos de ΔH° y ΔS°. La temperatura a la que la reacción se vuelve no espontánea se encuentra estableciendo ΔG° igual a cero y reordenando la ecuación\(\ref{Eq5}\) para resolver para T:
\\ [4pt]\ Delta H^\ circ &=T\ Delta S^\ circ
\\[4pt] T=\dfrac{\Delta H^\circ}{\Delta S^\circ}&=\dfrac{(-\textrm{91.8 kJ})(\textrm{1000 J/kJ})}{-\textrm{198.1 J/K}}=\textrm{463 K}\end{align*}\]
Este es un caso en el que un ingeniero químico está severamente limitado por la termodinámica. Cualquier intento de aumentar la velocidad de reacción del nitrógeno con hidrógeno aumentando la temperatura provocará que los reactivos se vean favorecidos sobre los productos por encima de 463 K.
Como encontraste en el ejercicio en Ejemplo\(\PageIndex{3}\), ΔH° y ΔS° son ambos negativos para la reacción de óxido nítrico y oxígeno para formar dióxido de nitrógeno. Utilice esos datos para calcular la temperatura a la que esta reacción cambia de espontánea a no espontánea.
- Contestar
-
792.6 K
Solución de video
Resumen
- El cambio en la energía libre de Gibbs, que se basa únicamente en cambios en las funciones estatales, es el criterio para predecir la espontaneidad de una reacción.
- Cambio de energía libre:
\[ΔG = ΔH − TΔS\nonumber\]
- Cambio estándar de energía libre:
\[ΔG° = ΔH° − TΔS°\nonumber\]
Podemos predecir si una reacción ocurrirá espontáneamente combinando la entropía, entalpía y temperatura de un sistema en una nueva función de estado llamada energía libre de Gibbs (G). El cambio en la energía libre (ΔG) es la diferencia entre el calor liberado durante un proceso y el calor liberado para el mismo proceso que ocurre de manera reversible. Si un sistema está en equilibrio, ΔG = 0. Si el proceso es espontáneo, ΔG < 0. Si el proceso no es espontáneo como está escrito sino espontáneo en la dirección inversa, ΔG > 0. A temperatura y presión constantes, ΔG es igual a la cantidad máxima de trabajo que un sistema puede realizar en su entorno mientras experimenta un cambio espontáneo. El cambio estándar de energía libre (ΔG°) es el cambio en la energía libre cuando una sustancia o un conjunto de sustancias en sus estados estándar se convierte en una o más otras sustancias, también en sus estados estándar. La energía libre estándar de formación (ΔG o f), es el cambio en la energía libre que se produce cuando se forma 1 mol de una sustancia en su estado estándar a partir de los elementos componentes en sus estados estándar. Los valores tabulados de las energías libres estándar de formación se utilizan para calcular ΔG° para una reacción.


