18.4: Cambios de entropía y la Tercera Ley de la Termodinámica
- Page ID
- 78129
- Utilizar ciclos termodinámicos para calcular los cambios en la entropía.
Los átomos, moléculas o iones que componen un sistema químico pueden sufrir varios tipos de movimiento molecular, incluyendo traslación, rotación y vibración (Figura\(\PageIndex{1}\)). Cuanto mayor es el movimiento molecular de un sistema, mayor es el número de microestados posibles y mayor es la entropía. Un sistema perfectamente ordenado con un solo microestado disponible tendría una entropía de cero. El único sistema que cumple con este criterio es un cristal perfecto a una temperatura de cero absoluto (0 K), en el que cada átomo, molécula o ion componente se fija en su lugar dentro de una red cristalina y no exhibe movimiento (ignorando los efectos cuánticos). Tal estado de orden perfecto (o, a la inversa, desorden cero) corresponde a la entropía cero. En la práctica, el cero absoluto es una temperatura ideal que es inalcanzable, y un monocristal perfecto también es un ideal que no se puede lograr. Sin embargo, la combinación de estos dos ideales constituye la base de la tercera ley de la termodinámica: la entropía de cualquier sustancia cristalina perfectamente ordenada en cero absoluto es cero.
La entropía de cualquier sustancia cristalina perfectamente ordenada a cero absoluto es cero.
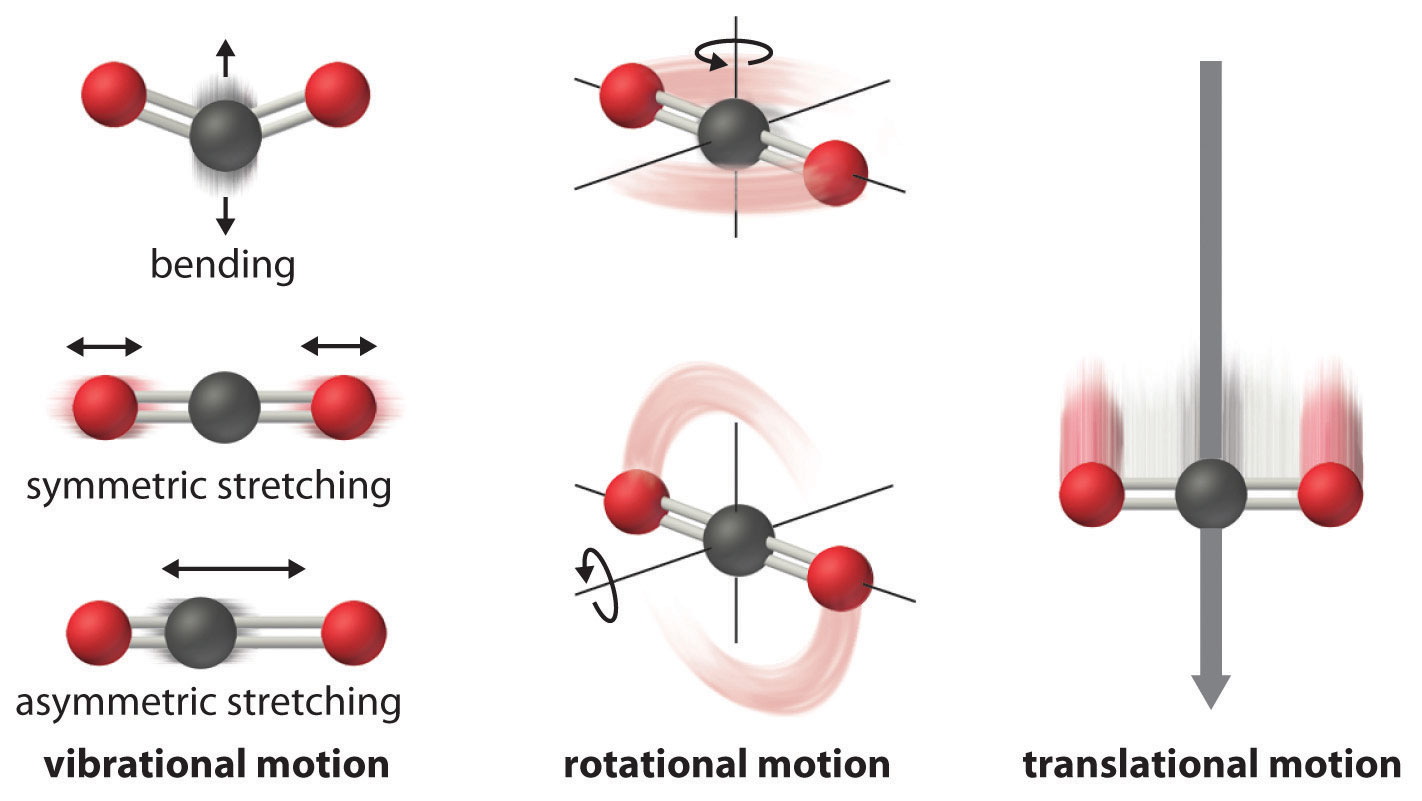
Figura\(\PageIndex{1}\): Movimientos Moleculares. Aquí se ilustran los movimientos vibracionales, rotacionales y traduccionales de una molécula de dióxido de carbono. Solo una sustancia cristalina perfectamente ordenada a cero absoluto no exhibiría movimiento molecular y tendría cero entropía. En la práctica, este es un ideal inalcanzable.
La tercera ley de la termodinámica tiene dos consecuencias importantes: define el signo de la entropía de cualquier sustancia a temperaturas superiores al cero absoluto como positivo, y proporciona un punto de referencia fijo que nos permite medir la entropía absoluta de cualquier sustancia a cualquier temperatura.En la práctica, los químicos determinar la entropía absoluta de una sustancia midiendo la capacidad calorífica molar (Cp) en función de la temperatura y luego graficando la cantidad C p/T versus T. El área bajo la curva entre 0 K y cualquier temperatura T es la entropía absoluta de la sustancia en T. En contraste, otras propiedades termodinámicas, como la energía interna y la entalpía, pueden evaluarse solo en términos relativos, no en términos absolutos. En esta sección, examinamos dos formas diferentes de calcular ΔS para una reacción o un cambio físico. El primero, basado en la definición de entropía absoluta proporcionada por la tercera ley de la termodinámica, utiliza valores tabulados de entropías absolutas de sustancias. El segundo, basado en el hecho de que la entropía es una función de estado, utiliza un ciclo termodinámico similar a los discutidos anteriormente.
Cálculo de ΔS a partir de valores de entropía molar estándar
Una forma de calcular ΔS para una reacción es usar valores tabulados de la entropía molar estándar (S°), que es la entropía de 1 mol de una sustancia a una temperatura estándar de 298 K; las unidades de S° son J/ (mOL•K). A diferencia de la entalpía o la energía interna, es posible obtener valores absolutos de entropía midiendo el cambio de entropía que se produce entre el punto de referencia de 0 K [correspondiente a S = 0 J/ (mOL•K)] y 298 K.
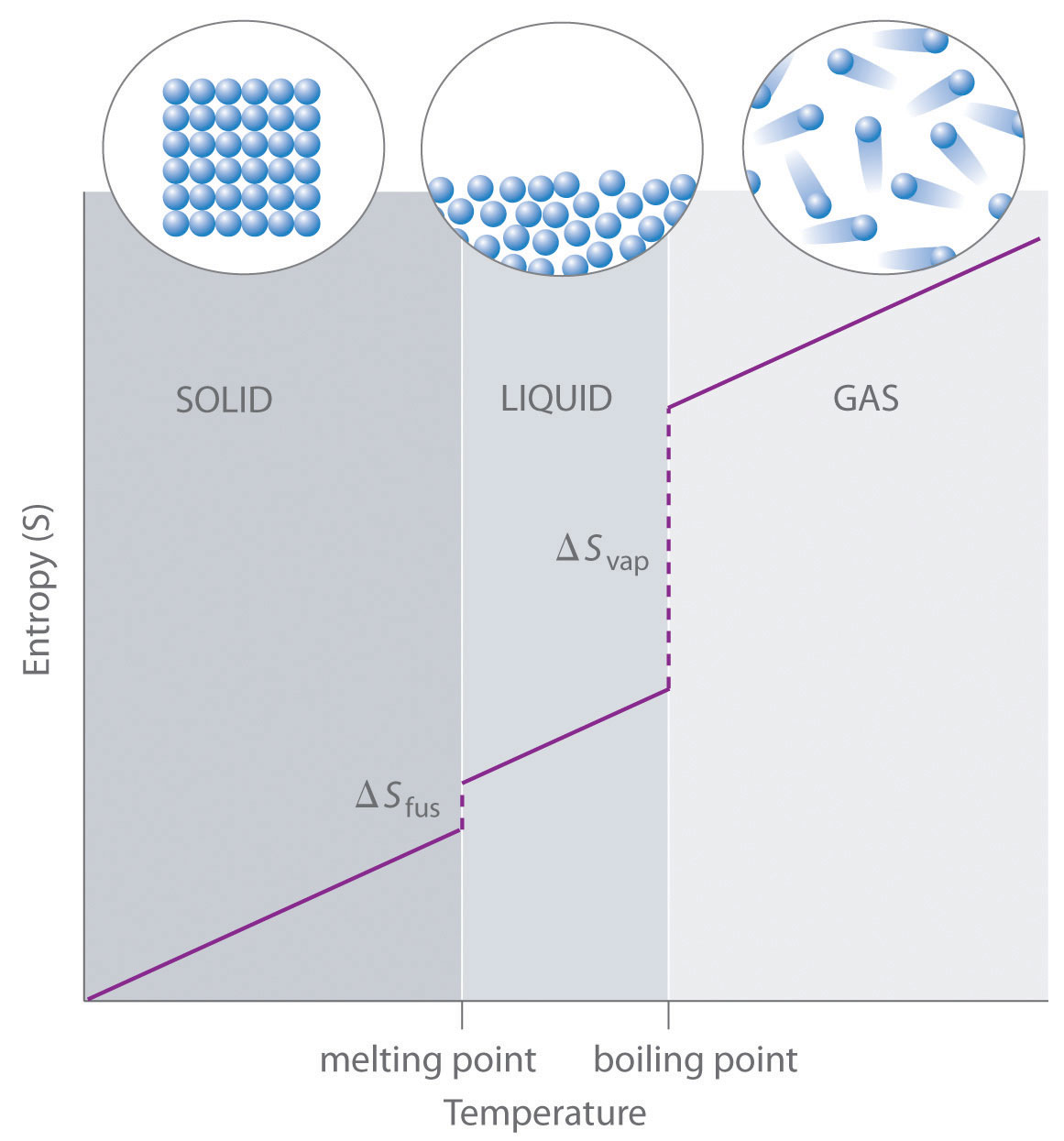
Figura\(\PageIndex{2}\): Gráfica Generalizada de Entropía versus Temperatura para una Sustancia Única. La entropía absoluta aumenta de manera constante al aumentar la temperatura hasta alcanzar el punto de fusión, donde salta repentinamente a medida que la sustancia sufre un cambio de fase de un sólido altamente ordenado a un líquido desordenado (ΔS fus). La entropía vuelve a aumentar de manera constante al aumentar la temperatura hasta alcanzar el punto de ebullición, donde salta repentinamente a medida que el líquido sufre un cambio de fase a un gas altamente desordenado (ΔS vap).
Como se muestra en la Tabla\(\PageIndex{1}\), para sustancias con aproximadamente la misma masa molar y número de átomos, los valores de S° caen en el orden S° (gas) > S° (líquido) > S° (sólido). Por ejemplo, S° para el agua líquida es 70.0 J/ (mol•K), mientras que S° para el vapor de agua es 188.8 J/ (mol•K). Asimismo, S° es 260.7 J/ (mol•K) para I 2 gaseoso y 116.1 J/ (mol•K) para I2 sólido. Este orden tiene sentido cualitativo basado en los tipos y extensiones de movimiento disponibles para los átomos y moléculas en las tres fases. La correlación entre el estado físico y la entropía absoluta se ilustra en la Figura\(\PageIndex{2}\), que es una gráfica generalizada de la entropía de una sustancia frente a la temperatura.
| Gases | Líquidos | Sólidos | |||
| Sustancia | S° [J/ (mol•K)] | Sustancia | S° [J/ (mol•K)] | Sustancia | S° [J/ (mol•K)] |
| Él | 126.2 | H 2 O | 70.0 | C (diamante) | 2.4 |
| H 2 | 130.7 | CH 3 OH | 126.8 | C (grafito) | 5.7 |
| Ne | 146.3 | Br 2 | 152.2 | LiF | 35.7 |
| Ar | 154.8 | CH 3 CH 2 OH | 160.7 | SiO 2 (cuarzo) | 41.5 |
| Kr | 164.1 | C 6 H 6 | 173.4 | Ca | 41.6 |
| Xe | 169.7 | CH 3 COCl | 200.8 | Na | 51.3 |
| H 2 O | 188.8 | C 6 H 12 (ciclohexano) | 204.4 | MGF 2 | 57.2 |
| N 2 | 191.6 | C 8 H 18 (isooctano) | 329.3 | K | 64.7 |
| O 2 | 205.2 | NaCl | 72.1 | ||
| CO 2 | 213.8 | KCl | 82.6 | ||
| I 2 | 260.7 | I 2 | 116.1 | ||
La entropía aumenta con sólidos más blandos y menos rígidos, sólidos que contienen átomos más grandes y sólidos con estructuras moleculares complejas.
Un examen más detallado de Table\(\PageIndex{1}\) también revela que las sustancias con estructuras moleculares similares tienden a tener valores similares de S°. Entre los materiales cristalinos, aquellos con las entropías más bajas tienden a ser cristales rígidos compuestos por pequeños átomos unidos por enlaces fuertes y altamente direccionales, como el diamante [S° = 2.4 J/ (mOL•K)]. En contraste, el grafito, el alótropo más blando y menos rígido del carbono, tiene un S° mayor [5.7 J/ (mOL•K)] debido a un mayor desorden en el cristal. Las sustancias cristalinas blandas y aquellas con átomos más grandes tienden a tener entropías más altas debido al aumento del movimiento molecular y el desorden. De manera similar, la entropía absoluta de una sustancia tiende a aumentar al aumentar la complejidad molecular debido a que el número de microestados disponibles aumenta con la complejidad molecular. Por ejemplo, compare los valores de S° para CH 3 OH (l) y CH 3 CH 2 OH (l). Finalmente, las sustancias con fuertes enlaces de hidrógeno tienen valores menores de S°, lo que refleja una estructura más ordenada.
ΔS° para una reacción se puede calcular a partir de valores absolutos de entropía usando la misma regla de “productos menos reactivos” utilizada para calcular ΔH°.
Para calcular ΔS° para una reacción química a partir de entropías molares estándar, utilizamos la regla familiar de “productos menos reactivos”, en la que la entropía absoluta de cada reactivo y producto se multiplica por su coeficiente estequiométrico en la ecuación química equilibrada. Ejemplo\(\PageIndex{1}\) ilustra este procedimiento para la combustión del hidrocarburo líquido isooctano (C 8 H 18; 2,2,4-trimetilpentano).
Utilizar los datos de la Tabla\(\PageIndex{1}\) para calcular ΔS° para la reacción de isooctano líquido con O 2 (g) para dar CO 2 (g) y H 2 O (g) a 298 K.
Dado: entropías molares estándar, reactivos y productos
Preguntado por: ΔS°
Estrategia:
Escriba la ecuación química balanceada para la reacción e identifique las cantidades apropiadas en la Tabla\(\PageIndex{1}\). Restar la suma de las entropías absolutas de los reactivos de la suma de las entropías absolutas de los productos, cada una multiplicada por sus coeficientes estequiométricos apropiados, para obtener ΔS° para la reacción.
Solución:
La ecuación química equilibrada para la combustión completa de isooctano (C 8 H 18) es la siguiente:
Calculamos ΔS° para la reacción usando la regla de “productos menos reactivos”, donde m y n son los coeficientes estequiométricos de cada producto y cada reactivo:
\ begin {align}\ Delta S^\ circ_ {\ textrm {rxn}} &=\ suma mS^\ circ (\ textrm {products}) -\ suma nS^\ circ (\ textrm {reactantes})
\\ &= [8S^\ circ (\ mathrm {CO_2}) +9S^\ circ (\ mathrm {H_2O})] - [S^\ circ (\ mathrm {C_8H_ {18}}) +\ dfrac {25} {2} S^\ circ (\ mathrm {O_2})]
\\ &=\ izquierda\ {[8\ textrm {mol}\ mathrm {CO_ 2}\ times213.8\;\ mathrm {J/ (mol\ cdot K)}] + [9\ textrm {mol}\ mathrm {H_2O}\ times188.8\;\ mathrm {J/ (mol\ cdot K)}]\ derecha\}
\\ &- izquierda\ {[1\ textrm {mol}\ mathrm {C_8H_ {18}}\ tiempos329.3\;\ mathrm {J/ (mol\ cdot K)}] +\ izquierda [\ dfrac {25} {2}\ textrm {mol}\ mathrm {O_2}\ tiempos205.2\ textrm {J}/(\ mathrm {mol\ cdot K})\ derecha]\ derecha\}
\\ &=515.3\;\ mathrm {J/K}\ end {align}
ΔS° es positivo, como se esperaba para una reacción de combustión en la que una molécula de hidrocarburo grande se convierte en muchas moléculas de productos gaseosos.
Utilizar los datos de la Tabla\(\PageIndex{1}\) para calcular ΔS° para la reacción de H 2 (g) con benceno líquido (C 6 H 6) para dar ciclohexano (C 6 H 12).
Respuesta: −361.1 J/K
Cálculo de ΔS a partir de ciclos termodinámicos
También podemos calcular un cambio en la entropía usando un ciclo termodinámico. Como aprendiste anteriormente, la capacidad calorífica molar (C p) es la cantidad de calor necesaria para elevar la temperatura de 1 mol de una sustancia en 1°C a presión constante. De igual manera, C v es la cantidad de calor necesaria para elevar la temperatura de 1 mol de una sustancia en 1°C a volumen constante. El incremento de la entropía con el aumento de la temperatura en la Figura\(\PageIndex{2}\) es aproximadamente proporcional a la capacidad calorífica de la sustancia.
Recordemos que el cambio de entropía (ΔS) está relacionado con el flujo de calor (q rev) por ΔS = q rev /T. Debido a q rev = nC p ΔT a presión constante o nC v ΔT a volumen constante, donde n es el número de moles de sustancia presentes, el cambio en la entropía para una sustancia cuya temperatura cambia de T1 a T 2 es la siguiente:
\[\Delta S=\dfrac{q_{\textrm{rev}}}{T}=nC_\textrm p\dfrac{\Delta T}{T}\hspace{4mm}(\textrm{constant pressure})\]
Como descubrirás en cursos de matemáticas más avanzados de lo que se requiere aquí, se puede demostrar que esto es igual a lo siguiente:Para una revisión de logaritmos naturales, consulte Habilidades Esenciales 6 en el Capítulo 11.
Del mismo modo,
\[Delta S=nC_{\textrm v}\ln\dfrac{T_2}{T_1}\hspace{4mm}(\textrm{constant volume}) \tag{18.21}\]
Así podemos utilizar una combinación de mediciones de capacidad calorífica (Ecuación 18.20 o Ecuación 18.21) y valores medidos experimentalmente de entalpías de fusión o vaporización si se trata de un cambio de fase (Ecuación 18.18) para calcular el cambio de entropía correspondiente a un cambio en la temperatura de una muestra.
Podemos usar un ciclo termodinámico para calcular el cambio de entropía cuando el cambio de fase para una sustancia como el azufre no se puede medir directamente. Como se señaló en el ejercicio del Ejemplo 6, el azufre elemental existe en dos formas (parte (a) en la Figura\(\PageIndex{3}\)): una forma ortorrómbica con una estructura altamente ordenada (S α) y una forma monoclínica menos ordenada (S β). La forma ortorrómbica (α) es más estable a temperatura ambiente pero experimenta una transición de fase a la forma monoclínica (β) a temperaturas mayores a 95.3°C (368.5 K). La transición de S α a S β puede ser descrita por el ciclo termodinámico mostrado en la parte (b) de la Figura\(\PageIndex{3}\), en el que el azufre líquido es un intermedio. El cambio en la entropía que acompaña a la conversión de azufre líquido a S β (−ΔS fus (β) = ΔS 3 en el ciclo) no se puede medir directamente. Debido a que la entropía es una función de estado, sin embargo, ΔS 3 se puede calcular a partir del cambio de entropía general (ΔS t) para la transición S α —S β, que es igual a la suma de los valores ΔS para los pasos en el ciclo termodinámico, usando la Ecuación 18.20 y tabulada parámetros termodinámicos (las capacidades térmicas de S α y S β, ΔH fus (α) y el punto de fusión de S α.)
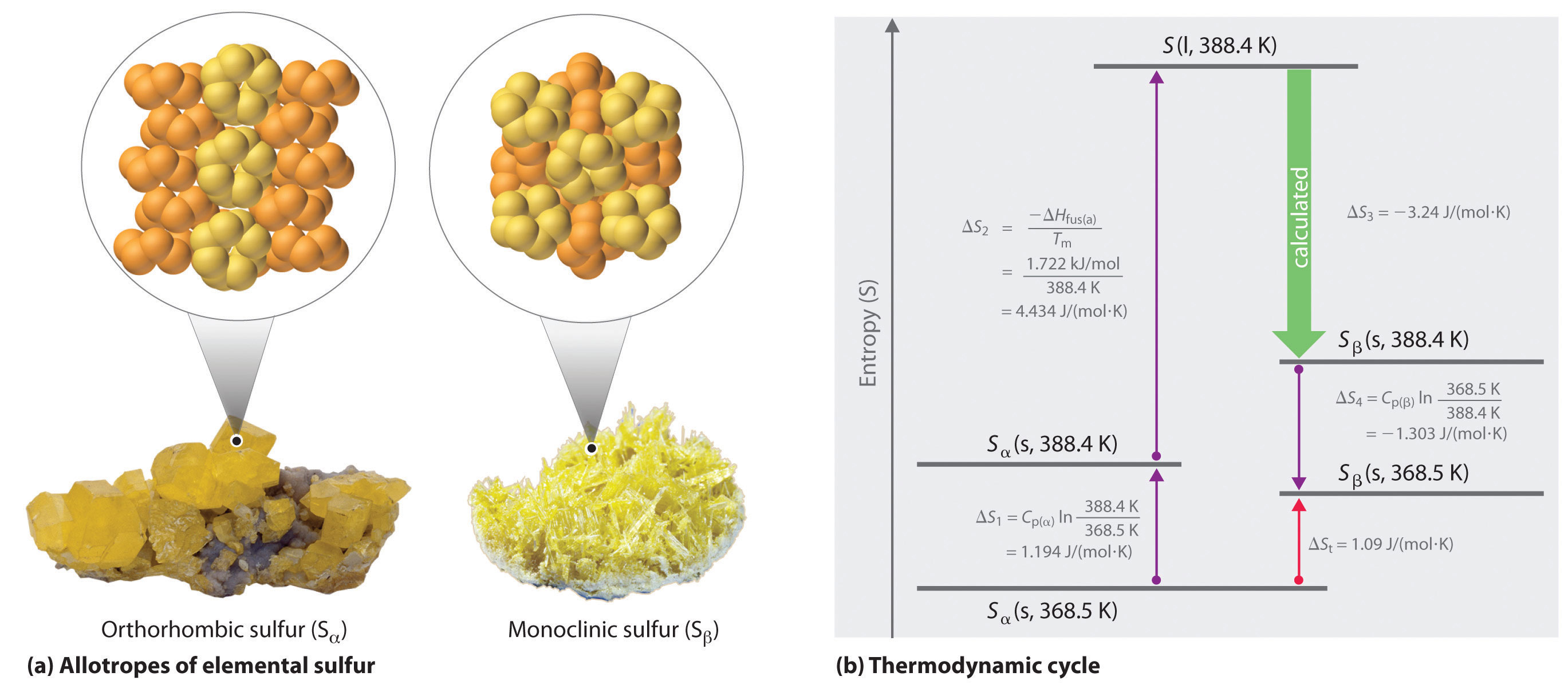
Figura\(\PageIndex{3}\): Dos formas de azufre elemental y un ciclo termodinámico que muestran la transición de una a otra (a) El azufre ortorrómbico (S α) tiene una estructura altamente ordenada en la que los anillos S 8 se apilan en una disposición de “cigüeñal”. El azufre monoclínico (S β) también está compuesto por anillos S 8 pero tiene una estructura menos ordenada. (b) A 368.5 K, S α experimenta una transición de fase a S β. Aunque ΔS 3 no se puede medir directamente, se puede calcular utilizando los valores mostrados en este ciclo termodinámico.
Si conocemos el punto de fusión de S α (T m = 115.2°C = 388.4 K) y ΔS t para la transición de fase global [calculado para ser 1.09 J/ (mol•K) en el ejercicio del Ejemplo 6], podemos calcular ΔS 3 a partir de los valores dados en la parte (b) en la Figura\(\PageIndex{3}\) donde C p (α) = 22.70 J/mol•K y C p (β) = 24.77 J/mol•k (los subíndices en ΔS se refieren a pasos en el ciclo):
\ (\ begin {align}\ Delta S_ {\ textrm t} &=\ Delta S_1+\ Delta S_2+\ Delta S_3+\ Delta S_4
\\ 1.09\;\ mathrm {J/ (mol\ cdot K)} &=C_ {\ textrm p ({\ alpha})}\ ln\ izquierda (\ dfrac {T_2} {T_1}\ derecha) +\ dfrac {\ Delta H_ {\ textrm {fus}}} {T_ {\ textrm m}} +\ Delta S_3+C_ {\ textrm p (\ beta)}\ ln\ izquierda (\ dfrac {T_4} {T_3}\ derecha)
\\ &=22.70\;\ mathrm {J/ (mol\ cdot K)}\ ln\ izquierda (\ dfrac {388.4} {368.5}\ derecha) +\ izquierda (\ dfrac {1.722\;\ mathrm {kJ/mol}} {\ textrm {388.4 K}}\ times1000\ textrm {J/kJ}\ derecha)
\\ +\ Delta S_3+24.77\;\ mathrm {J/ (mol\ cdot K)}\ ln\ izquierda (\ dfrac {368.5} {388.4}\ derecha)
\\ &= [1.194\;\ mathrm {J/ (mol\ cdot K)}] + [4.434\;\ mathrm {J/ (mol\ cdot K)}] +\ Delta S_3+ [-1.303\;\ mathrm {J/ (mol\ cdot K)}]\ end {align}\)
Resolver para ΔS 3 da un valor de −3.24 J/ (mOL•K). Como se esperaba para la conversión de un estado menos ordenado (un líquido) a uno más ordenado (un cristal), ΔS 3 es negativo.
Resumen
- Los cambios de entropía se pueden calcular usando la regla de “productos menos reactivos” o a partir de una combinación de mediciones de capacidad calorífica y valores medidos de entalpías de fusión o vaporización.
La tercera ley de la termodinámica establece que la entropía de cualquier sustancia cristalina perfectamente ordenada en cero absoluto es cero. A temperaturas superiores al cero absoluto, la entropía tiene un valor positivo, lo que nos permite medir la entropía absoluta de una sustancia. Las mediciones de la capacidad calorífica de una sustancia y las entalpías de fusión o vaporización pueden utilizarse para calcular los cambios en la entropía que acompañan a un cambio físico. La entropía de 1 mol de una sustancia a una temperatura estándar de 298 K es su entropía molar estándar (S°). Podemos usar la regla de “productos menos reactivos” para calcular el cambio de entropía estándar (ΔS°) para una reacción usando valores tabulados de S° para los reactivos y los productos.


